双水杨醛合铜(Ⅱ)配合物的合成及抗肿瘤活性*
2017-01-17张冬英
张冬英,韩 潇
(长江职业学院,湖北 武汉 430074)
双水杨醛合铜(Ⅱ)配合物的合成及抗肿瘤活性*
张冬英,韩 潇
(长江职业学院,湖北 武汉 430074)
通过铜(Ⅱ)离子诱导N-亚水杨基-4-氨基-3,5-二溴苯磺酰胺Schiff碱水解合成了双水杨醛合铜(Ⅱ)配合物。结构测试表明,双水杨醛合铜(Ⅱ)配合物是一个以Cu(Ⅱ)离子为对称中心的四配位平面四边形,晶体属于单斜晶系,空间群为P2(1)/n,a=0.8646(3) nm,b=1.1231(2) nm,c=1.1146(4) nm;=74.294(8)°,β=88.6715(6)°,=86.9573(7)°,Z=2,最终偏差因子R1= 0.0592,R2= 0.1770,并通过分子间的作用力形成三维网状空间结构;抗肿瘤活性检测表明,双水杨醛合铜配合物对MCF-7、HepG2、Hela、PC-3和KB肿瘤细胞均有的抑制活性,并强于配体水杨醛。
双水杨醛合铜(Ⅱ)配合物;晶体结构;抗肿瘤活性
铜配合物是金属配合物家族中的重要的一员,其多样的结构与独特的性能使之成为近年来国内外的研究热点[1-3]。在生物体内,多种生物酶都需要依赖铜元素的反应来激活其活性并进一步完成其在生物体内参与新陈代谢过程的催化反应[4-6]。因此,有望将铜配合物开发成各种药物来治疗相应的疾病。事实上,一些具有优秀抗癌,抗菌等活性的铜配合物已经被报道了[7-9]。目前制备铜配合物基本上是用Schiff碱与铜进行螯合来制得相应的铜配合物,尤其是采用水杨醛Schiff碱制备铜配体已经成为铜配体的经典合成法[10-11]。但是,本课题组在研究铜配合物时,却发现在通过乙酸铜水解水杨醛缩3,5-二溴对氨基苯磺酰胺Schiff碱后能与其水解产物水杨醛反应形成双水杨醛合铜(Ⅱ)配合物(图1),并得到其晶体结构。随后,通过MTT法来测定双水杨醛合铜(Ⅱ)配合物对抗乳腺癌MCF-7、肝癌HepG2、宫颈癌Hela、前列腺癌PC-3和口腔表皮样癌KB细胞的抑制活性。结果表明,配合物对五种肿瘤细胞均较强的抑制活性,并强于配体水杨酸。
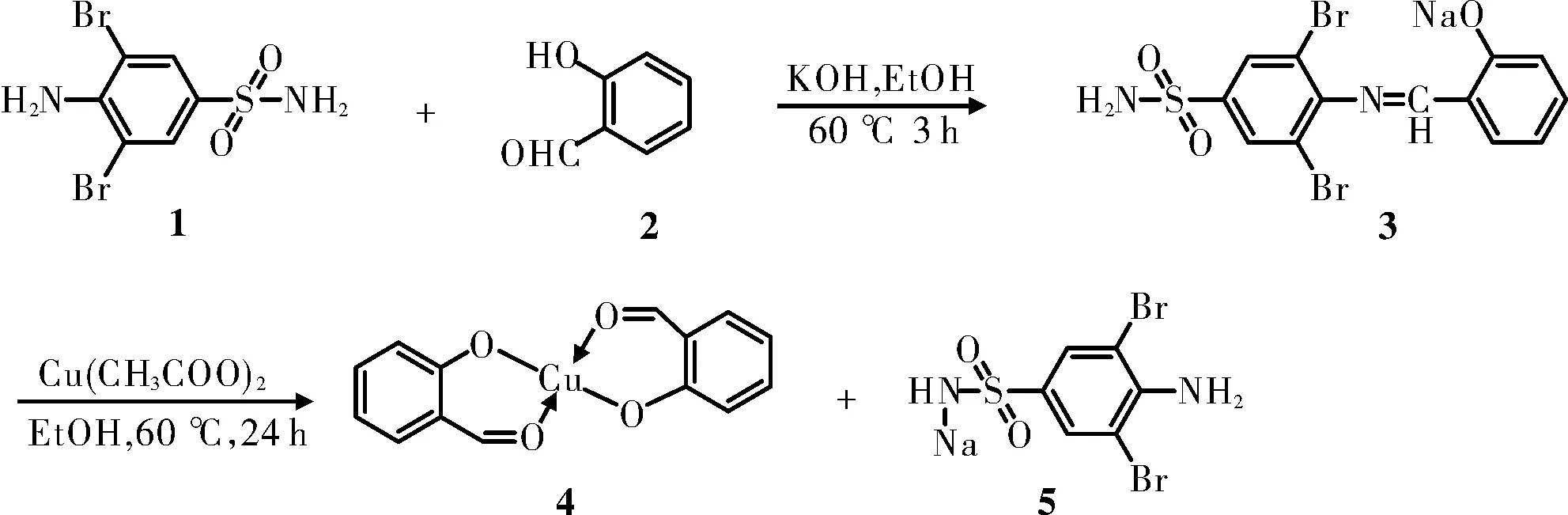
图1 铜配合物的合成路线
1 仪器与试剂
1.1 仪器
BrukerAM-400Hz型核磁共振仪,TMS内标;X-射线晶体结构测定采用Bruker CDD Area Detector衍射仪,德国Bruker公司;PE2400II型元素分析仪,美国PE公司;UV-3600型紫外光谱仪,日本岛津公司;LS-55型荧光光谱仪,美国PE公司;纳米傅里叶红外光谱,美国Neaspec公司;FA1104N型电子天平,上海民桥精密科学仪器有限公司;DF-101S集热式恒温加热磁力搅拌器,河南巩义市予华仪器有限责任公司;XR4显微熔点测定仪,上海光学仪器厂;BB16/BB5060仪器CO2培养箱,上海力创科学仪器有限公司;CKX31型倒置显微镜,奥林巴斯公司;ELx800通用酶标仪,美国BioTek公司。
1.2 试剂
水杨醛 (质量分数≥99%,Aladdin,货号:S103742);3,5-二溴对氨基苯磺酰胺(质量分数≥95%),北京伊诺凯科技有限公司,货号:BD82463;氢氧化钠(质量分数≥95%),Aladdin,货号:S111498;乙酸铜(质量分数≥95%),Aladdin,货号:C106651;DMEM培养基、胎牛血清,购自Hyclone公司;二甲基亚砜等其他试剂均为分析纯;MCF-7、HepG2、Hela、PC-3和KB细胞株,购自上海细胞典藏中心,本实验室冻存使用。
2 方法与结果
2.1 合成部分
2.1.1N-亚水杨基-4-氨基-3,5-二溴苯磺酰胺Schiff 碱(3)的合成
氩气保护下,将水杨醛(30.0 mmol)、3,5-二溴对氨基苯磺酰胺 (30.0 mmol) 和KOH加入到无水乙醇(25 mL)中,加热至60 ℃反应3 h,析出黄色的沉淀,过滤、真空干燥得到黄色的粉末,产率为78%。1H NMR (400 MHz, CDCl3):δ8.52 (s, 1H), 8.17 (s, 2H), 7.76 (d,J= 8.4 Hz, 1H), 7.61 (m, 1H), 7.23 (t,J= 8.8 Hz, 1H), 7.17 (d,J= 8.4 Hz, 1H)。
2.1.2 双水杨醛合铜(Ⅱ)的合成
将Schiff 碱3溶解到乙醇 (20 mL)中,加热至60 ℃后加入乙酸铜搅拌反应24 h,过滤,滤液,室温放置,缓慢挥发,50天后,析出棕褐色菱形的单晶。
2.2 晶体结构测定
选取尺寸大小为0.21 mm×0.14 mm×0.09 mm的配合物单晶置于Bruker Smart APEX单晶仪上,采用CDD面探测器,用石墨单色化的MoK射线 (λ=0.71073 Å),应用Crystalclear 程序在温度296(2) K,2.16°≤θ≤27.44°范围内,以w/2θ扫描方式收集晶体结构数据,共收集到衍射点4468个,其中独立衍射点1337个(Rint=0.0264)。全部衍射资料经Lp因子和经验吸收校正。晶体结构由直接法和差值 Fourier 合成法解出,并进行全矩阵最小二乘法修正,对全部非氢原子的坐标和各向异性温度因子进行了修正,氢原子则通过理论计算加入。晶体结构计算和修正均由 SHELXL-97程序完成,相关数据见表1。配合物的主要键长和键角列于表2中,分子的结构图、晶胞堆积图分别见图2和图3。
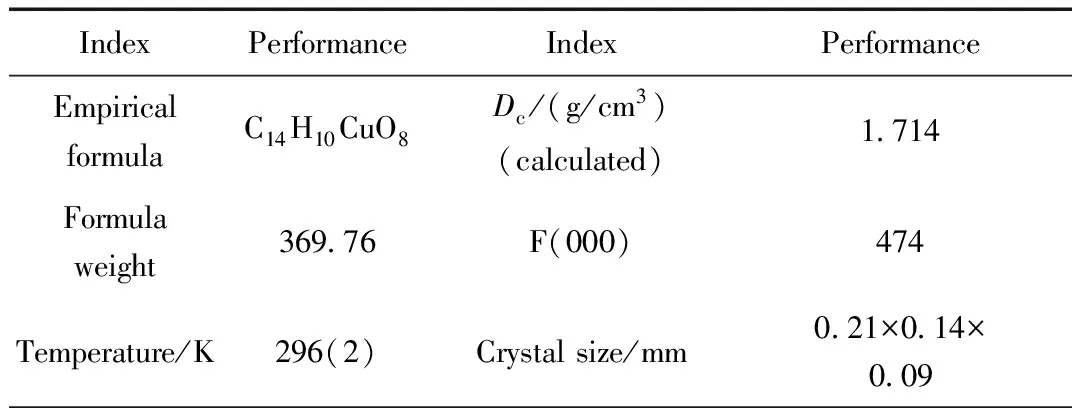
表1 配合物的晶体数据和结构精修参数
续表1
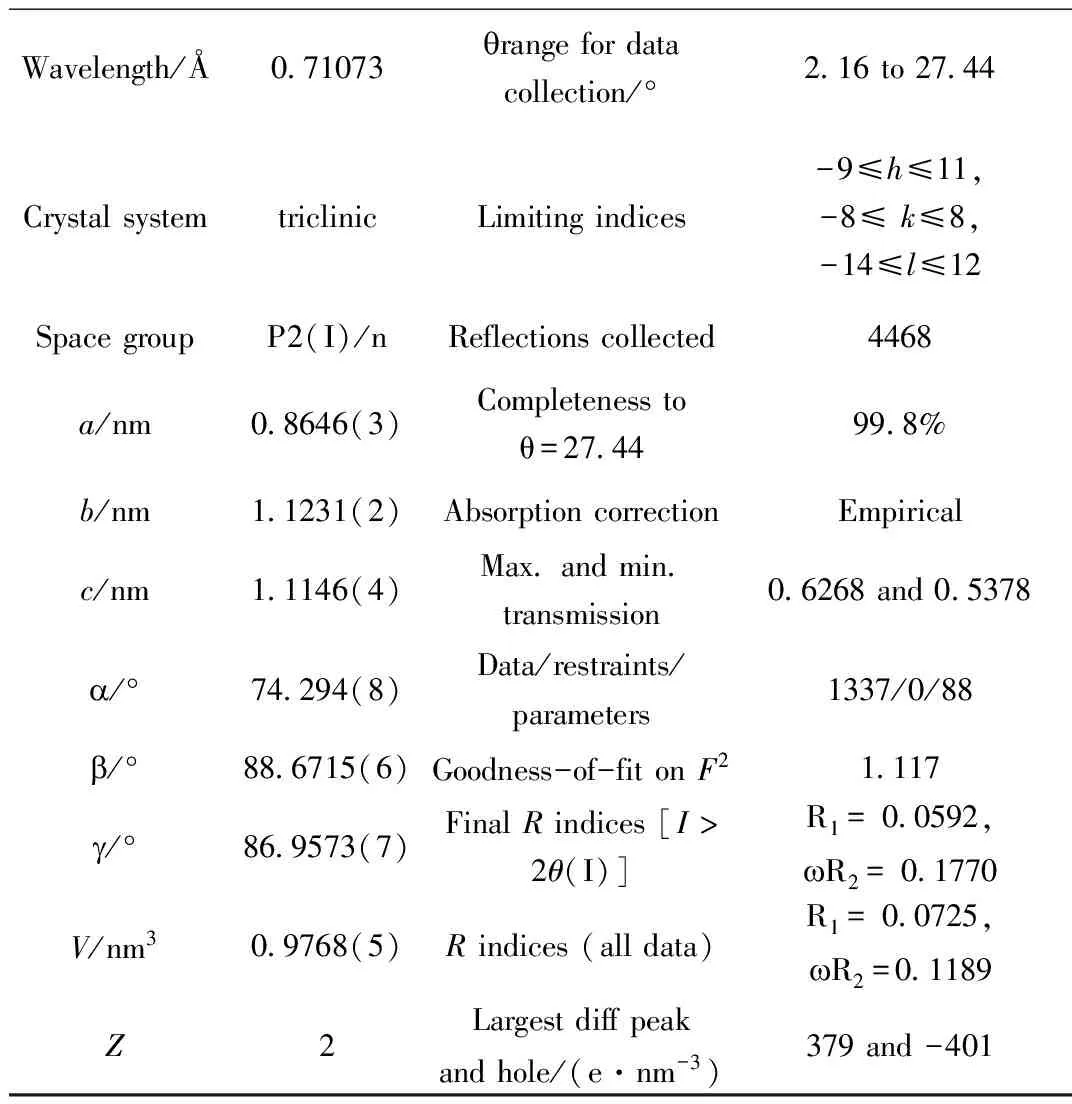
Wavelength/Å0 71073qrangefordatacollection/°2 16to27 44CrystalsystemtriclinicLimitingindices-9≤h≤11,-8≤k≤8,-14≤l≤12SpacegroupP2(I)/nReflectionscollected4468a/nm0 8646(3)Completenesstoθ=27 4499 8%b/nm1 1231(2)AbsorptioncorrectionEmpiricalc/nm1 1146(4)Max andmin transmission0 6268and0 5378a/°74 294(8)Data/restraints/parameters1337/0/88b/°88 6715(6)Goodness-of-fitonF21 117g/°86 9573(7)FinalRindices[I>2θ(I)]R1=0 0592,wR2=0 1770V/nm30 9768(5)Rindices(alldata)R1=0 0725,wR2=0 1189Z2Largestdiffpeakandhole/(e·nm-3)379and-401
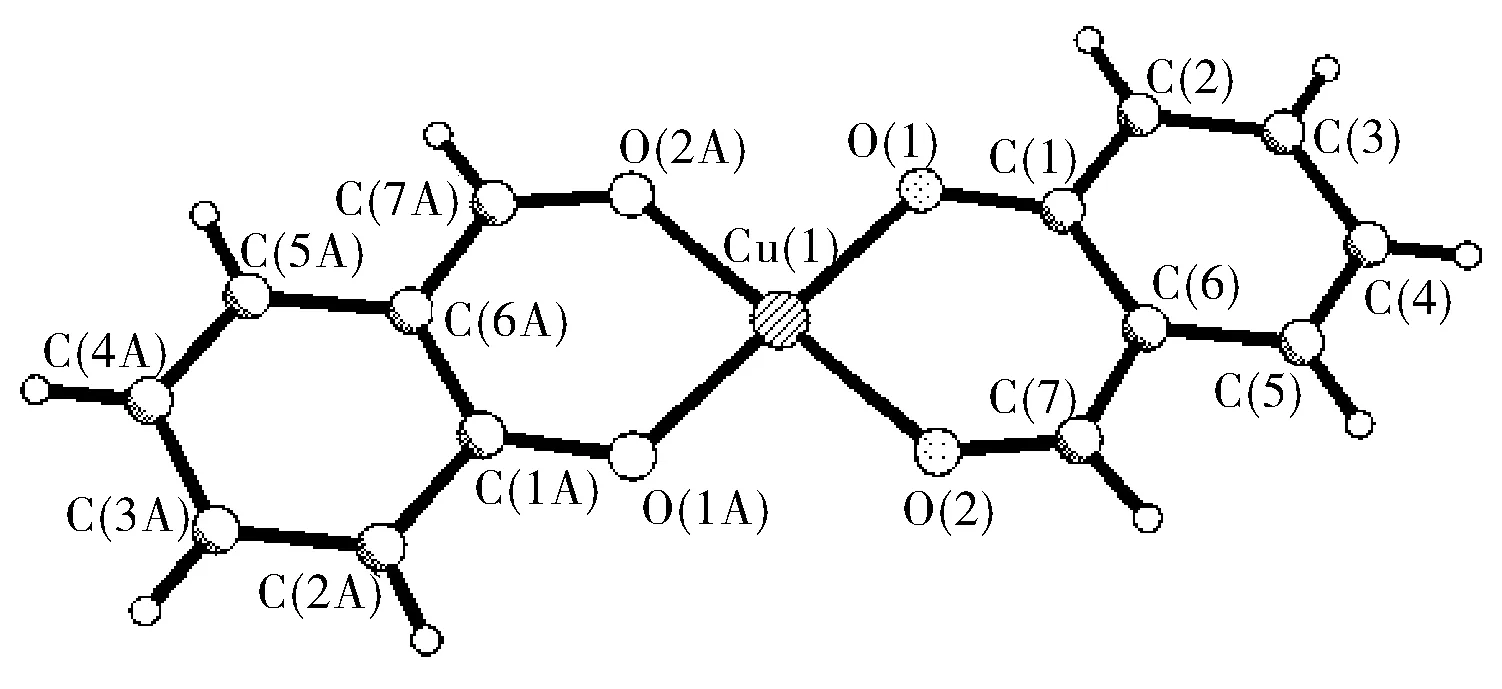
图2 铜(Ⅱ)配合物的晶体结构
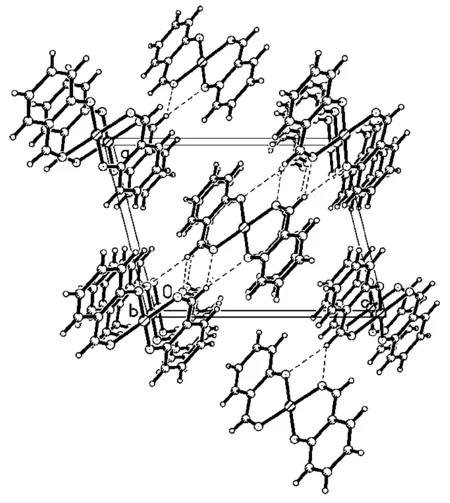
图3 由氢键及-堆积作用形成的配合物结构
由晶体结构图 (图2)可以看出,该配合物的分子式为:[Cu(C14H10O4)],配合物晶体为中心对称的单核铜单元,其水杨醛配体采取双齿配位方式,中心金属铜离子采取常见的四配位平面四边形构型,配位原子来自两个水杨醛的4个氧原子[O(1), O(2), O(1A), O(2A)]。O(1)-Cu(1)-O(1A)、O(2A)-Cu(1)-O(2)的键角均为180°,∠O(1)-Cu(1)-O(2A)键角是86.59(6)°,∠O(1A)-Cu(1)-O(2A)键角是93.42(6)°,∠O(1)-Cu(1)-O(2) 键角是93.41(6)°,∠O(1A)-Cu(1)-O(2)键角是86.58(6)°,这些键角总和360°,说明O(1),O(2),O(1A),O(2A)共面性好;Cu(1)-O(1)、Cu(1)-O(1A)键长均为0.1889(11)°稍短于Cu(1)-O(2)、Cu(1)-O(2A)键长0.1942(13)°,说明苯环上-OH上的O与金属的配位能力比苯环上-CHO上的O更强。Cu-O键长均与其他铜配合物的相应键长相近[14-15]。从晶胞堆积图 (图3)可知,分子之间通过范德华作用力连成一维链状结构,通过氢键连接成二维网状结构,相邻的[Cu(C7H5O2)2]分子单元中的苯环分子间分别存在π-π堆积作用,构成三维网状结构。
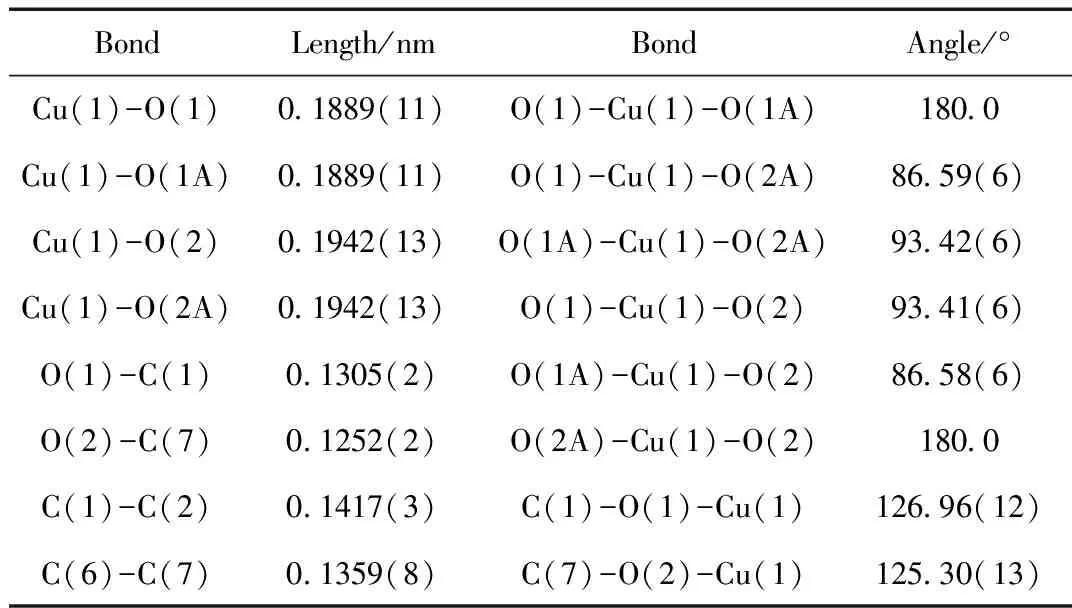
表2 配合物的部分键长键角
2.3 元素分析
将水杨醛及双水杨醛合铜(Ⅱ)配合物进行元素分析,结果见表3。由表3可知,合成的双水杨醛合铜(Ⅱ)配合物中各元素的实测值与理论值基本一致。

表3 配体及铜(Ⅱ)配合物的元素分析结果
注:括号内为理论值。
2.4 配合物的红外光谱
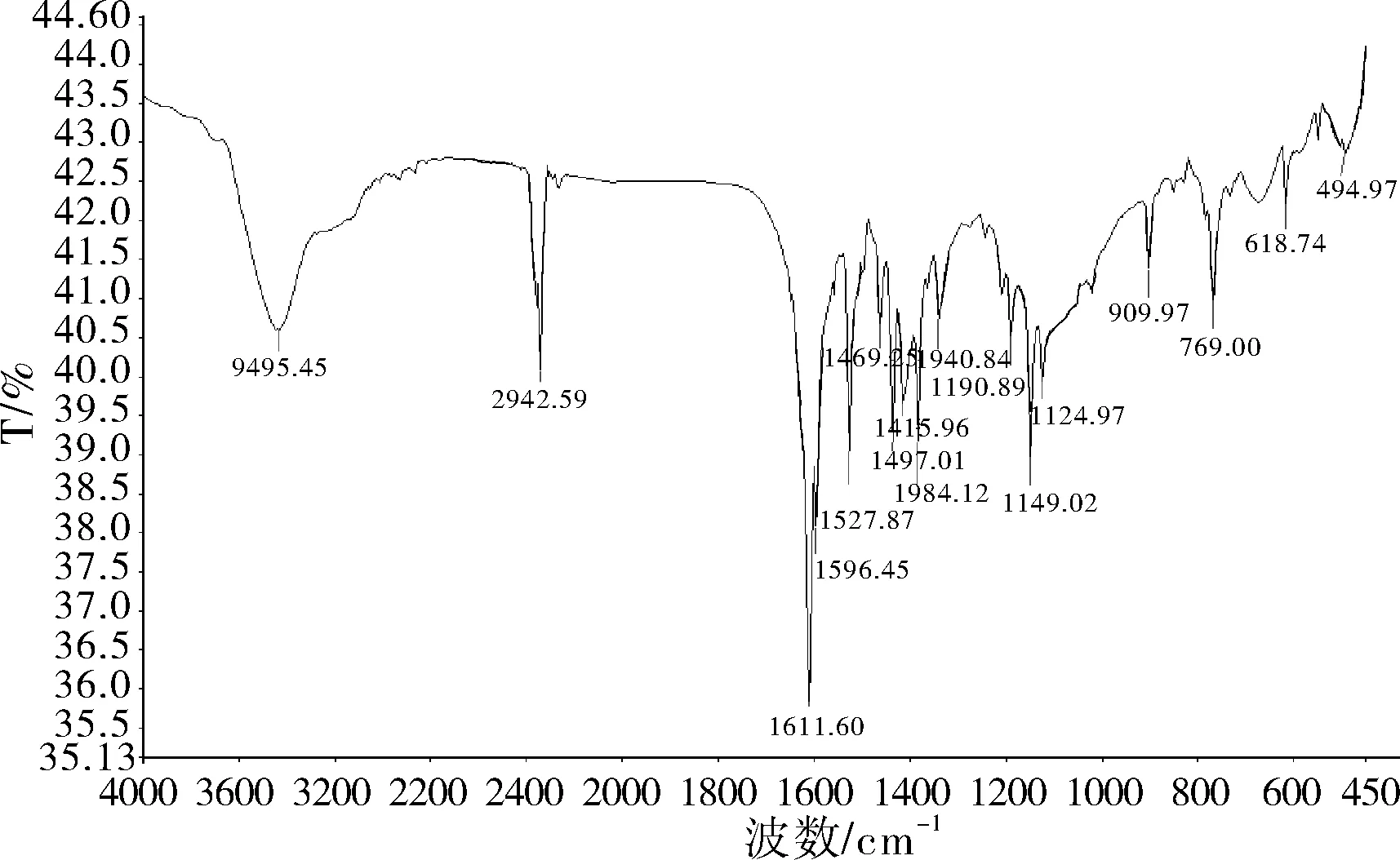
图4 铜(Ⅱ)配合物的红外光谱
以KBr压片,在450~4000 cm-1范围内测定了配合物的红外光谱 (图4)。自由配体中2-羟基苯甲醛上的酚羟基在3610 cm-1出现O-H振动吸收峰,在1715~1695 cm-1有-CHO振动吸收峰;而在其双水杨醛合铜(Ⅱ)配合物中酚羟基的吸收峰消失,同时-CHO蓝移到1596.59 cm-1。这表明水杨醛的羟基的氧和-CHO上的羰基氧参与了配位。此外,配合物在3435.45 cm-1,1611.60 cm-1,903.97 cm-1,769.00 cm-1出现的振动吸收峰归属于苯环的振动吸收峰;在2342.45 cm-1出现的吸收峰归属于醛基上C-H的振动吸收峰;在1190.89 cm-1出现的吸收峰归属于酚羟基上C-O的振动吸收峰 。
2.5 抗增殖活性测试
选取乳腺癌MCF-7、肝癌HepG2、宫颈癌Hela、前列腺癌PC-3和口腔表皮样癌KB细胞为测试细胞株,采用MTT法对合成的查耳酮类化合物进行抗乳腺癌活性评价。取对数生长期的测试细胞株悬浮于含10%胎牛血清的无酚红DMEM培养基中,铺至96孔细胞培养板中。待细胞完全贴壁后,弃去原培养液,加入100 μL的含有测试药物的培养液培养3天后,每孔加入30 μL 5 mg/mL MTT,置于37 ℃、5% CO2培养箱中继续孵育4 h,然后每孔加入100 μL 二甲亚砜(DMSO)溶解。使用酶标仪在490 nm波长测定每孔的吸光度(OD)值,分析实验结果,并计算出IC50。
体外抗肿瘤活性结果表明 (图5),双水杨醛合铜(Ⅱ)配合物对乳腺癌MCF-7、肝癌HepG2、宫颈癌Hela、前列腺癌PC-3和口腔表皮样癌KB细胞展现出优秀的抗肿瘤活性,其IC50分别为(6.5 ± 0.25)、(5.2 ± 0.05)、(7.1 ± 1.19)、(4.96 ± 0.32)、(6.6 ± 0.94)mol/L,而配体水杨醛对这五种肿瘤细胞的抑制活性较弱 (IC50均大于30mol/L),这些结果说明在配体中引入铜元素能够提高抗肿瘤活性,值得进一步研究。
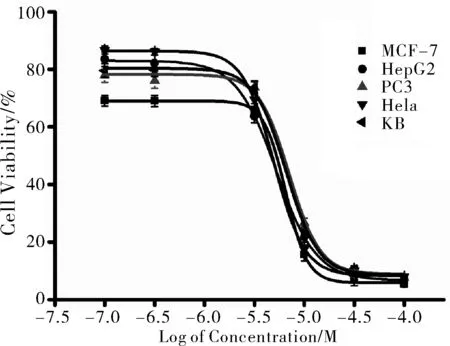
图5 配合物抗肿瘤的量-效曲线
3 讨 论
自从第一个抗癌金属配合物类药物顺铂上市以来,目前已有数十个金属配合物进入临床试验来治疗个各种癌症。然而,大部分金属配合物是以Schiff碱作为配体,其他类型的配合物却较少被报道。为了寻找新型、高效、低毒的金属配合物,本文应用Cu(Ⅱ)盐水解N-亚水杨基-4-氨基-3,5-二溴苯磺酰胺Schiff碱合成了双水杨醛合铜(Ⅱ)配合物,其结构经过元素分析、红外光谱技术和X射线单晶衍射进行确证;同时,利用紫外-可见光吸收光谱、荧光激发和发射光谱研究了其光物理性能,并初步筛选了该配合物的抗肿瘤活性。
从体外抗肿瘤活性实验结果可以发现双水杨醛合铜(Ⅱ)配合物对MCF-7、HepG2、Hela、PC-3和KB五种肿瘤细胞均有较强的抑制活性 (IC50< 8mol/L),并强于配体水杨醛 (IC50> 30mol/L)。本研究为开发具有抗肿瘤活性的新型结构铜(Ⅱ)配合物提供了新的合成方法,并丰富了铜(Ⅱ)配合物的种类。
[1] Jana S, Bhowmik S, Harms K, et al. Theoretical study on the degree of delocalization of unpaired spin in two mixed valence copper(II/I) complexes with isomeric chelating diamines and iodide[J]. Inorganica Chimica Acta, 2016,451(1):16-22.
[2] Kumar R, Yadav A, Mahiya K, et al.Copper(Ⅱ) complexes with box or flower type morphology: Sustainability versus perishability upon catalytic recycling [J]. Inorganica Chimica Acta, 2016,450(24):279-284.
[3] 郑玉萍,范玉华,张霞,等.一种新型希夫碱Cu(Ⅱ)配合物的合成、表征及与DNA的相互作用[J].中国海洋大学学报,2011,41(9):77-82.
[4] Pogozelski WK, Tullius TD. Oxidative Strand Scission of Nucleic Acids: Routes Initiated by Hydrogen Abstraction from the Sugar Moiety [J]. Chem Rev, 1998,98(3):1089-1108.
[5] Marzano C, Pellei M, Tisato F, et al. Copper complexes as anticancer agents[J]. Anticancer Agents Med Chem, 2009,9(2):185-211.
[6] 周建良,春晓改,周琳娇.新型三元铜配合物的合成、晶体结构及与DNA的相互作用[J].无机化学,2010,26(4):645-650.
[7] Tardito S, Marchiò L. Copper compounds in anticancer strategies [J]. Curr Med Chem, 2009, 16(11):1325-1348.
[8] Suksrichavalit T, Prachayasittikul S, Nantasenamat C, et al. Copper complexes of pyridine derivatives with superoxide scavenging and antimicrobial activities[J]. Eur J Med Chem, 2009,44(8):3259-3265.
[9] Jiang Q, Xiao N, Shi PF, et al. Design of artificial metallonucleases with oxidative mechanism [J]. Coordin Chem Rev,2007,251(15/16):1951-1972.
[10]张晓松,丁国华,齐巧珍.3,5-二氯水杨醛缩邻苯二胺铜配合物的合成、晶体结构及光谱学性质[J].应用化学,2010,27(11):1334-1338.
[11]李翠勤,孟祥荣,张鹏,等.水杨醛缩胺类双席夫碱过渡金属配合物的合成与表征[J].化学与生物工程,2011,28(7):55-57.
Synthesis and Anti-tumor Activity of Bis(salicylaldehydato)-Cu(Ⅱ) Complex*
ZHANGDong-ying,HANXiao
(Changjiang Polytechnic, Hubei Wuhan 430074, China)
Bis(salicylaldehydato)-Cu(Ⅱ) complex was synthesizedviahydrolysis ofN-salicylidene-4-amino-3,5-bibromoosulfanilamide Schiff base by copper(Ⅱ) ions. Structure determination showed that bis(salicylaldehydato)-Cu(Ⅱ) complex was four-coordinated complex to form plane quadrilateral with a symmetric center of Cu(Ⅱ) ion, and the molecular formula was Cu(C14H10O4). The crystal belonged to monoclinic system, space group P2(1)/n, with cell parametersa=0.8646(3) nm,b=1.1231(2) nm,c=1.1146(4) nm,=74.294(8)°,β=88.6715(6)°,= 86.9573(7)°,Z=2, the final deviation factor R1=0.0592,R2=0.1770, and the three-dimensional network structure was formedviathe intermolecular forces. Additionally, the complex displayed significant antiproliferative effect on MCF-7, HepG2, Hela, PC-3and KB cells, which showed the more potency than ligand salicylaldehyde.
bis(salicylaldehydato)-Cu(Ⅱ) complex; crystal structure; anti-tumor activity
湖北技能型人才培养研究中心重点研究课题(2016JA003)。
张冬英(1964-),女,高级讲师,主要从事物理化学研究。
韩潇, 男, 讲师,主要从事抗肿瘤药物研究。
O614
A
1001-9677(2016)024-0039-04
