体外胃癌间质成纤维细胞模型建立和生物学特性初步研究
2017-01-16毕建威
柴 华,张 浩,毕建威
·基础医学· ·论著·
体外胃癌间质成纤维细胞模型建立和生物学特性初步研究
柴 华,张 浩,毕建威
目的 采用原代培养胃间质成纤维细胞(human gastric mucosal fibroblasts,HGMF),构建体外胃癌间质成纤维细胞模型,研究其生物学特性。方法 将调整培养条件的胃癌细胞系MKN- 45的培养上清液加入HGMF中培养,使其发生转化。MTT法检测其细胞增殖,ELISA方法测定其肝细胞生长因子(hepatocyte growth factor,HGF)、转化生长因子-β1(transforming growth factor beta 1,TGF-β1)、趋化因子9(chemokine ligand 9,CXCL9)、趋化因子5(chemokine ligand 5,CCL5)的表达变化,RT-PCR检测其端粒酶活性,BSA法检测蛋白合成能力。结果 胃癌细胞培养上清液与HGMF共培养可使其发生转化,转化HGMF细胞增殖能力(0.860±0.055)较HGMF(0.639±0.074)增强,差异有统计学意义(P<0.05),HGF、TGF-β1、CCL5和CXCL9表达增强,差异有统计学意义(P<0.01),端粒酶活性增高,差异有统计学意义(P<0.01),蛋白质合成能力增强,差异有统计学意义(P<0.01)。结论 转化成纤维细胞与亲代细胞相比具有更强的生物学活性和分裂活性,蛋白质合成增强,能表达和分泌更多的与胃癌细胞生长相关的生长因子和趋化因子。
成纤维细胞;胃癌;转化
胃癌来源于上皮组织,上皮细胞与间质微环境相互作用,间质细胞(绝大部分为成纤维细胞)显示出活跃的生物学特性:如调控胃癌细胞的增殖信号新生血管生成,肿瘤发生与肿瘤细胞本身的恶性增殖和间质之间的相互作用密不可分,肿瘤间质在整个过程中发挥了主动的作用。成纤维细胞是肿瘤基质成分中主要的细胞,肿瘤组织结构和功能的动态平衡有赖于该细胞维持[1]。微环境对细胞成瘤潜能有很大影响,恶性细胞如果生长于特定的微环境中可被诱导保持分化状态[2-3]。以往研究认为成纤维细胞能对来源于肿瘤细胞的信号改变作出应答,这种作用是一个被动过程,而新近的报道表明肿瘤基质细胞可首先发生遗传改变,从而主动参与和发动肿瘤的发生和进展过程[4]。
胃癌细胞与其微环境中的成纤维细胞关系密切,一方面胃癌细胞分泌的功能蛋白可影响周围成纤维细胞的生物学特性,使其发生恶性改变;另一方面发生变化的成纤维细胞通过旁分泌的方式产生的蛋白也可作用于癌细胞,促进细胞生长和血管形成。两者相互作用有级联放大效应,增加肿瘤的恶性程度,但是目前对于产生作用的蛋白种类以及作用机制尚不清楚,本实验拟建立体外的胃癌成纤维细胞模型,为筛选差异蛋白提供细胞基础。
1 材料与方法
1.1 主要试剂及材料
原代培养取材由第二军医大学附属长海医院手术室提供,手术由长海医院普外科实施,选取进展期胃癌标本。标本取材通过长海医院伦理委员会批准,并签署知情同意书。DMSO、RPMI-1640、0.25% EDTA-胰蛋白酶、胶原酶I购自美国Sigma公司;青、链霉素购自美国R&D公司;胎牛血清购自美国Genmed公司;胃癌MKN- 45细胞株由东方肝胆外科医院实验室提供;端粒酶活性检测试剂盒购自碧云天生物;MTT、BCA试剂盒购自博光生物;ELISA检测试剂盒购自博奥生物;Gentl MACS组织处理机购自美天妮公司。
1.2 研究方法
1.2.1 原代成纤维细胞培养 酶消化法培养,取材距离癌组织>10 cm以上的正常胃黏膜组织。贴壁生长的细胞经优势生长法纯化,免疫组织化学鉴定[5]。
1.2.2 体外构建成纤维细胞模型 采取共培养法。复苏MKN- 45细胞株,调整培养液RPMI 1640的FCS浓度为10%,PH值为7.4,培养箱37℃、5%CO2,3 d后吸取上清液,过滤杂质并调整培养液PH值和血清浓度,-20℃低温保存。将采集的MKN-45的培养上清液加入细胞浓度为6×104/ml原代成纤维细胞中培养至20代,平均每2~3 d传代1次。细胞浓度为6×104/ml的原代成纤维细胞同步培养。
1.2.3 细胞增殖生长情况 观察采用MTT法,ELISA法检测肝细胞生长因子(HGF)、转化生长因子TGF-β1)、趋化因子9(CXCL9)、趋化因子5(CCL5)表达变化,端粒酶活性检测采用RT-PCR法,细胞总蛋白质含量检测采用BSA法。
1.3 统计学处理
计数资料采用χ2检验;计量资料采用t检验、方差分析。数据用SPSS 19.0统计软件分析。P<0.05表示差异有统计学意义。
2 结果
2.1 获取转化HGMF
消化法原代分离出人胃黏膜成纤维细胞,免疫组化染色结果为波形丝蛋白(+),角蛋白(-)和结蛋白(-)。胃癌细胞培养上清液与正常成纤维细胞共培养构建体外胃癌间质成纤维细胞模型,得到转化HGMF。
2.2 细胞增殖动力学测定
转化HGMF增殖较HGMF明显加快,差异有统计学意义(P<0.01)。见图1。

注:HGMF:胃间质成纤维细胞图1 MTT法测定2种细胞的OD值
2.3 HGMF和转化HGMF中HGF、TGF-β1、CCL5和CXCL9的表达
转化HGMF和HGMF培养上清液中HGF、TGF-β1、CCL5和CXCL9的表达值见表2。
表2 HGMF和转化HGMF中HGF、TGF-β1、CCL5和CXCL9的表达(pg/L,x±s)
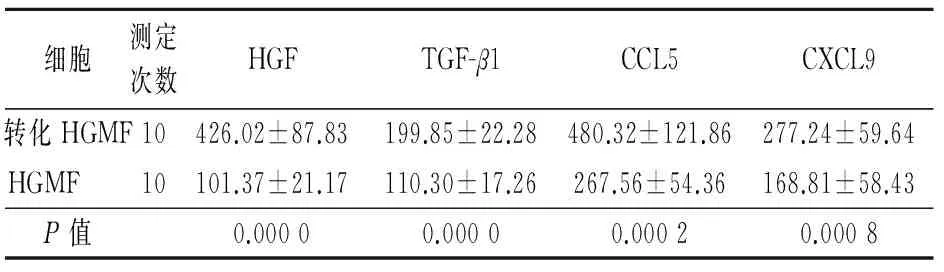
细胞测定次数HGFTGF-β1CCL5CXCL9转化HGMF10426.02±87.83199.85±22.28480.32±121.86277.24±59.64HGMF 10101.37±21.17110.30±17.26267.56±54.36168.81±58.43P值0.00000.00000.00020.0008
注:HGMF:胃间质成纤维细胞,HGF:肝细胞生长因子,TGF-β1:肝细胞生长因子-β1,CCL5:趋化因子5,CXCL9:趋化因子9
2.4 端粒酶活性测定
10次测定得到的光密度(OD)值见表3。转化HGMF和HGMF分别为0.860±0.055和0.639±0.074,前者明显增强(t=7.515,P=0.000)。阴性对照OD=0.015,阳性对照OD=1.29。见表3。
表3 2种细胞端粒酶活性测定的OD值

细胞测定次数12345678910转化HGMF0.7850.8210.9430.8750.8030.8050.8940.8870.8550.932HGMF 0.6630.6460.5970.6870.5240.7080.5840.6860.7550.548
注:OD:光密度,HGMF:胃间质成纤维细胞
2.5 细胞总蛋白测定
总蛋白检测标准液一元线性方程为y=0.697 6x+0.013 5,各浓度与吸光度值相关值R2=0.988 7,差异有统计学意义(P<0.05),吸光度符合标准曲线。在该条件下测得5×105个GCAF蛋白浓度明显高于HGMF,分别为(0.442±0.075) g/L和(0.194±0.020) g/L(t=7.091,P=0.001)。
3 讨论
成纤维细胞是主要的基质细胞成分,也是产生基质蛋白的重要场所,支持肿瘤的基质形成与肿瘤生长关系密切。受肿瘤微环境影响,成纤维细胞出现活化异常,改变了原有的调控状态,可影响胃癌细胞的分裂和侵袭进程。基于成纤维细胞在胃癌形成和发展中的重要作用,有学者提出抗肿瘤基质新的治疗方向,即靶向成纤维细胞的策略[6]。有研究表明,肿瘤细胞与成纤维细胞合并培养,观察两者表型变化情况,可模拟成纤维细胞活化进程[7]。胃癌细胞系MKN-45是一种侵袭能力较强的胃癌细胞,能以实体瘤或腹水瘤形式生长,因其可分泌功能蛋白对成纤维细胞产生作用,促进正常成纤维细胞发生转化。微生物学首先引入转化概念,即依赖于新遗传物质摄入的变化,而培养细胞的转化是指自发性的或诱导引起的永久性表型改变。本实验选择培养代数为20代,考虑到成纤维细胞的遗传稳定性,如果培养代数过少,则很难产生转化效应,而培养代数过长,即使没有实验干预,连续培养的成纤维细胞也可能自发性发生转化。
胃癌细胞MKN-45培养上清液和人胃粘膜成纤维细胞共同培养后,促使成纤维细胞发生恶性转化,在很多方面有异于人胃粘膜成纤维细胞的活化特征。端粒酶活性升高表明有更多细胞处于S期,因为细胞在G1/G0期开始表达端粒酶,S期达高峰[8]。实验表明转化HGMF总蛋白量明显增加,原因是转化细胞以旁分泌方式分泌功能因子刺激肿瘤细胞生长[9]。成纤维细胞是体内HGF和TGF-β1的主要合成场所。HGF受体c-Met表达于上皮细胞,其信号通路的失常可导致肿瘤细胞的侵袭性生长。TGF-β1具有广泛的生物学作用,TGF-β1的高水平表达与肿瘤的侵袭转移关系密切[10]。CXCL9和CCL5是目前已报道的与胃癌相关的趋化因子,不仅可自分泌系统直接刺激肿瘤细胞增殖,也可激活机体的特殊免疫应答,调控肿瘤血管生成。趋化因子诱导靶细胞趋化性迁移,参与细胞信号转导,微环境中成纤维旁分泌是趋化因子/受体的一个重要来源[11-12]。结果表明以上与胃癌密切相关的生长因子和趋化因子在转化成纤维细胞上清液中表达上调,提示其生物学特性活跃。
以往研究正常成纤维细胞和肿瘤相关成纤维细胞之间的差异需要原代培养出两种细胞,难度较大。本实验用胃癌细胞MKN-45培养上清液和人胃黏膜成纤维细胞共同培养并促使后者发生转化,为进一步进行蛋白质组学研究,筛选出差异蛋白提供了实验基础。
[1] Bhowmick NA, Neilson EG, Moses HL.Stromal fibroblasts in cancer initiation and progression[J]. Nature, 2004, 432(7015): 332-337. DOI:10.1038/nature03096.
[2] Kenny PA, Bissell MJ. Tumor reversion: correction of malignant behavior by microenvironmental cues[J]. Int J Cancer, 2003, 107(5): 688-695. DOI:10.1002/ijc.11491.
[3] Radisky DC, Bissell MJ. Cancer. Respect thy neighbor[J]. Science, 2004, 303(5659): 775-777. DOI:10.1126/science.1094412.
[4] Waite K A, Eng C. From developmental disorder to heritable cancer: it′s all in the BMP/TGF-βfamily[J]. Nature Rev Genet, 2003, 4(10): 763-773. DOI:10.1038/nrg1178.
[5] 张浩,申晓军,唐古生,等. 人胃黏膜成纤维细胞原代培养条件的优化[J]. 中华实验外科杂志, 2009, 26(5): 610-611. DOI:10.3760/cma.j.issn.1001-9030.2009.05.024.
[6] Mersmann M, Schmidt A, Rippmann JF, et al. Human antibody derivatives against the fibroblast activation protein for tumor stroma targeting of carcinomas[J]. Int J Cancer, 2001, 92(2): 240-248.
[7] Anderson IC, Mari SE, Broderick RJ, et al. The angiogenic factor interleukin 8 is induced in non-small cell lung cancer/pulmonary fibroblast cocultures[J]. Cancer Res, 2000, 60(2): 269-272.
[8] Holt SE, Wright WE, Shay JW. Regulation of telomerase activity in immortal cell lines[J]. Mol Cell Biol, 1996, 16(6): 2932-2939. DOI:10.1128/mcb.16.6.2932.
[9] Satyamoorthy K, Li G, Vaidya B, et al. Insulin-like growth factor-1 induces survival and growth of biologically early melanoma cells through both the mitogen-activated protein kinase and beta-catenin pathways[J]. Cancer Res, 2001, 61(19): 7318-7324.
[10] Lin Y, Kikuchi S, Obata Y, et al. Serum levels of transforming growth factor beta1 are significantly correlated with venous invasion in patients with gastric cancer+.[J]. J Gastroenterol Hepatol, 2006, 21(2): 432-437. DOI:10.1111/j.1440-1746.2005.03939.x.
[11] Ohtani H, Jin Z, Takegawa S, et al. Abundant expression of CXCL9 (MIG) by stromal cells that include dendritic cells and accumulation of CXCR3+ T cells in lymphocyte-rich gastric carcinoma[J]. J Pathol, 2009, 217(1): 21-31. DOI:10.1002/path.2448.
[12] Mizukami Y, Kono K, Kawaguchi Y, et al. CCL17 and CCL22 chemokines within tumor microenvironment are related to accumulation of Foxp3+ regulatory T cells in gastric cancer[J]. Int J Cancer, 2008, 122(10): 2286-2293. DOI:10.1002/ijc.23392.
(本文编辑:彭润松)
Establishment of vitro cell model of human gastric mucosal fibroblasts and preliminary exploration of its biological features
Chai Hua, Zhang Hao, Bi Jianwei
(DepartmentofGeneralSurgery,ShanghaiJiangwanHospital,Shanghai200434,China)
Objective To establish vitro cell model of human gastric mucosal fibroblasts (HGMF) in gastric cancer and explore its biological features.MethodsHGMF were cultured with the regulated supernatant of MKN-45 cells, facilitating its transformation. Cell proliferation was detected by MTT assay. The expressions of hepatocyte growth factor(HGF), transforming growth factor beta 1(TGF-β1), chemokine ligand 5 (CCL5)and chemokine ligand 9(CXCL9)were detected by ELISA. The activity of telomerase and the ability to synthesize proteins were detected by RT-PCR and BSA assay respectively.ResultsSupernatant of MKN-45 could induce HGMF transformation. The ability of cell proliferation was enhanced (P<0.05), and the expression levels of HGF, TGF-β1, CCL5 and CXCL9 were also increased (P<0.01). Telomerase activity and the ability to synthesize proteins were also enhanced respectively (P<0.01).ConclusionDetection results suggested that the transformed HGMF seemed to display higher biological activity, as compared with that of the parent cells, with stronger proliferation activity and higher protein synthesis, and the HGMF could express and secrete more growth factor and chemokines associated with the growth of gastric cancer cells.
Fibroblast; Gastric cancer; Transformation
200434 上海,上海市虹口区江湾医院普外科(柴华);第二军医大学长海医院普外科(张浩、毕建威)
毕建威,电子信箱:noflyzone@163.com
R735.2
A
10.3969/j.issn.1009-0754.2016.06.004
2016-08-15)
