Fe3O4/Au磁性纳米复合材料的制备和性能
2017-01-12吴燕平沈欣怡宫培军
吴燕平,穆 肖,沈欣怡,毛 艳,吴 宾,宫培军*
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
Fe3O4/Au磁性纳米复合材料的制备和性能
吴燕平,穆 肖,沈欣怡,毛 艳,吴 宾,宫培军*
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
以聚乙烯亚胺修饰的纳米Fe3O4(Fe3O4/PEI)为磁性组分,采用化学还原法制备得到Fe3O4/Au磁性纳米复合材料(Fe3O4/Au),对其形貌和尺寸、磁学性质和分散稳定性进行表征,并研究了借助3-巯基丙酸在磁粒表面偶联模型靶分子精氨酸-甘氨酸-天冬氨酸肽(RGD)的效果。结果表明,Fe3O4/Au由纳米Au粒和Fe3O4/PEI构成,当进行二次还原反应后,产物中Au粒的数量和尺寸均增大,Fe3O4/Au的平均水力学粒径增大、饱和磁化强度则减小,但磁响应性和分散稳定性保持良好。偶联反应显示1 mg Fe3O4/Au可以固定约61.9 μg RGD,所得磁粒的粒径分布仍较窄。这些特征和性能显示Fe3O4/Au有望应用于生物分离与检测、靶向药物输运等领域。
Fe3O4/Au;磁性粒子;分散稳定性;共价偶联;生物应用
近年来,不断发展的生物医学检测技术在实现恶性疾病的早期筛查和高致病性传染病的快速检测等方面发挥重要作用,其中基于磁性纳米材料发展的生物分离、基因杂交检测和肿瘤成像等检测技术呈现出优异的应用性能[1-2]。因此,适合生物应用的磁性纳米材料的制备和性能研究备受关注。
金修饰的磁性粒子是近些年来发展的一类新型磁性材料。相比传统的高分子或氧化硅修饰的磁性粒子,金的光学、电化学性质使得金修饰的磁性粒子在生物分离与检测等应用中拥有更多可选的分析检测手段[3-4],金的生物相容性和光热性质则赋予该类材料作为成像剂或纳米药物应用于体内肿瘤成像与治疗的性能[5-7]。在生物修饰方法上,金的表面化学性质既能使巯基或胺基功能化的靶向分子(如抗体、核酸等)直接组装在磁性材料表面[1],也能采用先连接偶联剂或间隔臂、再共价偶联靶向分子的修饰路线[5],多样化的表面修饰路线更有利于磁粒在多种生物体系的应用。
金修饰的磁性粒子的合成方法包括化学还原法、组装法、光化学法、声化学法等[3-9],其中化学还原法的合成工艺简便,通过调节还原反应中物料配比或还原反应的次数可以方便地调控复合材料中金壳层的厚度或金颗粒的大小,进而调控材料的光学、电学和磁学等性质参数,因此受到广泛的研究。本文以聚乙烯亚胺(PEI)修饰的Fe3O4纳米粒子为磁性组分,采用化学还原法制备了Fe3O4/Au纳米复合材料(Fe3O4/Au)。以对多种肿瘤细胞新生血管表面高表达的整合素αvβ3受体具有靶向作用的精氨酸-甘氨酸-天冬氨酸肽(RGD)为模型靶分子,研究了Fe3O4/Au的生物修饰性能,结合Fe3O4/Au的形貌和尺寸、磁学性能和分散稳定性等特征和性质,分析了Fe3O4/Au作为磁性载体用于生物分离与检测、药物输运等领域的可行性。
1 实验
1.1 试剂和仪器
PEI(Mw100 kD)购自百灵威化学试剂公司,RGD(序列为c(RGDyK))购置吉尔生化(上海)公司,Bradford法蛋白质浓度测定试剂盒购置碧云天生物技术公司;其他试剂购自国药集团化学试剂公司,均为分析纯级。氮气(99.9%)作为磁性材料制备过程的保护气。
PW3040/60型X-射线衍射仪(荷兰Philps公司),JEM2010型透射电子显微镜(日本JEOE公司),Zetasizer nano ZS90型纳米粒度和Zeta电位仪(英国Malvern公司),7404型振动样品磁强计(美国Lakeshare公司,25℃测试),Nexus 670型傅立叶变换红外光谱仪(美国Nicolet公司,KBr压片),UV-2100型紫外-可见分光光度计(日本Shimadzu公司)。
1.2 Fe3O4/Au的制备
将1.62 g FeCl3·6H2O、1.39 g FeSO4·7H2O和0.30 g PEI溶解在30 mL蒸馏水中,在N2气氛下滴入20 mL 2.5% NaOH,搅拌15 min后转移反应液至100 mL反应釜,200℃反应1 h。冷却至室温,用磁铁分离固体产物并水洗至中性,得到PEI修饰的Fe3O4纳米粒子(Fe3O4/PEI)。
将50 mg Fe3O4/PEI超声分散于20 mL水中,加入1.6 mL 1% HAuCl4,滴加1.2 mL 0.1 mol/L盐酸羟胺,室温搅拌反应1 h。用磁铁分离磁性产物并洗涤数次,得到Fe3O4/Au纳米复合材料,记为Fe3O4/Au1。向Fe3O4/Au1分散液再次加入HAuCl4和盐酸羟胺,进行二次还原反应,制备条件同上,得到的Fe3O4/Au复合材料标记为Fe3O4/Au2。
1.3 RGD在Fe3O4/Au表面的修饰
将2.5 mg Fe3O4/Au2与5 mL 0.05 mol/L 3-巯基丙酸(MPA)在室温下振荡反应2 h,得到MPA修饰的Fe3O4/Au磁粒(Fe3O4/Au2-MPA)。将洗净的Fe3O4/Au2-MPA分散在5 mL 10 mmol/L磷酸盐缓冲液(pH 5.7),加入1 mg 1-(3-二甲胺丙基)-3-乙基碳二亚胺盐酸盐(EDC·HCl)和0.5 mg N-羟基硫代琥珀酰亚胺(Sulfo-NHS),搅拌均匀后室温振荡反应0.5 h,加入0.5 mg RGD,用NaOH调节溶液至pH 8.0,在4℃下振荡反应10 h,得到RGD偶联的Fe3O4/Au磁粒子(Fe3O4/Au2-MPA-RGD)。磁分离,用磷酸盐缓冲液(10 mmol/L,pH 8.0)洗磁性产物3次,合并反应清液和洗涤液,使用Bradford法蛋白浓度测定试剂盒测定游离RGD的浓度[10],依据反应前RGD的投料量求算单位质量磁粒偶联RGD的质量。
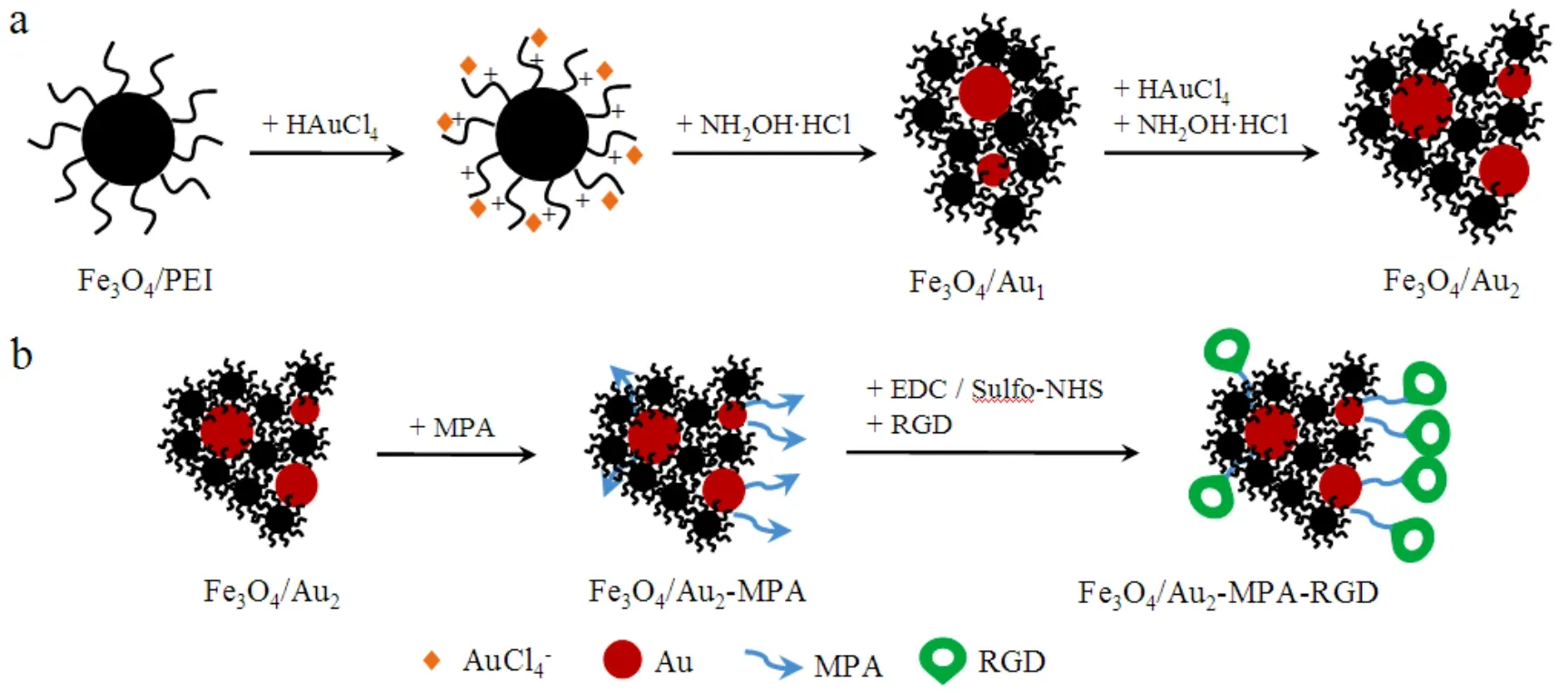
图1 Fe3O4/Au的制备(a)和表面修饰RGD过程(b)的示意图
2 结果与讨论
2.1Fe3O4/Au的制备和结构表征
Fe3O4/Au的制备过程如图1a所示。具有正ζ电位的Fe3O4/PEI[8]可以吸附阴离子AuCl4-,后者在盐酸羟胺的还原下转变为Au0,在PEI链的稳定作用下生长为Au纳米粒子,形成Fe3O4/Au。在图2(a)所示的吸收光谱中,相比Fe3O4/PEI,Fe3O4/Au1在550 nm附近出现Au胶体特征的吸收带,证实Au与Fe3O4/PEI成功复合;二次还原产物Fe3O4/Au2的Au吸收带红移至约584 nm且明显展宽,意味着复合材料中Au粒的尺寸变大且尺寸分布变宽[4]。
图2b给出样品的X-射线衍射(XRD)图。制备的Fe3O4/PEI的衍射峰与面心立方结构Fe3O4标准卡片(JCPDS No.89-3854)一致,证实所含晶相为Fe3O4。在复合Au后,Fe3O4的各衍射峰位置和相对强度未变化,产物在38.2、44.3、64.6和 77.6º处出现的衍射峰对应于面心立方结构Au(JCPDS No. 89-3697)的(111)、(200)、(220)和(311)晶面的衍射信号,证明复合材料含有Au和Fe3O4。相比Fe3O4/Au1,Fe3O4/Au2的Au与Fe3O4衍射峰强度的比值较大,表明Fe3O4/Au2中Au的相对含量较大。
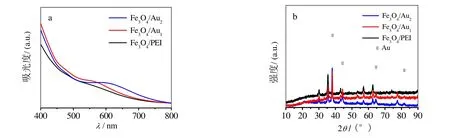
图2 样品的吸收光谱(a)和XRD图(b)
2.2 形貌和尺寸
由图3的TEM图可见,Fe3O4/PEI呈现尺寸较均匀的小颗粒,平均尺寸约24 nm;Fe3O4/Au1是由少数尺寸介于35~90 nm的深色Au粒子与Fe3O4/PEI粒子构成,其形貌与Pradhan等超声法制备的Fe3O4/Au相近[9];Fe3O4/Au2中Au粒的数目明显增多,尺寸增大至40~115 nm。由于样品在铜网上严重团聚,难以确定Fe3O4/Au的尺寸范围。
为此,借助动态光散射获得的水力学粒径分布图确定了分散在水中的三种磁粒的平均水力学粒径(MHD)和多分散系数(PDI)。图3(d)显示Fe3O4/PEI的MHD为59.4 nm,PDI为0.289。由于处于干态的PEI链倾向于收缩在Fe3O4表面,而在水溶液中PEI链因良好的亲水性易于溶胀或向溶液中伸展;同时,动态光散射测定的水力学粒径包含粒子的真实尺寸及其周围的双电层厚度,因此,MHD数值大于TEM统计的尺寸数值。Fe3O4/Au1和Fe3O4/Au2的水力学粒径也呈现单峰分布,较小的PDI(0.278和0.184)表明其粒径分布较窄;MHD值(94.8 nm和128.6 nm)较Fe3O4/PEI明显增大,表明Fe3O4/Au中包含一定数量的Fe3O4/PEI和Au粒子,PEI与Au之间Au-N作用不仅使Fe3O4/PEI和Au粒复合,同时在一定程度上可以限制了PEI链在溶液中的伸展。
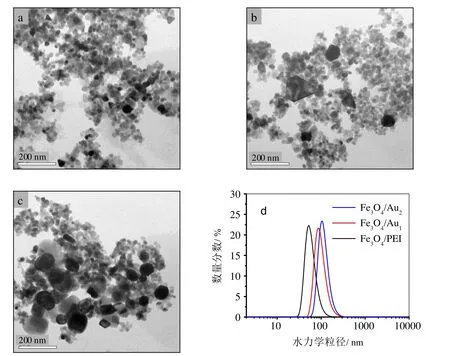
图3 样品的TEM图(a. Fe3O4/PEI;b. Fe3O4/Au1;c. Fe3O4/Au2)和水力学粒径分布图(d)
2.3 磁学性质
由图4可知,Fe3O4/PEI、Fe3O4/Au1和Fe3O4/Au2的磁滞回线均无明显的磁滞现象,剩余磁化强度(Mr)和矫顽力(Hc)均很小,表明三个样品均呈现准超顺磁性[11],这是因为样品中Fe3O4粒子的平均尺寸介于Fe3O4由铁磁性向超顺磁性转变的尺寸区间。Fe3O4/PEI的饱和磁化强度(Ms)为69.8 emu/g,由于非磁性组分Au的存在降低了Fe3O4在复合材料中的含量,Fe3O4/Au1和Fe3O4/Au2的Ms分别降低至44.9和26.9emu/g。较大的Ms值赋予了Fe3O4/Au良好的磁响应性能,两种样品均可以在8 min内从水溶液中完全磁回收,这足以确保Fe3O4/Au作为磁性载体用于生物分离与检测、靶向药物输运等应用。

图4 样品的室温磁滞回线
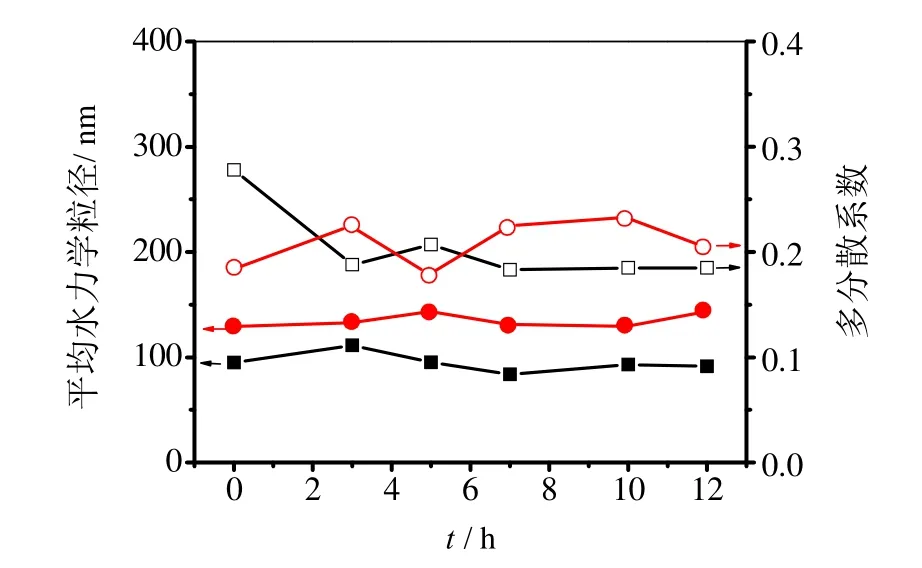
图5 Fe3O4/Au的平均水力学粒径和多分散系数随时间的变化
2.4 分散稳定性
进一步考察了Fe3O4/Au1和Fe3O4/Au2在水中的分散稳定性,图5显示在12 h内两种Fe3O4/Au的MHD的变化幅度均很小,PDI也无明显增大,表明Fe3O4/Au具有较好的分散稳定性。考虑到较大的Au粒数目有助于提高Fe3O4/Au偶联生物靶分子的数量,本文选择Fe3O4/Au2进一步研究其生物修饰性能。
2.5 生物修饰性能
模型靶分子RGD在Fe3O4/Au2表面的修饰路线如图1(b)所示,借助红外光谱和蛋白浓度测定验证了该偶联反应。图6 中Fe3O4/Au2的1628、3120 和3423 cm-1吸收带分别对应 PEI 中亚胺基(胺基)的N-H变形振动、对称和反对称伸缩振动;由于N的电子对Fe和Au的贡献导致PEI的C-N键偶极性增加,C- N振动出现在892 cm-1处;584 cm-1吸收带归属Fe-O键伸缩振动[12]。Fe3O4/Au2-MPA在1412和1566 cm-1处的吸收带对应于MPA中羧酸根COO-的对称和反对称伸缩振动,MPA的脱质子是由PEI中亚胺基(胺基)的碱性所致。由于RGD的1640和1554 cm-1处酰胺I带和II带分别与N-H变形振动和COO-的反对称伸缩带的位置临近和重叠,Fe3O4/Au2-MPA-RGD与Fe3O4/Au2-MPA的FTIR谱在上述区域非常相近,但Fe3O4/Au-MPA-RGD的1566 cm-1附近吸收带与Fe-O吸收带的强度之比大于Fe3O4/Au2-MPA,证明RGD已偶联在磁粒表面。同时,蛋白浓度测定实验得到1 mg Fe3O4/Au2表面的RGD偶联量约为61.5 µg,考虑到RGD的分子量(619.2)远小于常见抗体(M~104数量级),该偶联量意味着RGD在Fe3O4/Au表面的数量非常大,这有助于使用少量的磁粒实现对肿瘤细胞等特定目标分子的结合或捕获。
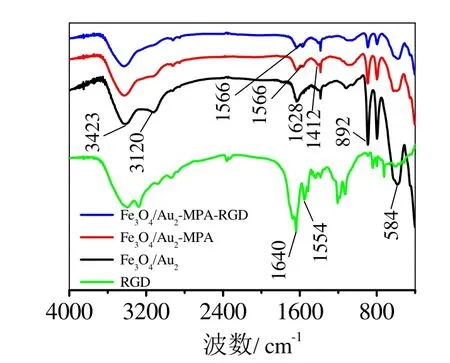
图6 生物修饰前后Fe3O4/Au的红外光谱
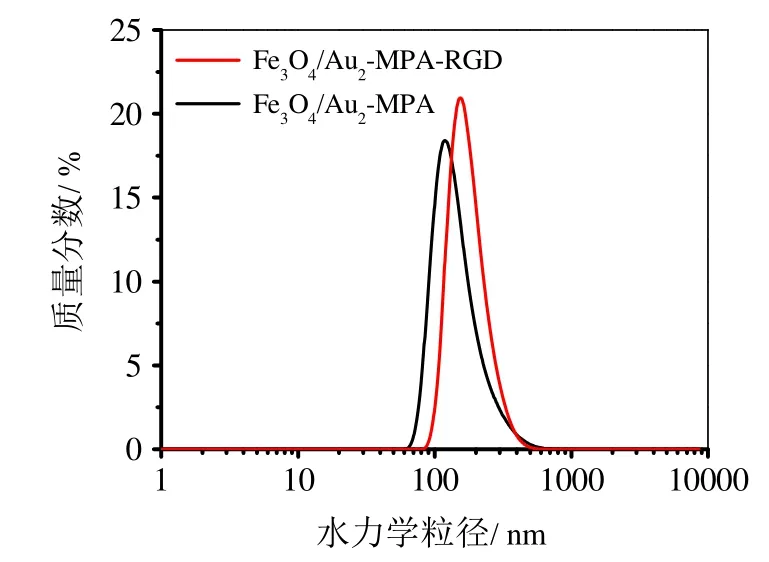
图7 MPA修饰和RGD偶联的Fe3O4/Au2的水力学粒径分布图
动态光散射的结果也间接证实了Fe3O4/Au表面偶联RGD的成功。图7显示,当Fe3O4/Au表面组装MPA和偶联RGD后,Fe3O4/Au2-MPA和Fe3O4/Au-MPA-RGD的水力学粒径仍呈现单峰分布,MHD分别增大至151.3 和180.1 nm,表明MPA和RGD依次连接在磁粒表面[2];样品较小的PDI值(0.308和0.208)反映出上述偶联方法基本不会导致磁粒尺寸分布的宽化。因此,上述修饰策略有望用于在Fe3O4/Au磁粒表面共价偶联核酸、抗体等生物靶分子或阿霉素、紫杉醇等药物分子,以进一步利用主动靶向或磁靶向作用实现对特定组织的药物输运。
3 结论
本文采用化学还原法制备了准超顺磁性Fe3O4/Au纳米复合材料。增加还原反应的次数可以获得平均水力学粒径较大的复合材料,其所含Au粒子的尺寸增大、数目增多,同时Fe3O4/Au的饱和磁化强度有所减小。借助3-巯基丙酸在Fe3O4/Au表面的组装和共价偶联的修饰路线可以方便地在Fe3O4/Au表面修饰靶分子RGD。良好的磁响应性能和分散稳定性、高的靶分子偶联量以及所得功能化磁粒较窄的尺寸分布等特征和性能使得Fe3O4/Au有望应用于生物分离与检测、靶向药物输运等领域。
参考文献:
[1] Zhou H, Lee J, Park T J, et al. Ultrasensitive DNA monitoring by Au-Fe3O4nanocomplex[J]. Sens Actuators B, 2012, 163(1): 224-232.
[2] 乔瑞瑞, 刘侃, 贾兵, 等. 不同表面修饰的Fe3O4纳米颗粒在体肿瘤成像研究[J]. 东南大学学报(医学版), 2011, 30(1): 63-66. [3] 李建平, 陈绪胄. 基于Fe3O4/Au/GOx 的新型磁性敏感膜葡萄糖传感器的研制[J]. 化学学报, 2008, 66(1): 84-90.
[4] 刘丽赏, 刘洪娜, 李松, 等. 用于生物检测的链霉亲和素修饰γ-Fe2O3@Au复合颗粒的制备与表征[J]. 化学学报, 2010, 68(20): 2041-2046.
[5] Zhou Ting, Wu Baoyan, Xing Da. Bio-modified Fe3O4core/Au shell nanoparticles for targeting and multimodal imaging of cancer cells[J]. J Mater Chem, 2012, 22: 470-477.
[6] Ma Ming, Chen Hangrong, Chen Yu, et al. Au capped magnetic core/mesoporous silica shell nanoparticles for combined photothermo-/chemo-therapy and multimodal imaging[J]. Biomaterials, 2012, 33(3): 989-998.
[7] Yang Hungwei, Liu Haoli , Li Menglin, et a l. Magnetic gold-nanorod/ PNIPAAmMA nanoparticles for dual magnetic resonance and photoacoustic imaging and targeted photothermal therapy[J]. Biomaterials, 2013, 34(22): 5651-5660.
[8] 彭哲阳, 吴文贤, 冒卫星, 等. Fe3O4/聚乙烯亚胺/金磁性复合材料的光化学制备与表征[J]. 辐射研究与辐射工艺学报, 2013, 31(3): 38-43.
[9] Pradhan A, Jones R C, Caruntu D, et al . Gold-magnetite nanocomposite materials formed via sonochemical methods[J]. Ultrason Sonochem, 2008, 15(5): 891-897.
[10] 穆肖. 整合素αvβ3靶向Fe3O4/羧甲基壳聚糖纳米磁粒的制备和功能化修饰[D]. 硕士学位论文. 金华: 浙江师范大学, 2015, 16-17.
[11] Li L, Yang Y, Ding J, et al. Synthesis of magnetite nanooctahedra and their magnetic field- induced two-/three-dimensional superstructure[J]. Chem Mater, 2010, 22(10): 3183-3191.
[12] Luo Yanling, Fan Lihua, Xu Feng, et al. Synthesis and characterization of Fe3O4/PPy/P (MAA-co-AAm) trilayered composite microspheres with electric, magnetic and pH response characteristics[J]. Mater Chem Phys, 2010, 120(2-3): 590-597.
Preparation and Properties of Fe3O4/Au Magnetic Nanocomposites
WU Yan-ping, MU Xiao, SHEN Xin-yi, MAO Yan, WU Bing, GONG Pei-jun*
(College of Chemistry and Life Sciences, Zhejiang Normal University, Jinhua 321004, China)
Fe3O4/Au magnetic nanocomposites (Fe3O4/Au) were prepared by a chemical reduction method, using polyethyleneimine-modified Fe3O4nanoparticles (Fe3O4/PEI) as the magnetic component. The morphology, size, magnetic property and dispersion stability of the obtained products were then characterized. Besides, A coupling reaction between Fe3O4/Au and arginine-glycine-aspartate peptide (RGD), a model targeting molecule, was investigated by using 3-mercaptopropionic acid as the spacer. The results showed that Fe3O4/Au was composed of Fe3O4/PEI and Au nanoparticles. As the second reduction reaction was done, both the number and size of Au nanoparticles in the obtained nanocomposite increased, which contributed to an increase in the mean hydrodynamic diameter and a decrease in the saturation magnetization of the nanocomposite. But the magnetic responsiveness and dispersion stability of Fe3O4/Au were good and independent of the successive reduction process. About 61.9 μg of RGD was conjugated to 1 mg of Fe3O4/Au and the diameter distribution of RGD-functionalized magnetic nanocomposite remained narrow. Therefore, these features and properties demonstrated that the magnetic nanocomposite are perspective materials for bioseparation, biodetection and targeted drug delivery.
Fe3O4/Au; magnetic nanoparticle; dispersion stability; covalent coupling; bioapplication
TB333
A
1009-220X(2016)06-0012-06
10.16560/j.cnki.gzhx.20160604
2016-08-06
浙江省公益技术应用研究项目(2016C31014);国家级大学生创新创业训练计划项目(201510345020);浙江师范大学“化学”重中之重学科学生创新训练项目。
吴燕平(1995~),女,本科生;主要从事磁性纳米材料制备研究。
* 通讯作者:宫培军(1978~),男,博士,副教授;主要从事磁性纳米材料制备和应用研究。skygpj@zjnu.cn
