拉鲁湿地土壤理化因子与酵母菌多样性及产胞外酶活性相关性分析
2017-01-11郭小芳熊宁郝兆梁泽鹏拉巴
郭小芳 熊宁 郝兆 梁泽鹏 拉巴
(西藏大学理学院 西藏拉萨 850000)
拉鲁湿地土壤理化因子与酵母菌多样性及产胞外酶活性相关性分析
郭小芳 熊宁 郝兆 梁泽鹏 拉巴
(西藏大学理学院 西藏拉萨 850000)
采用稀释倒平板法从拉鲁湿地土壤中分离酵母菌,结合经典分类法及26S rDNA D1/D2区域序列分析,对获得的83株酵母菌菌株进行系统分类,并对土壤的基本理化因子进行了测定。结果显示,拉鲁湿地土壤酵母菌分属于隐球酵母属Cryptococcus、假丝酵母属Candida、原囊菌属Protomyces、红酵母属Rhodotorula及Cystofilobasidium 5个属16个种,其中隐球酵母属Cryptococcus包括8个种。多样性指数比较结果表明,6号样点酵母菌多样性最丰富,9号样点最低。理化因子测定结果显示,不同样点所测的6种理化因子存在一定程度的差异,其中6号样点水分含量明显高于其他样点(P<0.05),3号样点铵态氮、速效磷以及速效钾含量最高(P<0.05),9号样点则最低(P<0.05);3、4、5、6号样点有机质含量明显高于其他几个样点(P<0.05)。酵母菌多样性与理化因子相关性分析结果表明,两者之间没有显著相关性,而有机质含量与酵母菌总丰度相关性系数较高。产不同胞外酶活性菌株比例与土壤理化因子间不呈现显著相关性,果胶酶活性菌株比例与水分呈现显著负相关性(P<0.05),速效磷与产脂肪酶活性菌株比例则呈现显著正相关性(P<0.05)。
拉鲁湿地;土壤;酵母菌多样性;理化因子;26SrDNAD1/D2区域序列分析
湿地为水生、陆生生态系统界面相互延伸扩展的重叠空间区域,是地球上特殊过渡类型生态系统,也是自然界富有生物多样性的生态景观和人类重要的生存环境之一,具有多种生态功能和社会经济价值,被誉为“自然之肾”[1]。微生物不仅在湿地生态系统物质循环、能量流动和系统稳定性维持等方面具有重要作用,此外还参与废物处理、生态修复、气体调节和生物多样性保护等生态过程[2]。拉鲁湿地是目前我国城市范围内面积最大的天然湿地,在保持地区生物多样性、维持城市生态平衡、改善城市环境质量等方面起着十分重要的作用,故有拉萨“城市之肺”之称[3-4]。尽管拉鲁湿地具有重要的生态作用,但是由于受地域等条件的限制,对其中生物资源和多样性的研究起步较晚,且主要集中在动物[5-12]和植物[13-15]群落结构方面的研究,在微生物方面,仅见的零星报道也只是局限于土壤放线菌和细菌的研究[16-17]。本实验对拉鲁湿地土壤理化因子进行测定,并就其与酵母菌多样性、产胞外酶活性菌株分布特性相关性进行分析,旨在为拉鲁湿地生物多样性研究提供理论依据。
1 研究内容与方法
1.1 土壤样品的采集
在拉鲁湿地选择具有代表性的10个生境样点,进行土壤的采集。采用多点混合法采集0~30cm深度的土壤样品,并在4℃下保藏备用。
1.2 土壤理化因子测定
测定土壤pH值、水分、铵态氮、速效磷、速效钾及有机质含量。采用烘干法提取水分,pH计测定土壤的pH值,其他理化指标的测定采用土壤化肥速测仪TRF-1进行。
1.2.1 土壤水分的测定
称取100g土壤,将其烘干至恒重。称量烘干土壤重量,并计算样品水分含量。重复测定三次。
1.2.2 土壤pH的测定
称取过20目筛的风干土壤10g,置于100mL烧杯中;量取50mL蒸馏水,加入烧杯中;用玻璃棒搅拌约1min,静置半小时使其澄清;用标准缓冲液校正后的酸度计测定样品pH值。重复测定3次。
1.2.3 土壤铵态氮的测定
滤液制备:取待测土壤样品4g放入50mL烧杯中,加蒸馏水20mL;加1g 1号粉后密封烧杯,并摇动10min,过滤后取滤液。
铵态氮测定:向空比色皿内加蒸馏水作为空白液;向空比色皿中滴入18滴蒸馏水,再滴入2滴氮标液,摇匀,做为标准液(20mg/kg);吸取20滴待测滤液放入空比色皿中,为待测液;向装有标准液、待测液比色皿内分别加入2滴氮1号试剂,摇匀,再加入2滴氮2号试剂,摇匀。静止10min后各滴入15滴蒸馏水,上仪器进行测定。每个处理重复3次。
1.2.4 土壤速效磷的测定
滤液制备同1.2.3节。
速效磷测定:向比色皿内加蒸馏水作为空白液;向空的比色皿中滴18滴蒸馏水,再滴入2滴磷标液,摇匀,作为磷标准液(20mg/kg);吸取16滴蒸馏水、4滴磷滤液加入另一比色皿中摇匀,为待测液;向装有磷标准液、待测液比色皿内分别滴入15滴蒸馏水,再各加入2滴磷1号试剂和1滴磷2号试剂,立即上仪器进行测定。每个处理重复3次。
1.2.5 土壤速效钾的测定
滤液制备同1.2.3节。
速效钾测定:向空的比色皿内加蒸馏水作为空白液;向另一比色皿中滴18滴蒸馏水,再滴2滴钾标液,摇匀,作为钾标准液(100mg/kg);吸取20滴钾滤液放入另一空的比色皿中,为待测液;向装有钾标准液、待测液的比色皿内分别加2滴钾1号试剂,摇匀,再加2滴钾2号试剂,摇匀。再各滴15滴蒸馏水,上仪器进行测定。每个处理重复3次。
1.2.6 土壤有机质测定步骤
将5mL测磷浸提滤液倒入小试管中,与说明书上5个标准色标进行比较即可得出土样有机质的百分含量。5个标准试管分别代表4.0%、3.0%、2.0%、1.0%、0.5%。
1.3 酵母菌的分离及鉴定
采用稀释涂布法从10个土壤样品中分离酵母菌。培养基主要包括酸化YPD、酸化YM及酸化PDA平板。采用平板划线法在YPD培养基上进行酵母菌菌株的纯化。分离获得的酵母菌菌株的鉴定主要采用26SrDNAD1/D2区域序列分析法进行。DNA扩增和检测等由云南大学微生物研究所完成DNA扩增和条带检测后送达测序公司进行测序。序列进行人工校对后在GenBank核酸序列数据库中进行同源性搜索,以确定酵母菌所属分类单元。
1.4 产胞外酶活性菌株筛选
采用平皿法进行产胞外酶活性菌株的初步筛选。胞外酶主要包括淀粉酶、纤维素酶、果胶酶、几丁质酶及脂肪酶。在不同平板上接种酵母菌菌株后分别于4℃和25℃进行培养。低温21d、常温5d时观察晕圈或透明圈的产生情况,并进行记录。
1.5 数据的处理及统计
采用Excel软件计算Shannon-Wiener多样性指数(H’)、Pielou均匀度指数(J’)及Simpson多样性指数(D);用Spss19.0 Duncan检验法分析各样点理化因子差异性,并用其中Pearson分析法进行酵母菌理化因子间、理化因子与酵母菌多样性指数以及理化因子与产胞外酶活性菌株分布特性相关性分析。
2 结果与分析
2.1 拉鲁湿地土壤理化因子测定
表1结果显示,不同样点所测的6种理化因子存在一定程度的差异;6号样点水分含量明显高于其他样点(P<0.05),而2号样点水分含量最低(P<0.05);pH测定结果表明,不同样点间基本存在显著差异,其中1号样点pH最高(P<0.05),3号样点则最低(P<0.05);3号样点铵态氮、速效磷以及速效钾含量最高(P<0.05),9号样点则最低(P<0.05);有机质含量而言,3、4、5、6号样点明显高于其他几个样点(P<0.05),1号、2号和7号样点则明显低于其他样点(P<0.05)。

表1 拉鲁湿地土壤理化因子
2.2 拉鲁湿地土壤酵母菌种群分布特性
表2结果显示,拉鲁湿地土壤分离的酵母菌分属5个属16种。其中隐球菌属Cryptococcus种类最多,为8个种,主要包括Cryptococcusadeliensis、Cryptococcusaerius、Cryptococcusaspenensis、Cryptococcuscerealis、Cryptococcusflavus、Cryptococcusfriedmannii、Cryptococcusuzbekistanensis和Cryptococcusvictoriae,其中Cryptococcusvictoriae分布最为广泛,5个样点均有分离。其次为红酵母属Rhodotorula,包括4个种(Rhodotorula glutinis、Rhodotorula ingeniosa、Rhodotorula mucilaginosa、Rhodotorula vanillica),其中Rhodotorula mucilaginosa相对丰度最高。Cystofilobasidium分离到2个种,原囊菌属Protomyces和假丝酵母属Candida均分离到1个种。

表2 拉鲁湿地土壤酵母菌种群分布特征
2.3 拉鲁湿地土壤酵母菌多样性指数分析
表3结果显示,拉鲁湿地每个土壤样品中分离的酵母菌种类不多,最多为3种,最少为1种。10个样点中,6号样点可培养酵母菌数量、H’值、D值均最高,而9号样点以上值均最低。总体而言,6号土壤样点酵母菌相对丰富,其次为2号样点和7号样点,9号样点则比较单一,且数量较少。10个样点的J’值均不高,最高仅为0.39,说明酵母菌的分布不均匀。

表3 拉鲁湿地土壤中酵母菌多样性指数
2.4 拉鲁湿地不同土壤样点酵母菌产胞外酶活性菌株数比较

表4 拉鲁湿地不同样点土壤酵母菌产胞外酶活性菌株数比较(4℃)
从表4可以看出,4℃条件下,4号、5号和8号样点具有产几丁质酶活性菌株;3号、9号和10号样点产淀粉酶活性菌株比例最高,均为100%;3号和7号样点产脂肪酶菌株比例最高;5号样点产果胶酶活性菌株比例最高;2号样点产纤维素酶活性菌株比例最高。

表5 拉鲁湿地不同样点土壤酵母菌产胞外酶活性菌株数比较(25℃)
表5数据显示,25℃条件下,2号样点产淀粉酶活性菌株比例最高;7号样点产脂肪酶菌株比例最高;而3号样点产纤维素酶和果胶酶活性菌株比例最高。比较表4和表5数据可以发现,除3号、9号和10号,其他7个样点高温条件下的产脂肪酶活性菌株比例均高于低温条件;除2号样点外,其他样点低温条件下的产淀粉酶活性菌株比例均不低于高温条件;产纤维素酶活性而言,除6号样点外,其他样点低温条件下活性菌株比例仍均不低于高温条件;产几丁质酶活性菌株仅在低温条件下被分离到。
2.5 拉鲁湿地土壤理化因子、酵母菌多样性及产胞外酶活性间相关性分析
2.5.1 拉鲁湿地土壤理化因子间相关性分析分析
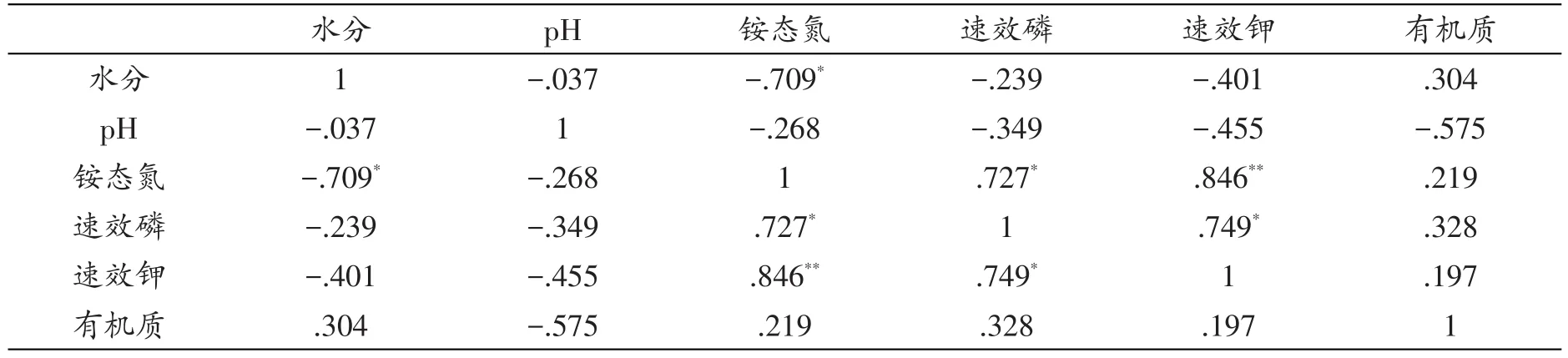
表6 拉鲁湿地土壤理化因子间Pearson相关性系数
拉鲁湿地酵母菌多样性指数相关性结果显示(见表6),铵态氮、速效磷与速效钾间呈显著或极显著正相关。铵态氮与水分间呈显著负相关(P<0.05);有机质、pH与其他理化因子之间则无明显相关性。

表7 拉鲁湿地土壤理化因子与酵母菌多样性指数Pearson相关性系数
2.5.2 拉鲁湿地土壤理化因子与酵母菌多样性指数间相关性分析
理化因子与多样性指数间相关性分析结果显示(见表7),拉鲁湿地酵母菌物种丰富度、总丰度等多样性指数与理化因子(pH、水分、铵态氮、速效磷、速效钾、有机质)之间无明显相关性,相对而言,酵母总丰度与有机质之间相关性系数较高(0.534)。

表8 拉鲁湿地土壤理化因子与不同酵母菌丰度Pearson相关性系数

表9 拉鲁湿地土壤理化因子与产不同胞外酶活性菌株比例Pearson相关性系数
2.5.3 拉鲁湿地土壤理化因子与不同种酵母菌总丰度相关性分析
表8数据表明,从拉鲁湿地土壤中分离到的16种酵母菌总丰度与土壤水分间无明显相关性;Cryptococcus adeliensis总丰度与pH呈现极显著正相关(P<0.01);Cryptococcus flavus和Rhodotorula glutinis总丰度与铵态氮、速效磷和速效钾间呈现显著或极显著正相关性;Cryptococcusaspenensis总丰度与有机质间呈现极显著正相关性(P<0.01)。
2.5.4 拉鲁湿地土壤理化因子与产不同胞外酶活性菌株比例相关性分析
从表9可以看出,产不同胞外酶活性菌株比例与土壤理化因子间基本不呈现显著相关性,但果胶酶活性菌株比例与水分呈现显著负相关性(P<0.05),速效磷与产脂肪酶活性菌株比例则呈现显著正相关性(P<0.05)。
2.5.5 拉鲁湿地不同酵母菌与产不同胞外酶活性菌株比例相关性分析
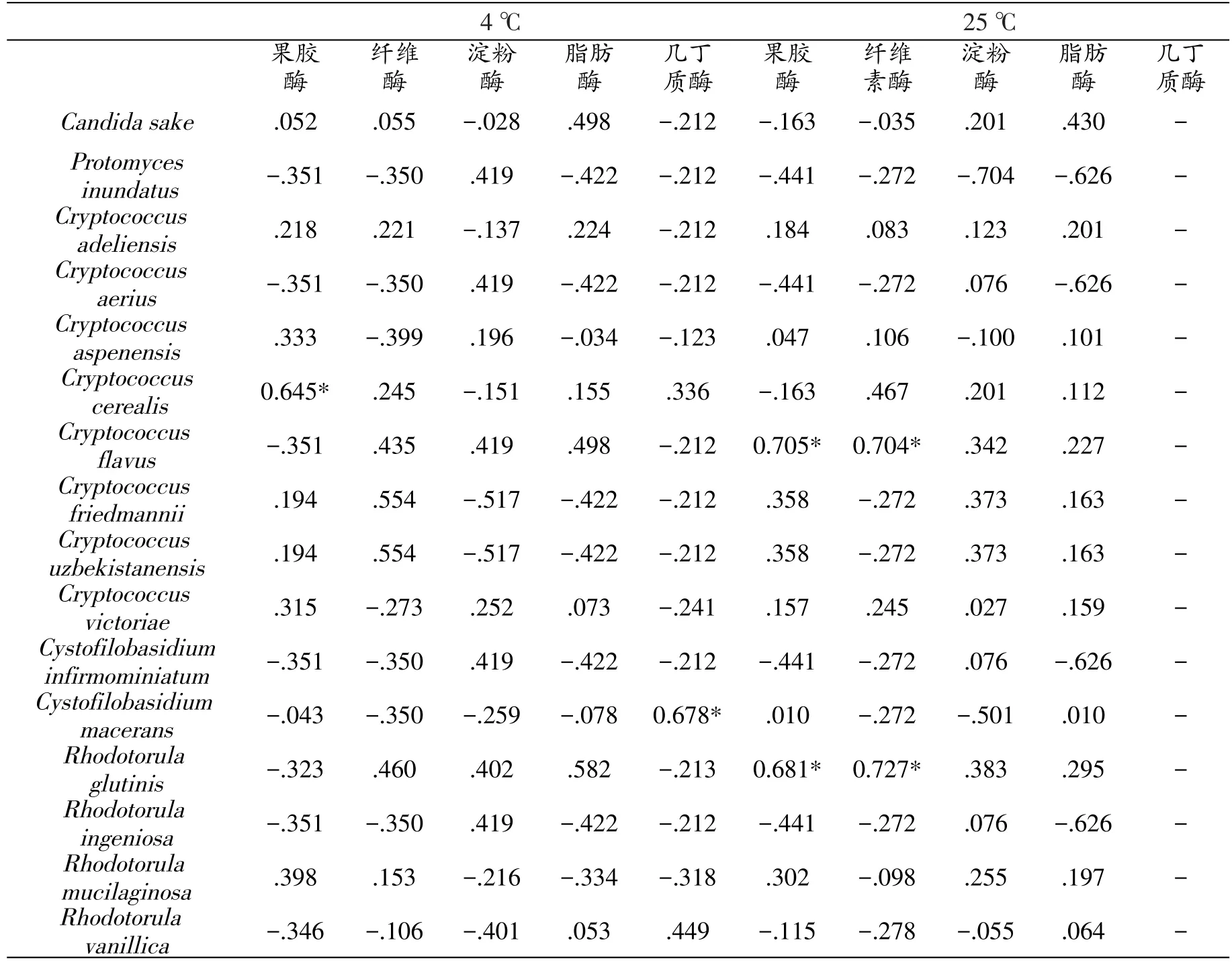
表10 拉鲁湿地不同酵母菌丰度与产不同胞外酶活性菌株比例Pearson相关性系数
表10结果显示,Cryptococcusflavus与Rhodotorula glutinis丰度与产果胶酶及纤维素酶活性菌株比例间呈现显著正相关性(P<0.05),另外,Cryptococcuscerealis丰度与果胶酶产生菌比例也呈现为显著正相关性(P<0.05);Cystofilobasidiummacerans与几丁质酶产生菌比例间呈显著正相关性(P<0.05)。
3 结论和讨论
将分离自拉鲁湿地土壤的83株酵母菌菌株归为5个属16个种,其中隐球酵母属种类最多,包括8个种。土壤理化因子测定结果表明,6号样点水分含量明显高于其他样点;3号样点铵态氮、速效磷以及速效钾含量最高,9号样点则最低;3、4、5、6号样点的机质含量明显高于其他几个样点。酵母菌多样性指数分析结果显示,6号样点酵母菌多样性指数最高,9号样点酵母菌种类则最为单一。比较6号样点和9号样点发现,6号样点所处生境为以委陵菜Potentilla anserine、嵩草Kobresia sp.为主的草甸群落,受人为干扰较小,而9号样点则为流沙河入水口形成的沙石冲击区,前者有机质含量和氮磷钾等明显高于后者,因而样点间酵母菌群落组成存在一定差异。
理化因子间的相关性数据显示,铵态氮、速效磷与速效钾间呈显著或极显著正相关。理化因子与多样性指数间相关性分析结果则表明,拉鲁湿地酵母菌物种丰富度、总丰度等与理化因子之间无明显相关性,相对而言,酵母总丰度与有机质之间相关性系数较高,与前期对云南抚仙湖酵母菌多样性研究[18]的结果相吻合,能够进一步解释6号样点酵母菌总丰度高于9号样点的可能原因。从本实验结果看出,微生物群落组成是多种因素共同作用的结果,而微生物群落组成又不免受到人为因素等影响。
为进一步探讨不同酵母菌丰度与土壤理化因子的关系,计算了两者之间的Pearson相关系数,结果表明,速效磷与产脂肪酶活性菌株比例呈现显著正相关性,这可能与磷酸是脂肪酶作用底物甘油三脂的主要组成成分有关。
[1]Zhang YL,Wang CL,BaiWQ etal.Alpinewetlands in the Lhasa River Basin,China[J].JournalofGeographical Sciences,2010,20 (3):375-388.
[2]刘银银,李峰,孙庆业,等.湿地生态系统土壤微生物研究进展[J].应用与环境生物学报,2013,19(3):547-552.
[3]黄薇,陈叙图.拉鲁湿地的生态服务功能及其退化原由的分析[J].西部林业科学,2008,37(3):41-45.
[4]田洪武,刘际雨,孟虎生,等.拉鲁湿地及其保护的工程措施[J].中国水土保持,2003(10):28-29.
[5]陈德来,马正学,普布,等.拉萨拉鲁湿地夏季土壤动物的群落特征[J].动物学杂志,2011,46(5):1-7,25.
[6]巴桑,黄香,普布,等.拉鲁湿地夏秋季纤毛虫群落特征及其与水环境的关系[J].生态学杂志,2014,33(10):2740-2748.
[7]陈德来,普布,巴桑,等.西藏拉鲁湿地夏季土壤线虫群落特征[J].动物学杂志,2014,49(5):744-753.
[8]巴桑,普布.拉鲁湿地自然保护区有壳肉足虫物种多样性与空间分布特征[J].西藏大学学报(自然科学版),2014,29(1):1-7.
[9]普布,孙扩,张二豪,等.拉鲁湿地夏季昆虫群落组成特征的初步研究[J].西藏大学学报(自然科学版),2013,28(1):7-11.
[10]包新康,张健,曲扎,等.拉萨拉鲁湿地夏季鸟类调查初报[J].动物学杂志,2005,40(2):86-89.
[11]巴桑,次仁,普布,等.拉鲁湿地国家级自然保护区鸟类资源及其保护对策[J].西藏大学学报(自然科学版),2009,31(7):1238-1243.
[12]范丽卿,土艳丽,李建川,等.拉萨市拉鲁湿地鱼类现状与保护[J].西藏大学学报(自然科学版),2011,33(9):1742-1749.
[13]李春,周刊社,李晖.拉鲁湿地主要植物群落结构及物种多样性[J].西北植物学报,2008,28(12):2514-2520.
[14]拉多,John Birks,普布,等.拉萨市拉鲁湿地植物群落与环境因素之间的关系及其分布格局[J].西藏大学学报(自然科学版), 2009,24(1):15-20.
[15]巴桑,普布,马正学,等.西藏拉鲁湿地夏季和秋季浮游藻类群落特征[J].湿地科学,2012,10(4):404-416.
[16]何建清,张格杰,岳海梅.拉鲁湿地自然保护区放线菌组成分析及生物活性测定[J].微生物学杂志,2009(4):6-10.
[17]德吉,吴小妮,索朗德庆,等.拉鲁湿地土壤细菌多样性初探[J].西藏大学学报(自然科学版),2014,29(2):44-50.
[18]郭小芳,李治滢,董明华,等.云南高原湖泊抚仙湖酵母菌空间分布及其与环境因子的关系[J].湖泊科学,2016,28(2):358-369.
Analysison the correlationsbetween yeastdiversity,extracellularenzymeactivity and physicochemical factorsofsoil in LhaluWetland,Lhasa
Guo Xiao-fang Xiong Ning Hao Zhao Liang Ze-peng Laba
(Schoolof Science,TibetUniversity,Lhasa850000,Tibet)
Pour PlateMethodwasadopted to isolate yeasts from soil in the LhaluWetlandcombiningwith the classical identificationmethod and 26S rDNAD1/D2 sequenceanalysis.83 strainsofyeastwereisolated and soilenvironmental factorsweremeasured.The results showed that isolated yeast from soil in Lhalu wetland was classified into 16 specieswithin 5 generaincluding Cryptococcus,Candida,Protomyces,Rhodotorula and Cystofilobasidium.The diversity index showed that the highest diversity of yeastwas in sample 6 and the lowest insample 9.6 physicochemical factorsmeasured were differentbetween sampling points,thewater content in sample 6was significantly higher than thatofother sampling points(P<0.05),the concentration ofammonium nitrogen,available phosphorusand available potassium were the highest in sample 3 and the lowest in sample 9(P<0.05),the organicmatter contentof four samples,including sample 3,4,5 and 6washigher than thatofother samples.The correlation between yeast diversity and physicochemical factors showed that there was no significant correlation between them;however,the correlation coefficientbetween the totalabundance of yeastand the organicmatter contentwas relatively high.Therewas significantnegativecorrelation(P<0.05)between pectinase activity strain ratio and water contentand significantpositive correlation(P<0.05)between the proportion of lipase producing strain and available phosphorus.Overall,there were relatively abundant yeast resources in the soil in Lhalu wetland, and yeastcommunity compositionmay affected by physicochemical factorsand human disturbances.
Lhaluwetland;soil;yeastdiversity;physicochemical factors;26SrDNAD1/D2 sequence analysis
10.16249/j.cnki.54-1034/c.2016.02.001
S153.6
A
1005-5738(2016)02-001-009
[责任编辑:索郎桑姆]
2016-09-12
2016年度西藏自治区自然科学基金项目“西藏拉鲁湿地水体酵母菌多样性及其与环境因子相关性研究”(项目号:2016ZR-15-11);2015年度国家级大学生创新创业训练项目“拉鲁湿地土壤酵母菌分子鉴定及胞外酶活性测定”(项目号:201510694003);2016年度西藏大学珠峰学者人才发展支持计划(项目号:藏大字[2016]141号)阶段性成果。
郭小芳,女,汉族,甘肃兰州人,西藏大学理学院副教授,主要研究方向为微生物生态学。
