拉萨市林周县甘曲湿地夏、秋季土壤细菌的分离及鉴定
2017-01-11强久巴姆其米卓嘎
德 吉 李 媛 强久巴姆 其米卓嘎 杨 登
(西藏大学理学院 西藏拉萨 850000)
拉萨市林周县甘曲湿地夏、秋季土壤细菌的分离及鉴定
德 吉 李 媛 强久巴姆 其米卓嘎 杨 登
(西藏大学理学院 西藏拉萨 850000)
土壤微生物在高原湿地生态系统中具有重要的生态功能。文章在夏、秋两季对西藏拉萨市林周县甘曲湿地10个样点的土壤进行了培养和分离,鉴定出10种不同的细菌,在此基础上对各样点间土壤细菌的群落结构差异进行了分析,并针对夏、秋两季进行了物种多样性分析。分离到的10种细菌分别为:枯草芽孢杆菌(Bacillussubtilissubsp.inaquosorum),氧化微杆菌(Microbacterium oxydans),苏云金芽孢杆菌(Bacillus thuringiensis),嗜根寡氧单胞菌(Stenotrophomonasrhizophila),金黄杆菌属细菌(Chryseobacterium gambrini),新鞘氨醇杆菌属细菌(Novosphingobium capsulatum),维氏气单胞菌(Amromonasveronii),好氧反硝化菌(Pseudomonas chengduensis)和微小杆菌属细菌(Exiguobacterium artemiae)等9种菌和一种未知菌株。其中,维氏气单胞菌(Amromonasveronii)是夏、秋两季的优势种,维氏气单胞菌(Amromonasveronii)、枯草芽孢杆菌(Bacillussubtilissubsp.Inaquosorum)、氧化微杆菌(Microbacterium oxydans)是夏、秋两季的主要菌株,而嗜根寡氧单胞菌(Stenotrophomonasrhizophila)和金黄杆菌属细菌(Chryseobacterium gambrini)为夏季特有,新鞘氨醇杆菌属细菌(Novosphingobium capsulatum)和微小杆菌属细菌(Exiguobacterium artemiae)为秋季特有。多样性分析结果表明,夏季1#和4#样点物种多样性最丰富,3#样点多样性最低,而秋季8#样点多样性最丰富,1#最低。可知,夏、秋两季甘曲湿地土壤细菌物种多样性存在差异。
拉萨;甘曲湿地;土壤;细菌多样性;夏季;秋季
湿地为介于水生环境和陆地之间十分重要的过渡型环境,具有较丰富的微生物资源,使得湿地生态系统内部及其与邻近各生态系统之间物质迁移、转化和循环极其活跃[1]。西藏是中国湿地海拔最高、面积最大、分布最为集中的地区之一,湿地总面积达60042.72km2,约占西藏土地面积的4.9%。西藏湿地类型主要以自然湿地为主,加之该地区人口稀少、经济开发时间较晚,绝大部分湿地区域受现代工业污染极少,湿地及湿地生物基本上保持着自然原生的状况[2]。土壤是湿地生态系统的重要组成成分,因此土壤对湿地生态系统的功能及其可持续性方面发挥着重要的作用[3]。土壤的化学性质、物质的转化和循环利用及污染物的降解等都与土壤微生物息息相关,而细菌是土壤中种类和数量最多的微生物[4],占土壤微生物总量的70%~90%[5]。研究指出,地上的植被和群落与地下的微生物群落关系紧密,具有正负反馈的相互推动机制[6]。故细菌的重要作用不仅体现在能够形成和分解有机物、促进植物根系在微生态环境和土壤环境中物质和能量的循环[7-8],还能够直接或间接地提高土壤利用效率,实现合理利用土壤。
国内高原微生物及多样性方面的研究较多,赵垦田、杨小林等[9]对拉萨半干旱河谷土壤砂生槐灌丛恢复过程群落特征与土壤微生物的动态进行了分析。李静[10]等对西藏15个湿地生态系统中土壤氮循环微生物和多样性进行了研究。对于西藏甘曲湿地,目前已经有相关的土壤原生动物方面的报道[11],但该湿地微生物方面的研究较少。近年来,西藏经济发展逐步加快,诸多地区人流量增加,人类活动区域逐渐扩展甚至已经涉入湿地,导致部分湿地的生态环境及生态系统遭到不同程度的破坏。因此,本文分析了西藏拉萨市林周县甘曲湿地的土壤微生物多样性,为湿地微生物群落结构的认识和湿地的合理开发利用提供参考。
1 研究地概况
甘曲湿地海拔3774m,是雅鲁藏布江中游河谷的国家级湿地保护区的一部分,位于西藏拉萨市林周县甘曲镇巨荣村,为国家Ⅰ级重点保护野生动物黑颈鹤越冬栖息地和其他水禽生存的自然保护区。甘曲湿地占地面积2353亩,植被覆盖率达80%。植被类型主要为草甸、沼泽和灌木丛。主要植物包括矮嵩草(Kobesia humilis)、海韭菜(Triglochinmaririmum)、蒲公英(Taraxacummongolicum)等。湿地土壤主要为草甸土,地表部分土壤为沙土。该湿地对外开放,全年自由放牧,放牧牲畜主要是牛和驴。
2 材料与方法
2.1 土壤样品采集
2015年7月,通过实地探察,根据甘曲湿地地理条件、周围环境和研究方向,将该湿地分为面积相等的十个样地,并在各样地中间选取代表性的样点作为研究对象。记录各样点地理位置及土壤状况,用土壤采集器在每个样点取0~20cm土层土壤约100g,挑出植物细根、充分混合后用做好标记的封口塑料袋密封,并于采样当天带回实验室并置于4℃的冰箱中贮藏备用。取样时间分别为2015年7月(夏季)和2015年9月(秋季)。各采样点概况见表1。
2.2 细菌的分离及纯化
制备土壤悬浮液:分别称取各样地10g样品放入装有90mL无菌水的锥形瓶中,震荡30min,待土样与无菌水混合充分后即为10-1土壤悬液;用移液管吸取该悬液1mL于盛有9mL无菌水的试管中,均匀混合后即为10-2土壤悬液;以此类推则可制成10-3、10-4、10-5、10-6、10-7等不同稀释度的土壤溶液。
接种:用滴管分别取10-6、10-7土壤悬液200μL接于牛肉膏蛋白胨培养基平板上,均匀涂布。每个处理重复3次。
恒温培养:置于28℃恒温箱中培养2~3d。
观察和计数:比较每个样点的各稀释度悬液细菌生长状况,选取菌落长势较均匀的稀释度的培养皿,统计各培养皿中菌落数目,观察并记录各菌落的形态、大小、颜色、粘稠度、透明度、边缘情况、隆起状况、光泽度以及基本显微特征。
菌株的纯化和保藏:菌株的纯化采用平板划线法,将纯化好的斜面放置4℃保藏。
2.3 细菌的分类及鉴定
分离纯化所得细菌菌株采用经典分类法[12]进行形态学观察,并将纯化菌株送往云南大学微生物研究所,对菌株16SrRNA进行扩增和测序,测序结果在Genbank中进行序列比对分析。
2.4 数据统计及处理分析
统计夏、秋两季甘曲湿地土壤细菌群落分布,用Excel软件计算每个样点各细菌出现频率、相对丰富度和细菌多样性指数,细菌多样性指数采用物种丰富度、细菌总丰度、Pielou均匀度指数(J')、Shannon Wiener多样性指数(H′)、Simpson多样性指数(D)表示,并采用Spss软件对多样性指数进行相关性分析,计算各样点间Jaccard相似性系数。
其中:各细菌出现频率为各菌株出现的样点数与总样点数比值;
相对丰度为实验区域某种细菌总数与该区域所有细菌总数的比值;物种丰富度为某一样点菌株种数;
细菌总丰度为某一样点分离出的细菌总数量(cfu/g);
Jaccard相似性系数为两个样点共有物种数与这两个样点物种数的并集的比值;
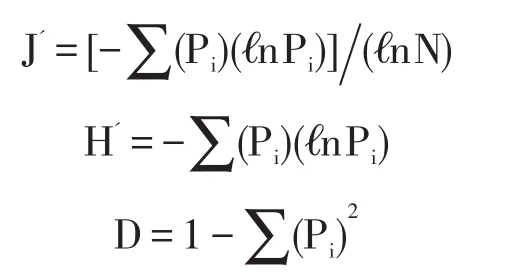
N为某一样点细菌总株数;Pi为某一样点第i种细菌菌株数与该样点的细菌总株数的比值。
3 结果与分析
3.1 甘曲湿地土壤细菌形态及基本特征
表2结果显示,甘曲湿地土壤中分离的细菌主要以白色、橙色和黄色为主,并存在一种银蓝色菌株;菌落形态以圆形为主,部分形态不规则;菌株大部分表面光泽且光滑;菌落大多隆起、不透明,存在部分扁平或半透明。10株细菌中,5株为革兰氏阴性菌,5株为革兰氏阳性菌;菌株显微形态以杆状为主。

表2 甘曲湿地土壤细菌固体培养及显微形态

表3 甘曲湿地夏季土壤细菌群落组成状况
3.2 拉萨甘曲湿地夏、秋季土壤细菌群落组成分析
3.2.1 拉萨甘曲湿地夏季土壤细菌菌落组成
表3数据表明,甘曲湿地夏季土壤共分离到6个属7个种的细菌以及一种未知菌种,其中Amromonas veronii出现频率高达100%,即该菌在各样点中均有分布;其次是Microbacterium oxyda和Bacillussubtilis subsp.Inaquosorum,出现频率分别为80%和70%,即分布较为广泛,其他种类细菌出现频率不高,为20%~40%。
夏季甘曲湿地土壤细菌中,Amromonasveronii相对丰度最高(41.82%),其次为Bacillussubtilissubsp.Inaquosorum和Microbacterium oxydans,相对丰度分别为28.41%和23.18%,Chryseobacterium grambrini和Bacillus thuringensis相对丰度分别为4.29%和1.5%,而Pseudomonaschengduensis和Stenotrophomonasrhizophila虽然在2~3个样点中均有分布,但相对丰度较低。综合分析可知,甘曲湿地夏季土壤细菌的优势菌种为Amromonasveronii。
3.2.2 甘曲湿地秋季土壤细菌菌落组成
表4数据表明,从秋季甘曲湿地土壤中分离的细菌为6个属7个种及一个未知菌种。Amromonasveronii出现频率最高(70%),即该菌分布最广泛,在7个样点中均有分布;其次是Bacillus thuringensis和Exiguobacterium artemiae,出现频率均为60%,Bacillussubtilissubsp.Inaquosorum和Microbaterium oxydans分布也较广泛,在该湿地的5个样点中均有分布,而Pseudomonaschengduensis和Novosphingobium capsulatum稍次之,出现频率均为30%。
甘曲湿地秋季土壤中Amromonasveronii、Microbaterium oxydans和Bacillussubtilissubsp.Inaquosorum相对丰度分别为33.0%、30.69%和22.82%。Novosphingobium capsulatum相对丰度为6.46%,Bacillus thurin-gensis相对丰度为4.87%,这两种菌分布较广泛,但在各样点中可培养菌株数量较少,故相对丰度稍低;而Exiguobacterium artemiae、Pseudomonaschengduensi和Bacillus thuringensis及未知菌种相对丰度均在0.39%~0.81%范围内,其中Pseudomonaschengduensis相对丰度最低,为0.39%。

表4 甘曲湿地秋季土壤细菌群落分布

表5 甘曲湿地夏季土壤各样点细菌Jaccard相似性系数
综合表3和表4可知,秋季和夏季甘曲湿地的优势细菌种均为Amromonasveronii。Stenotrophomonas rhizophila和Chryseobacterium gambrini为夏季特有,Novosphingobium capsulatum和Exiguobacterium artemiae为秋季特有。
3.3 甘曲湿地夏、秋季土壤各样点细菌群落结构相似性分析
表5数据显示,甘曲湿地夏季各样点间Jaccard相似性系数为0.14~1。不同样点间最高相似性系数为0.8,为4#和5#样点间,5#和8#样点、8#和10#样点相似性系数达到0.75,以上均属极度相似;Jaccard相似性系数最低为0.14,为2#和6#样点之间;3#分别与11#、4#、6#样点间的相似性系数介于0~0.25,即极度不相似。总的来说,0.5~0.75范围内的相似性系数最广泛,约占53.3%,属于中等相似。
从表6可以看出,甘曲湿地秋季土壤各样点细菌相似性系数在0和1之间。其中,4#和8#、5#和7#、6#和8#间Jaccard相似性系数最高,为0.6,属中等相似;1#和9#、1#和10#、2#和9#、3#和10#间相似性系数为0。总的来说,秋季各样点间相似性系数约为50%,介于0.25~0.5,即属于中等不相似。
3.4 甘曲湿地夏、秋季土壤细菌多样性指数分析
表7结果表明,1#样点物种最丰富,有6种细菌,其次是4#、6#、7#物种丰富度均为5;7#样点细菌总丰度最高,其次是5#和8#;1#样点Simpson多样性指数(D)最高(0.7326),即物种多样性最丰富,而4#样点ShannonWiener多样性指数(H′)和Pielou均匀度指数(J')最高,即该样点群落最复杂,分别为1.9430和0.2770。综合各多样性指数,1#和4#样点种群最丰富,群落稳定性最强。5#、6#、7#样点多样性也较丰富,而3#样点群落组成单一,只存在一种菌株,即维氏气单胞菌Amromonasveronii,故ShannonWiener多样性指数(H′)、Pielou均匀度指数(J')和Simpson多样性指数(D)最低,均为0。
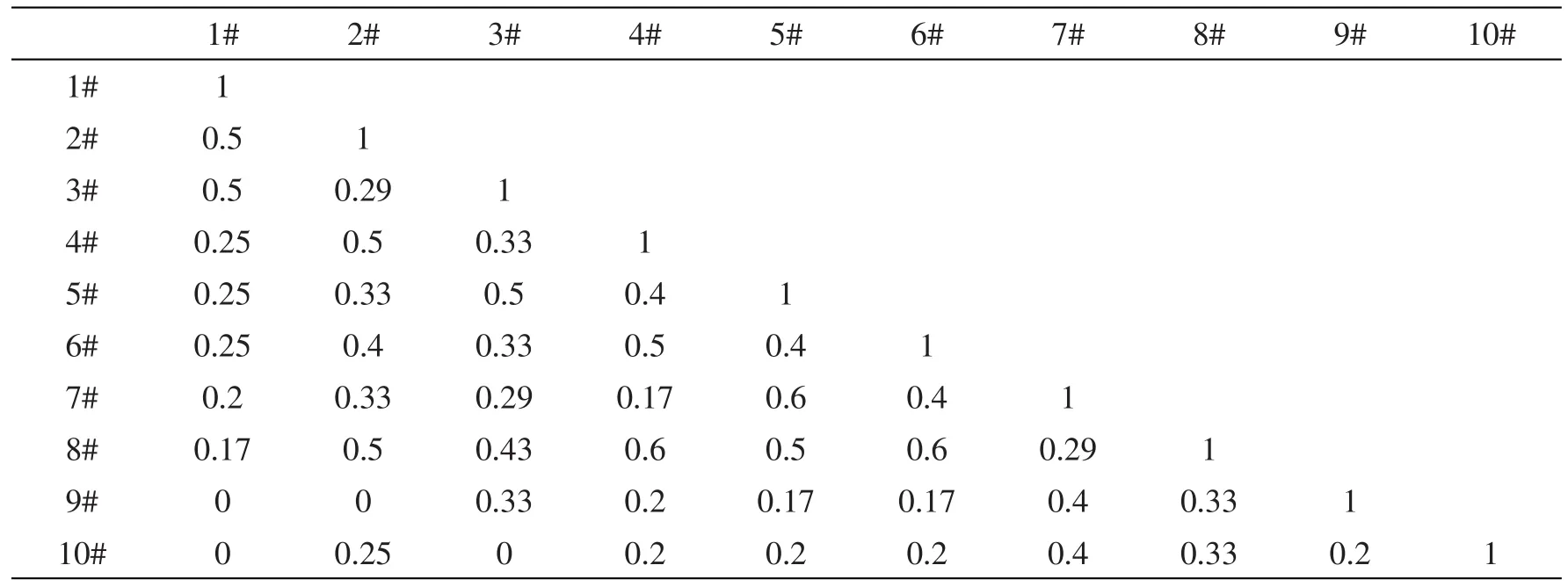
表6 甘曲湿地秋季土壤各样点细菌Jaccard相似性系数

表7 甘曲湿地夏季土壤细菌多样性指数
表8结果显示,甘曲湿地秋季土壤中,3#样点物种丰富度最高,为5;5#样点细菌总丰度最高;8#样点物种多样性最丰富,群落最复杂,稳定性最强。和夏季多样性指数相比较,1#样点物种丰富度和细菌总丰度均有所减少,且多样性指数降为最低。

表8 甘曲湿地秋季细菌多样性指数

表9 甘曲湿地夏季土壤细菌多样性指数Pearson相关性分析
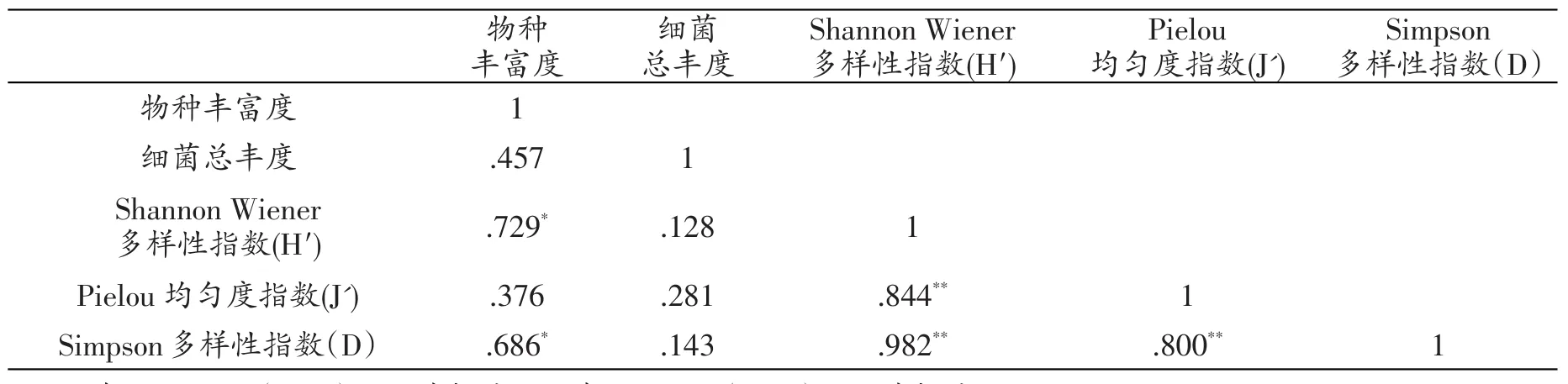
表10 甘曲湿地秋季土壤细菌多样性指数Pearson相关性分析
3.5 甘曲湿地夏、秋季土壤细菌多样性指数相关性分析
Pearson相关性分析表明(见表9),甘曲湿地夏季土壤细菌物种丰富度与J'和D存在极显著正相关性(P<0.01);而Pielou均匀度指数(J')与Simpson多样性指数(D)则显著正相关(P<0.05)。
表10结果显示,甘曲湿地秋季土壤细菌物种丰富度与细菌总丰度、Pielou均匀度指数影响均不显著,与ShannonWiener多样性指数(H′)、Simpson多样性指数(D)则呈显著正相关(P<0.05);Shannon Wiener多样性指数、Pielou均匀度指数(J')、Simpson多样性指数(D)之间两两极显著正相关(P<0.01)。
4 结论
对夏季和秋季分离自甘曲湿地土壤细菌进行分子鉴定,将其归为10种,主要包括Bacillussubtilis sub sp.Inaquosorum,Microbacterium oxydans,Bacillus thuringiensis,Stenotrophomonas rhizophila,Chryseobacterium gambrini,Novosphingobium capsulatum,Amromonas veronii,Pseudomonas chengduensis和Exiguobacterium artemiae等9种菌和一种未知菌株。其中Amromonasveronii是夏、秋两季的优势种,Amromonasveronii、Bacillus subtilis subsp.Inaquosorum、Microbacterium oxydans是夏、秋两季的主要菌株,而S tenotrophomonas rhizophila和Chryseobacterium gambrini为夏季特有,Novosphingobium capsulatum和Exiguobacterium artemiae为秋季特有。
5 讨论
本研究对夏、秋两季拉萨甘曲湿地进行设点,培养、分离并鉴定出该湿地土壤细菌,比较分析各样点间群落结构差异和夏、秋两季多样性差异。作为同一试验地的10个样点,在夏、秋两季的研究中,1#、3#、6#等样点的群落结构和多样性指数出现明显差异,这可能由于细菌主要类群的种类与数量在不同季节存在差异,导致不同季节相同样点细菌多样性指数存在差异。另外,在植物生长旺盛的夏季,植物的根系分泌物对土壤环境产生影响[13],而秋季少量植物凋零进入土壤,改变了微生物可利用底物的组成(与夏季旺盛的植物根系代谢物相比可能更单一),从而导致土壤细菌的群落结构产生较明显的变化。除此之外,西藏独有的高原气候、高原生境,以及该湿地常有牛、驴群等放牧,不同时间不同动物和人类的频繁活动及牲畜代谢物很大程度上也直接影响该湿地表层土壤微生物群落的多样性。
[1]杨平,仝川.淡水水生生态系统温室气体排放的主要途径及影响因素研究进展[J].生态学报,2015,35(20):6868-6880.
[2]罗怀斌.西藏高原湿地面临主要问题及保护对策[J].中南林业调查规划,2014,33(1):32-35.
[3]陈月星,温晓霞,孙瑜琳,等.地表覆盖对渭北旱作苹果园土壤细菌群落结构及多样性的影响[J].微生物学报,2015,55(7):892-904.
[4]陈秀荣,南志标.细菌多样性及其在农业生态系统中的作用[J].草业科学,2002,19(9):34-37.
[5]王岳坤,洪葵.红树林土壤细菌16SrDNA V3片段PCR产物的DGGE分析[J].微生物学报,2005,45(2):200-204.
[6]Klose SWernecke K D.Makeschin FMicrobialactivities in fores soils exposed to chronic depoditions from a lignite power plant [J].Soil Biology and Biochemitry,2004,36:1913-1923.
[7]夏北成,ZhouJ,Tiedje JM.土壤细菌类克隆群落及其结构的生态学特征[J].生态学报,2001,21(4):573-578.
[8]庞欣,张福锁,王敬国.不同氮素水平对微生物生物量氮和微生物活性的影响[J].植物营养与肥料学报,2000,6(4):476-480.
[9]赵垦田,杨小林,马和平,等.拉萨半河谷砂生槐灌丛生态恢复过程的群落特征与土壤微生物动态分析[J].林业科学,2013,49 (2):15-20.
[10]李静,陈芝兰,李小卫.西藏湿地生态系统中氮素循环微生物数量和多样性研究[J].西藏科技,2015,265(4):70-72.
[11]普布,向丹丹,司联邦,等.西藏甘曲湿地秋季土壤肉鞭虫多样性探究[J].西藏大学学报(自然科学版),2015,30(2):9-15.
[12]Kurtzman CP,Fell JW,Boekhout T.The Yeast:A Taxonomic Study(5th eds)[M].Elsevier Science,2011.
[13]张重义,陈慧,杨艳会,等.连作对地黄根际土壤细菌群落多样性的影响[J].应用生态学报,2010,21(11):2843-2848.
Isolation and identification ofbacteria in soilofGanquWetland in summer and autumn at Linzhou County,Lhasa
Deji LiYuan Qiangjiu Baimu QimiZhuoga Yang Deng
(Schoolof Science,TibetUniversity,Lhasa 850000,Tibet)
Soilmicroorganism has an importantecological function in thewetland ecosystem in the Tibetan Plateau.Soil bacteria were isolated by using the dilution method and purified from 10 soil samples in Ganqu wetland.The results showed that the 10 isolated bacteria can be classified into 8 species,including Bacillus subtilis subsp.Inaquosorum,Microbacterium oxydans,Bacillus thuringiensis,Stenotrophomonas rhizophila,,Chryseobacterium gambrini,Novosphingobium capsulatum,Amromonas veronii,Pseudomonas chengduensis,Exiguobacterium artemiaeand one unknownstrain.Amromonas veroniiwasdominant in both summerand autumn,while Stenotrophomonas rhizophila and Chryseobacterium gambriniwere special in summer,and Novosphingobium capsulatumand Exiguobacterium artemiaewere only found in autumn samples.Diversity analysis indicated that the summer samples 1#and 4#havemost abundant species,the species abundance in sample 3#was relatively low, while species abundancewas in autumn sample 8#was high and low in sample 1#.The species diversity of soil bacteriawasdifferent in summerand autumn samples in Ganquwetland.
Lhasa;GanquWetland;soil;bacteria diversity;summer;autumn
10.16249/j.cnki.54-1034/c.2016.02.002
S153.6
A
1005-5738(2016)02-010-008
[责任编辑:张建伟]
2016-08-19
2016年度西藏自治区自然科学基金项目“西藏拉鲁湿地水体酵母菌多样性及其与环境因子相关性研究”(项目号:2016ZR-15-11);2014年度国家级大学生创新创业训练项目“拉萨市河谷微生物群落研究”(项目号:2014XCX002);2016年度西藏大学珠峰学者人才发展支持计划(项目号:藏大字[2016]141号)阶段性成果。
德吉,女,藏族,西藏日喀则人,西藏大学理学院讲师,主要研究方向为微生物生态学。
