MicroRNA-124 rs531564、m icroRNA-26A rs7372209和m icroRNA-126 rs4636297多态性与结直肠癌易感性关联研究
2017-01-11刘剑荣陈小林
刘剑荣,陈小林
(江西省萍乡市人民医院检验科,江西萍乡337055)
MicroRNA-124 rs531564、m icroRNA-26A rs7372209和m icroRNA-126 rs4636297多态性与结直肠癌易感性关联研究
刘剑荣,陈小林
(江西省萍乡市人民医院检验科,江西萍乡337055)
目的探讨m icroRNA-124 rs531564(m iR-124 rs531564)、m icroRNA-26A rs7372209(m iR-26A rs7372209)和m icroRNA-126 rs4636297(m iR-126 rs4636297)基因多态性与结直肠癌遗传易感的关系。方法利用聚合酶链式反应-连接酶检测反应(PCR-LDR)技术,对724例结直肠癌患者和626例健康对照个体的m iR-124 rs531564、m iR-26A rs7372209和m iR-126 rs4636297多态位点进行分型。采用非条件逻辑回归分析统计该多态位点与结直肠癌易感的相关性,计算相对危险度的比值比()及95%置信区间(CI)。结果该试验中m iR-126 rs4636297多态位点,在病例中经调整年龄、性别、吸烟、饮酒等影响相对于CC基因型个体,发现携带AG或AA的基因型个体与结直肠癌的患病风险有一定的相关性(P<0.05),调整后的(95%)分别为[1.289(1.007,1.650)和1.383(0.396,4.834)]。相对于G等位基因,A等位基因显著提高个体患结直肠癌的风险(=1.307,95%CI=1.054,1.622,P=0.013);还发现携带A等位基因(AG+AA)的个体患结直肠癌风险是携带GG基因型个体的1.327倍(AG+AA vsGG,=1.327,95%CI=1.042,1.688,P=0.019)。而m iR-124 rs531564、m iR-26A rs7372209位点的多态性并未发现不同基因型个体与结直肠癌的患病风险相关(P>0.05)。结论m iR-126 rs4636297基因多态性与结直肠癌的遗传易感有密切关系,携带A等位基因可能是促进结直肠癌发病风险的重要因素。
m icroRNA-124;m icroRNA-26A;m icroRNA-126;单核苷酸多态性;结直肠癌;易感性
结直肠癌(colorectal cancer,CRC)是我国肿瘤发病率和死亡率常见恶性肿瘤[1-2]。由于缺乏更为有效的早期诊断、风险评估和预后判断指标和临床治疗手段,患者5年生存率较低。部分研究表明结直肠癌是环境因素与相关基因共同交互作用的结果。全基因组关联研究结果揭示相关基因单核苷酸多态性和拷贝数变异及CpG岛异常甲基化等都可导致CRC的发生和发展[3-5],为此CRC相关候选基因的分子和表观遗传研究是阐明其发病机制的重要研究方向[6]。而目前已知CRC致病基因的功能异常只能解释少数临床病例,而大部分病例精确的分子调控机制尚未阐明。因此,探索相关候选基因与CRC的关系对揭示其精确的分子发病机制、设计合理治疗药物、筛选更为特异有效的临床诊断和预后判断指标,以及进一步提高CRC的治疗水平具有重要意义。
McroiRNA-124(miR-124)、microRNA-126(miR-126)和microRNA-26A(miR-26A)是近年来在结直肠癌的发病发展过程中新鉴出发挥重要作用的分子[7-9]。上述3个miRNA分子在CRC进展中都发挥抑癌基因作用,笔者推测该miRNA基因可能是CRC潜在的风险易感基因。然而,国内外尚未有见miR-124、miR-126和miR-26A基因遗传多态性和CRC的关联研究报道,上述3个基因的遗传多态性位点与CRC的关系尚不清楚。因此本研究拟通过病例-对照研究,探讨以上3个位点的多态性与结直肠癌遗传易感之间的关系,为结直肠癌的预防和治疗提供新的思路。
1 资料与方法
1.1 研究对象
选取2013年9月-2015年9月江西省萍乡市人民医院住院结直肠癌患者。对照组人群来自同期萍乡市人民医院体检正常人群。所有病例患者和正常健康个体均为无血缘关系的汉族人群。所有结直肠癌患者均为经组织学病理确诊的新发病例,本研究进行的现场面对面调查均征得受试者本人的知情同意。
1.2 基因组DNA提取
问卷调查结束后,经研究对象知情同意,抽提每份样品均取静脉血2ml,EDTA-K2抗凝,按照TIAN amp血液基因组DNA提取试剂盒说明抽提外周血基因组,提取的DNA在-80℃冰箱冷冻保存备用,采用PCR-LDR方法对miR-124 rs531564、miR-26A rs7372209和miR-126 rs4636297多态进行基因分型。见表1。

表1 引物序列
1.3 统计学方法
采用SPSS 17.0统计软件进行数据分析,采用χ2检验多态位点的基因型分布是否符合Hardy-Weinberg平衡;同时Pearson'sχ2检验比较结直肠癌患者与正常对照人群的基因型分布差异;计算比值比(odds ratios,ORs)及其95%置信区间(confidence intervals,CI)分析基因型与结直肠癌发生危险性的关系。所有的统计检验均为双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 病例组与对照组基本特征因素分布的比较
本次研究总共纳入符合标准的结直肠癌患者724例,以及626例健康体检人群作为对照组(排除肿瘤疾病),并获得研究对象基因分型数据和完整的基本临床特征资料。结直肠癌组中最小年龄21岁,最大年龄86岁,平均(56.5±10.8)岁;男性415例,女性309例;健康对照组中最小年龄18岁、最大年龄81岁,平均(53.9±12.7)岁;男性390例,女性236例。两组在性别、年龄上差异无统计学意义(P>0.05)。结直肠癌组中吸烟、饮酒等情况差异无统计学意义(P>0.05)。见表2。
2.2 3个位点基因型分布及多态性与结直肠癌易感性的关系
2.2.1 M iR-124 rs531564多态性与结直肠癌遗传易感的关系本研究中CC、CG和GG基因型在结直肠癌组中的频率分别为71.5%、26.0%和2.5%,在对照组中分别为72.2%、25.6%和2.2%,基因型的分布差异有统计学意义(χ2=6.35,P=0.042)。结果提示,经调整年龄、性别、吸烟、饮酒等影响因素,并未发现携带CG或GG的基因型个体与结直肠癌的患病风险相关(P>0.05),调整后的( 95%)分别为1.026(0.801,1.314)和1.192(0.576,2.470)。而相对于C等位基因,携带G等位基因的个体也未降低患结直肠癌的风险=1.049,95%CI:0.848,1.296,P= 0.744]。另有统计结果还说明,并未发现携带G等位基因(CG+GG)的个体与结直肠癌的患病风险有相关性(P>0.05),具体数据是([CG+GG vs CC= 1.043,95%CI:0.821,1.325,P=0.789)]。见表3。
2.2.2 M iR-26A rs7372209多态性与结直肠癌遗传易感的关系本研究中结直肠癌组718例CC、CT和TT基因型在结直肠癌组中的频率分别为54.5%、37.3%和8.2%,在对照中分别为53.4%、40.3%和6.3%。结果发现,经调整年龄、性别、吸烟、饮酒等影响相对于CC基因型个体,并未发现携带CT或TT的基因型个体与结直肠癌的患病风险相关(P>0.05),调整后的OR(95%)分别为0.914(0.729,1.146)和1.294(0.841,1.991)。而相对于C等位基因,携带T等位基因的个体也没有降低患结直肠癌的风险(=1.025,95%CI:0.863,1.217,P=0.832)。另外并未发现携带T等位基因(CT+TT)的个体与结直肠癌患病风险有关联性(P>0.05),调整后的具体结果为(CT+TTvsCC=0.964,95%CI:0.777,1.196,P= 0.686)。见表4。
2.2.3 MiR-126 rs4636297多态性与结直肠癌遗传易感的关系本研究中结直肠癌组721例GG、AG和AA基因型在病例中的频率分别为69.3%、28.3%和2.4%,在对照中分别为75.1%、23.6%和1.3%。经调整年龄、性别、吸烟、饮酒等影响相对于CC基因型个体,发现携带AG或AA的基因型个体与结直肠癌的患病风险有一定的相关性(P<0.05),调整后的OR(95%)分别为1.289(1.007,1.650)和1.383(0.396,4.834)。等位基因的相关数据显示,相对于G等位基因,A等位基因显著提高个体患结直肠癌的风险(=1.307,95%CI:1.054,1.622,P=0.013),提示A等位基因对宫颈癌的遗传易感具有损害促进作用。另外统计分析还发现携带A等位基因(AG+AA)的个体患结直肠癌的风险是携带GG基因型个体的1.327倍(AG+AA vsGG=1.327,95% CI:1.042,1.688,P=0.019)。见表5。
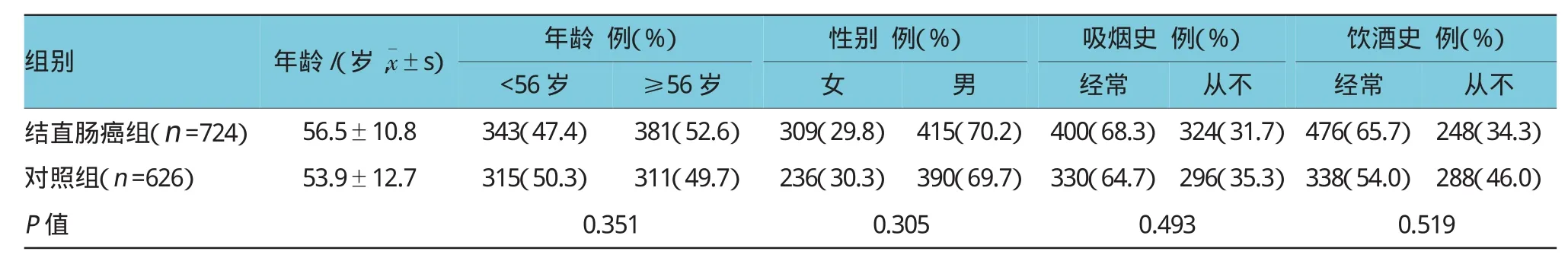
表2 两组的临床基线特征比较
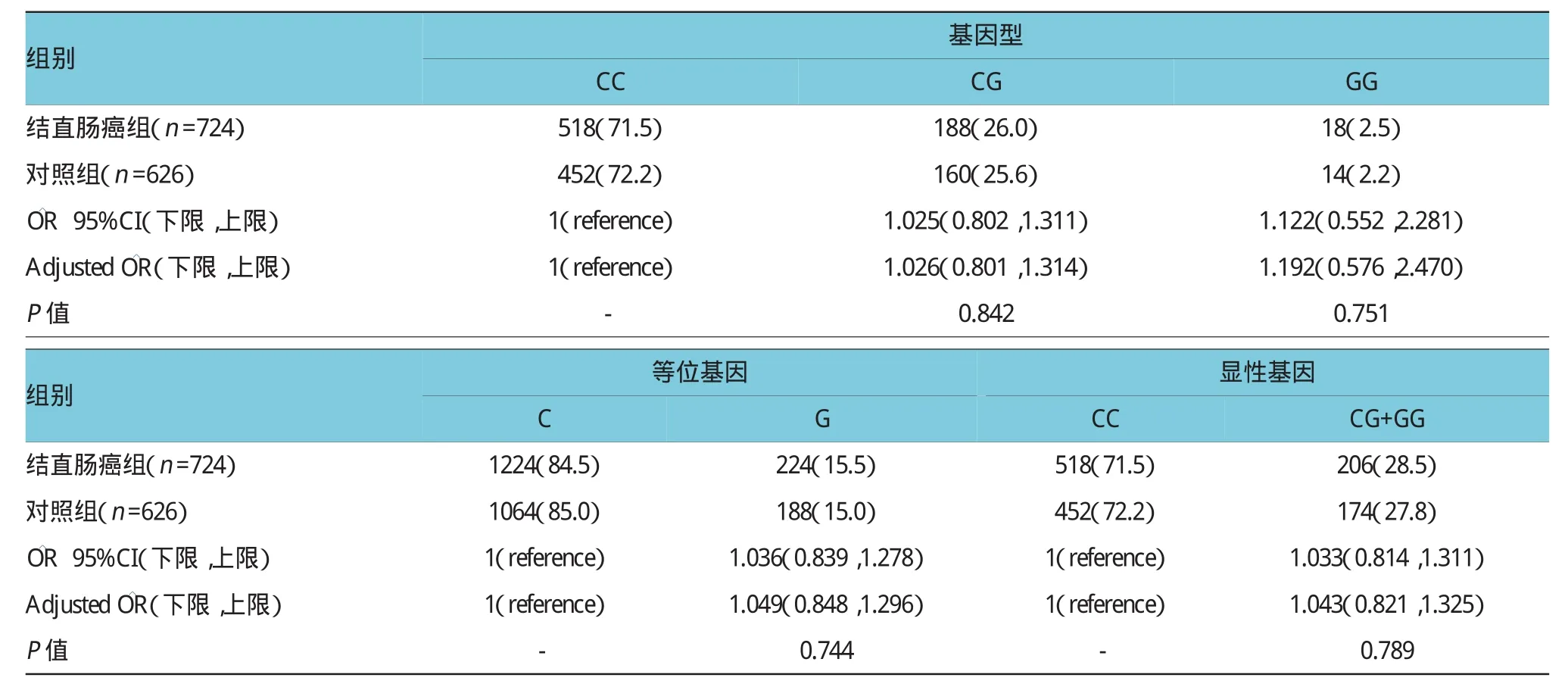
表3 MiR-124 rs531564多态性与结肠直肠癌发病风险之间的关联例(%)
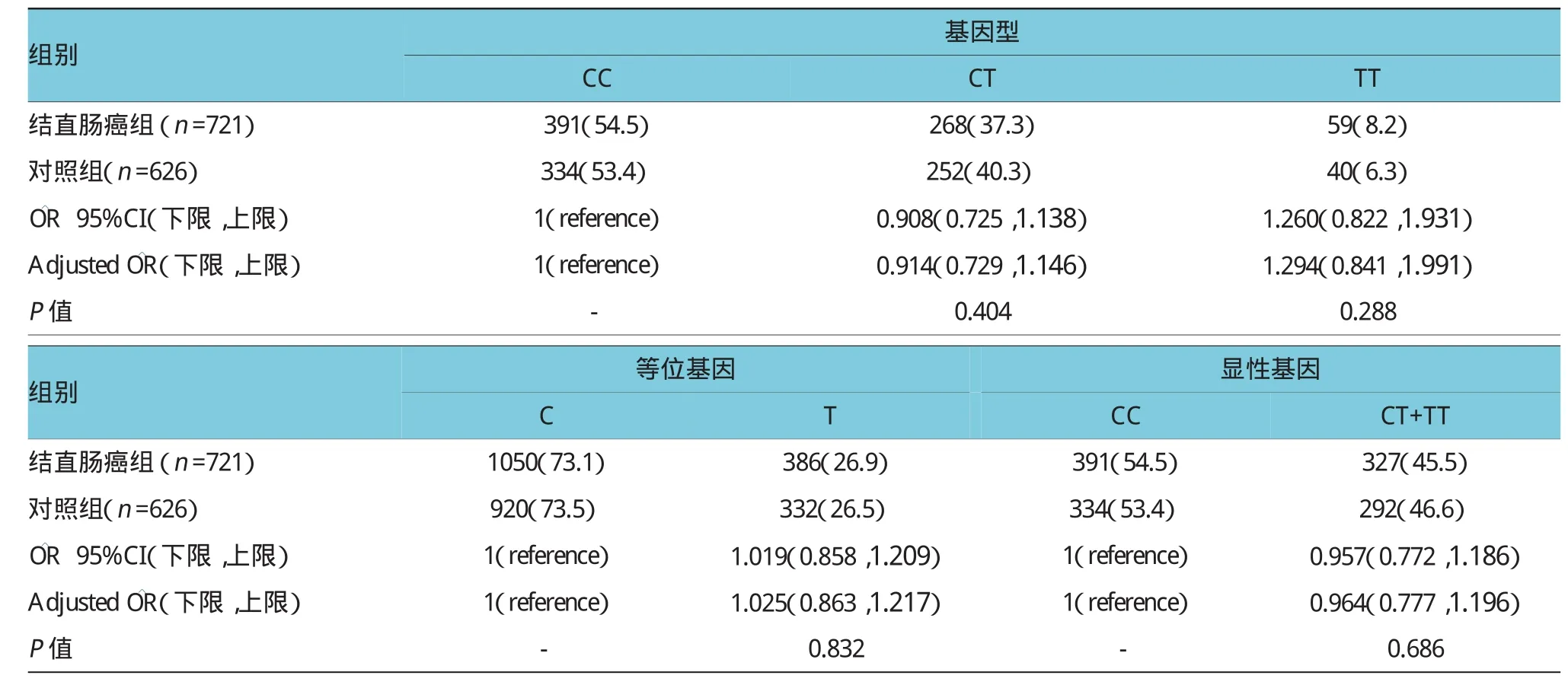
表4 MiR-26A rs7372209多态性与结肠直肠癌发病风险之间的关联例(%)
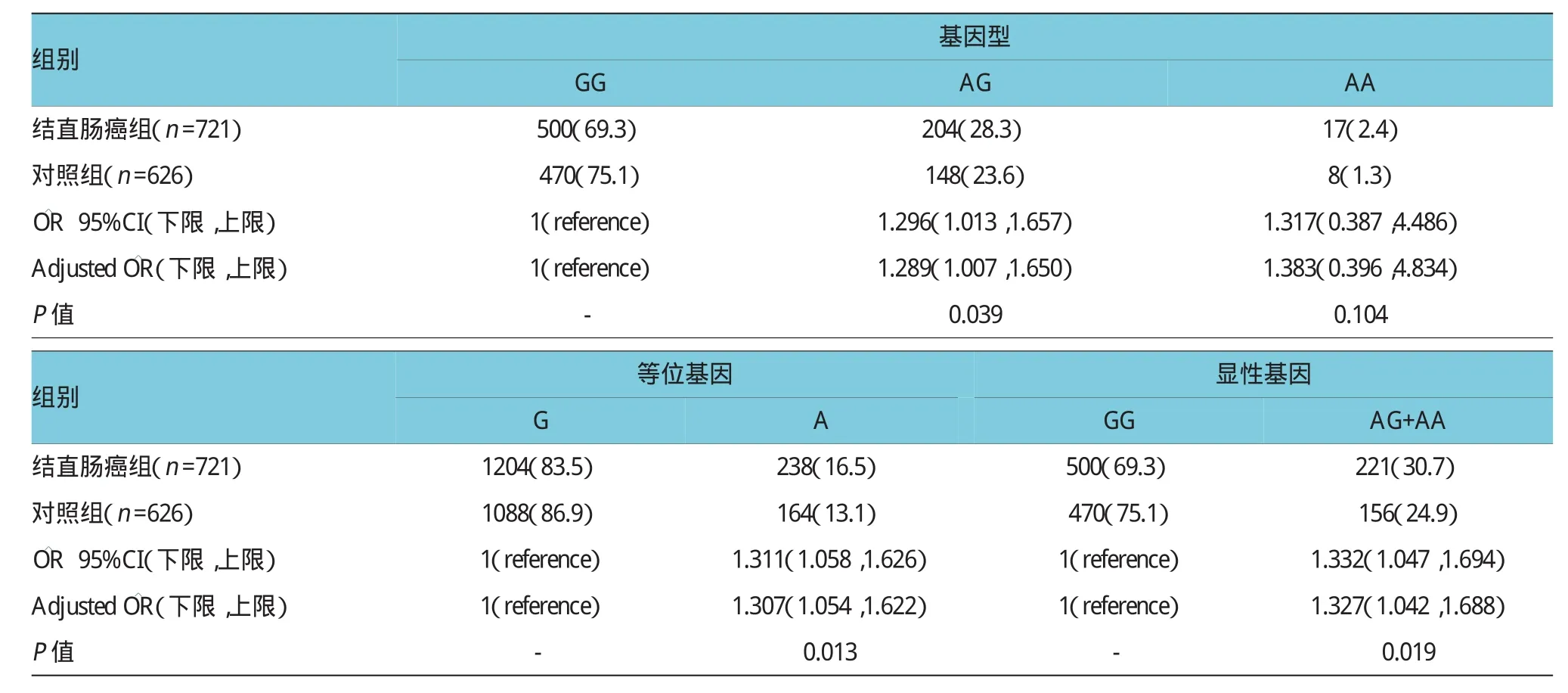
表5 MiR-126 rs4636297多态性与结肠直肠癌发病风险之间的关联例(%)
3 讨论
近年来,miRNA自身基因多态性与恶性肿瘤之间的关系开始受到关注,并发现某些miRNA基因SNPs与乳腺癌、肺癌、结肠癌等恶性肿瘤的发病相关[10-12]。内源性或外源性的诱变因素可损伤细胞的DNA,如果损伤不能修复,可能导致程序性细胞死亡或无节制的细胞增殖和肿瘤的发生。虽然miRNA并不编码蛋白质,但是普遍认为miRNA自身基因上的多态性改变可能会通过影响miRNA的成熟及与下游靶基因的结合等过程,从而调控目的基因的转录、表达和生物学功能,从而最终影响个体对不同疾病的易感性及药物治疗的有效性等[13-14]。
MiR-124、miR-126和miR-26A是近年来在结直肠癌发病发展过程中新鉴出发挥重要作用的分子。PKM1/2分子协助HNF4a转录因子结合miR-214基因的启动子区,上调miR-124的转录水平,高表达的miR-214可进一步激活线粒体凋亡信号通路促进CRC细胞的凋亡[7];MiR-124还可以通过与靶基因STAT3基因结合,促进结直肠癌细胞凋亡并降低肿瘤的生长,进而发挥抑癌基因作用,同时miR-124还可调控PRRX1基因的表达提高CRC细胞系对放疗的敏感性[17]。MiR-126在CRC组织中低表达,其可调控靶基因IRS-1和CXCR4通过AKT、ERK1/2和RhoA/ROCK信号通路途径抑制CRC细胞增殖,侵袭和迁移[8]。miR-26a的含量在结肠癌组织中下调,并且miR-26a下调与结肠癌临床分期、浸润深度以及淋巴结转移相关,进而抑制CRC细胞分化、促进其凋亡[9,18]。
本试验的结果表明,通过对724例患者的miR-126基因rs4636297多态位点与结直肠癌的关系进行分析,结果发现rs4636297中携带A等位基因患者的患病风险高于携带G等位基因的病例。基因型的分析结果显示,携带基因型AA可增加结直肠癌的患病风险,同时与GG基因型相比,携带A等位基因的个体(AG+AA)升高患结直肠癌的易感风险。该结果提示miR-124基因rs531564单核苷酸多态性与广东地区汉族妇女宫颈癌的遗传易感有密切关系,G等位基因可能是降低宫颈癌发病风险的一个因素。因此,在调整年龄、性别、吸烟、饮酒等影响因素,携带突变基因型AA可增加结直肠癌患病风险,但是未发现miR-124基因RS531564位点和miR-26A基因rs737220位点多态性与结直肠癌易感性存在相关联系。该结果提示miR-126基因rs4636297单核苷酸多态性与结直肠癌的遗传易感有密切关系。
有相关的研究已经证实,miRNA-126可以通过与VEGF mRNA中的互补位点进行结合,从而在翻译水平上抑制VEGF的表达[9,18]。在结直肠癌中表达异常降低或缺失,启动子区的甲基化修饰是miRNA-126表达降低的重要原因。其研究表明恢复表达miRNA-126可以抑制结直肠癌细胞的迁移和侵袭能力,并且通过抑制肿瘤细胞分泌VEGF而抑制肿瘤血管的生成。这说明结直肠癌中miRNA-126表达的降低或缺失,是造成肿瘤异常高表达VEGF从而促进肿瘤细胞侵袭以及肿瘤血管生成的重要原因。而本研究的结果提示miR-126 rs531564 G等位基因在病例组中的分布频率低于正常对照组,说明相对于等位基因G,携带等位基因A可能是增加结直肠癌发病风险的一个因素。
综上所述,本研究通过对miR-124 rs531564、miR-26A rs7372209和miR-126 rs46362973个多态位点进行分析,发现miR-126 rs4636297基因多态性与结直肠癌的遗传易感有密切关系,患者携带A等位基因可能是促进结直肠癌发病风险的重要因素之一。而miR-124 rs531564、miR-26A rs7372209两个位点多态性均未发现与结直肠癌的遗传易感有密切联系。由于结直肠癌的发生是一种多基因及多环境因素联合作用的复杂过程,因此,本研究的实验结果仍需在不同地区人群和更大样本中进行验证,并对其易感机制进行深入研究。
[1]CHEN W Q,ZHENG R S,ZHANG SW,et al.Incidences and mortalities of major cancers in China,2009[J].Chin J Cancer, 2013,32(3):106-112.
[2]STEWART BW,WILD CP.World Cancer Report 2014.International Agency for Research on Cancer[J].World Health Organization,2014:505.
[3]YANG R,CHEN B,PFÜTZE K,et al.Genome-wide analysis associates familial colorectal cancer with increases in copy number variations and a rare structural variation at 12p12.3[J].Carcinogenesis,2014,35(2):315-323.
[4]JIA W H,ZHANG B,MATSUO K,et al.Genome-wide association analyses in East Asians identify new susceptibility loci for colorectal cancer[J].Nat Genet,2013,45(2):191-196.
[5]HINOUE T,WEISENBERGER D J,LANGE CP,et al.Genomescale analysis of aberrant DNA methylation in colorectal cancer[J]. Genome Res,2012,22(2):271-282.
[6]VOGELSTEIN B,PAPADOPOULOS N,VELCULESCU V E,et al.Cancer genome landscapes[J].Science,2013,339(6127):1546-1558.
[7]ZHANG Y,ZHENG L,HUANG J,et al.MiR-124 radiosensitizes human colorectal cancer cells by targeting PRRX1[J].PLoS One,2014,9(4):DOI:10.1371/journal.pone.0093917.
[8]KHELLA H W Z,SCORILAS A,MOZES R,et al.Low expression of miR-126 is a prognostic marker for metastatic clear cell renal cell carcinoma[J].The American Journal of Pathology,2015, 185(3):693-703.
[9]GHANBARI R,MOSAKHANI N,ASADI J,et al.Downregulationof Plasma MiR-142-3p and MiR-26a-5p in patients with colorectal carcinoma[J].Iranian Journal of Cancer Prevention,2015, 8(3):89-93.
[10]SUNG JJY,NG SC,CHAN F K L,et al.An updated Asia Pacific Consensus Recommendations on colorectal cancer screening[J].Gut,2015,64(1):121-132.
[11]SALZMAN DW,WEIDHAAS JB.SNPing cancer in the bud: microRNA and microRNA-target site polymorphisms as diagnostic and prognostic biomarkers in cancer[J].Pharmacology& therapeutics,2013,137(1):55-63.
[12]LUAN Y,ZUO L,ZHANG S,et al.MicroRNA-126 acts as a tumor suppressor in glioma cells by targeting insulin receptor substrate 1(IRS-1)[J].International Journal of Clinical and Experimental Pathology,2015,8(9):10345-10354.
[13]GONG J,TONG Y,ZHANG HM,et al.Genome‐wide identification of SNPs in microRNA genes and the SNP effects on microRNA target binding and biogenesis[J].Human Mutation, 2012,33(1):254-263.
[14]THOMAS L F,SAETROM P.10 Finding SNPs that affect microRNA regulation in disease-associated genomic regions[J]. Genome-Wide Association Studies:From Polymorphism to Personalized Medicine,2016:139.
[15]GÖRÜCÜY S,ERDAL M E,AVCIÖA,et al.SNP variation in MicroRNA biogenesis pathway genes as a new innovation strategy for alzheimer disease diagnostics:a study of 10 candidate genes in an understudied population from the eastern mediterranean[J].Alzheimer disease and associated disorders,2016,30(3): 203-209.
[16]MULLANY LE,WOLFF RK,HERRICK JS,et al.SNP regulation ofmicroRNA expression and subsequent colon cancer risk[J]. PloS one,2015,10(12):DOI:10.1371/journal.pone.0143894.
[17]SUN Y,ZHAO X,LUO M,et al.The pro-apoptotic role of the regulatory feedback loop between miR-124 and PKM1/HNF4α in colorectal cancer cells[J].Int JMol Sci,2014,15(3):4318-4332.
[18]LI N,TANG A,HUANG S,et al.MiR-126 suppresses colon cancer cell proliferation and invasion via inhibiting RhoA/ROCK signaling pathway[J].PLoS One,2013,8(11):107-119.
(张蕾编辑)
Correlation analysis between m iR-124 rs531564、m iR-26A rs7372209 and m iR-126 rs4636297 polymorphisms and susceptibility to colorectal cancer
Jian-rong Liu,Xiao-lin Chen
(Departmentof Laboratory,the People's Hospital of Pingxiang, Pingxiang,Jiangxi337055,China)
ObjectiveTo investigate themiR-124 rs531564,MiR-26A rs7372209 and MiR-126 rs4636297 gene polymorphism and colorectal cancer genetic susceptibility.MethodsPolymerase chain reaction-ligase detection reaction(PCR-LDR)technology was used to detect 724 cases of colorectal cancer patients and 626 healthy control individuals of miR-124 rs531564,MiR-26A RS7372209 and MiR-126 RS4636297 polymorphism point type. Unconditional logistic regression analysis correlationwas used to calculate the relative risk of the statistical ratio of polymorphic lociand colorectal cancer susceptibility ratio()and 95%confidence intervals(CI).ResultsThe test MiR-126 RS4636297 polymorphic loci,in cases adjusted for age,sex,smoking,alcohol consumption and otherfactors with respect to the CC genotype,showed that a certain correlation between the AA or AG genotype and colorectal cancer(P<0.05),(95%)were adjusted{1.289(1.007,1.650)and 1.383(0.396,4.834)}with respect to the G allele.A allele significantly increased individual risk of colorectal cancer risk(=1.307,95%CI=1.054, 1.622,P=0.013).The study also found that the risk of colorectal cancer for A allele(AG+AA)individuals was 1.327 times of GG genotype(AG+AA vs GG,=1.327,95%CI=1.042,1.688,P=0.019).No correlation between the miR-124 rs531564,MiR-26A rs7372209 polymorphism loci and colorectal cancer risk(P>0.05).ConclusionsMiR-126 rs4636297 polymorphism and colorectal cancer is closely related to genetic susceptibility, and A allelemight promote the incidence of colorectal cancer important risk factors.
miR-124;MiR-26A;MiR-126;single nucleotide polymorphism;colorectal cancer;susceptibility
R 735.3
A
10.3969/j.issn.1005-8982.2016.24.007
1005-8982(2016)24-0033-06
2016-03-15
