结核分枝杆菌临床分离株利福平和异烟肼耐药性检测方法比较*
2017-01-11李同霞江国峰郝文嘉曹佳伟苏海涛肖谦王丙瑞
李同霞,江国峰,郝文嘉,曹佳伟,苏海涛,肖谦,王丙瑞
(山东省青岛市胸科医院1.结核科,2.检验科,山东青岛266043;3.山东省青岛市第九人民医院内科,山东青岛266000;4.山东省无棣县佘家镇卫生院,山东无棣251900)
临床论著
结核分枝杆菌临床分离株利福平和异烟肼耐药性检测方法比较*
李同霞1,江国峰2,郝文嘉1,曹佳伟2,苏海涛1,肖谦3,王丙瑞4
(山东省青岛市胸科医院1.结核科,2.检验科,山东青岛266043;3.山东省青岛市第九人民医院内科,山东青岛266000;4.山东省无棣县佘家镇卫生院,山东无棣251900)
目的探讨基因芯片法和改良罗氏培养及比例法药敏试验在结核分枝杆菌(MTB)利福平(RFP)和异烟肼(INH)耐药性测定中的应用价值。方法应用基因芯片法检测200株MTB临床分离株RFP耐药基因rpoB的6个位点、13种突变型,INH耐药基因katG的1个位点、2个突变型和INH inhA基因启动子-15位、1个C→T突变型。同时对MTB菌株进行罗氏培养及比例法药敏试验,并比较测定结果的敏感性、特异性和符合率。结果基因芯片法检测敏感株152株、耐药株48株,罗氏比例法检测敏感株161株、耐药株39株。若以罗氏比例法测定结果为判断标准,基因芯片法检测RFP耐药性的敏感性、特异性和符合率分别为85.0%、98.8%和97.5%;检测INH耐药性的敏感性、特异性、符合率分别为82.8%、92.4%和91.0%。结论基因芯片法对结核菌耐药菌株可做出初筛,与结核菌药敏试验联合检测可提高诊断率。
分枝杆菌,结核;药物敏感性;基因芯片;比例法;异烟肼;利福平
据世界卫生组织估算,目前全球已有20亿人感染结核分枝杆菌,每年新发结核患者达1 000万例,约有180万人因结核病死亡。近年来,耐药结核病疫情日趋严重,已成为结核病控制困难、死亡率增高的重要原因。利福平(Rifampicin,RFP)和异烟肼(Isoniazid,INH)是治疗结核病的最有效药物,但是近年来RFP和INH的耐药率显著上升,全国第5次结核病流行病学抽样调查,我国耐多药肺结核现状不容乐观,初始耐多药率最高地区10.4%,最低2.1%,获得性耐多药率最高地区36.8%,最低7.9%,总耐多药率最高16.1%,最低3.5%[1]。因此,快速、准确地测定结核分枝杆菌(MTB)对RFP和INH的耐药性已成为有效控制结核病的关键。目前,改良罗氏培养加药敏仍是基层医院检测结核菌耐药的主要手段,较Bactec-960价廉,但是需时长;基因芯片技术日臻成熟,检测结核分枝杆菌对RFP、INH的耐药性,耗时少,可大大缩短耐多药肺结核的诊断时间。本研究通过比较2种检测方法,分析其在耐多药肺结核诊治中的价值。
1 资料与方法
1.1 一般资料
1.1.1 菌株来源随机选取2013年1月-2014年12月青岛市胸科医院结核科门诊和住院患者200例。取患者痰液、肺泡灌洗液等为标本,按全国结核病细菌学检验标准化规程进行分枝杆菌分离培养,菌种鉴定,保存于菌株库。所有患者诊断均依据2006年版《临床诊疗指南结核病分册》的诊断标准确诊[2],经痰或肺泡灌洗液结核分枝杆菌培养阳性的结核病患者。结核分枝杆菌标准菌株H37Rv来自中国国家疾控中心。
1.1.2 改良罗氏固体培养基和罗氏比例法药敏培养基均购自珠海贝索生物技术有限公司。
1.1.3 芯片的制作及检测设备结核分枝杆菌耐药基因检测试剂盒、晶芯Biomixer芯片杂交仪、晶芯Slide WasherTM芯片洗干仪、晶芯Lux Scan 10K-B微阵列芯片扫描仪和Extractor 36核酸快速提取仪均由博奥生物有限公司生产。Bio-rad CFX96 PCR荧光扩增仪由美国伯乐公司生产。
1.2 实验方法
取出保存于本院菌株库中200株MTB临床分离株,将待检菌株转种至罗氏培养基,37℃培养2周进行复苏,以H37Rv为标准菌株。
采用罗氏比例法药敏试验,刮取多处复苏菌落,旋紧瓶盖,在涡旋振荡器上混旋0.5~1.0min,加入灭菌的PBS缓冲液,直至其浊度与标准麦氏管(Mac Farland NO.1)一致,即得到1mg/ml的菌液。菌悬液静置片刻,使其中的颗粒或菌块沉淀,用22 SWG标准接种环或微量吸管无菌操作逐步稀释至10-2mg/ml和10-4mg/ml。
用22SWG标准接种环分别沾取1环(即0.01m l)10-2mg/ml和10-4mg/ml的菌液,用划线法均匀接种于含药培养基和对照培养基斜面,应注意使菌液尽可能均匀分散于培养基斜面。最终接种菌量为10-4mg和10-6mg。
接种后的培养基置37℃培养,4周后观察结果。RFP耐药界定浓度为40μg/L,INH耐药界定浓度为0.2μg/L。
1.3 基因芯片药敏(DNA微阵芯片法)
用无菌接种环挑取一个肉眼可见复苏菌落,置于含有核酸提取液的核酸提取管中。使用Extractor 36核酸快速提取仪振荡5min,95℃水浴5min,5 000 r/min离心1min。
配置PCR反应体系至于Bio-rad CFX96 PCR荧光扩增仪,按下列热循环程序扩增。见附表。
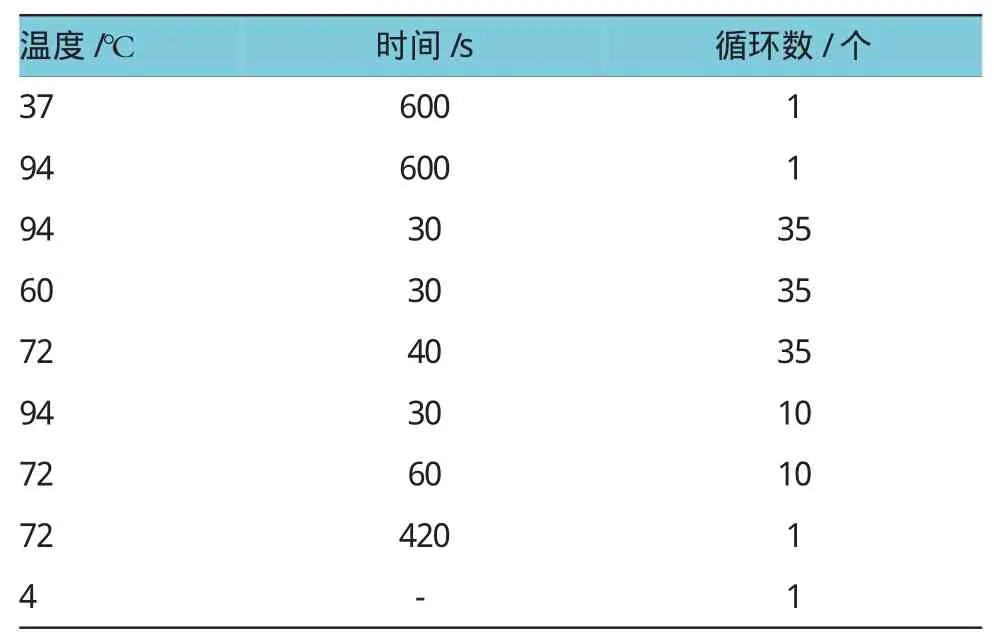
附表 PCR热循环程序
取杂交缓冲液9μl,PCR产物各3μl混匀,95℃热浴5min,使PCR产物变性,随后立即置于冰水混合物中骤冷3min。取13.5μl杂交溶液经加样孔加入芯片点阵,置杂交仪,50℃杂交2 h后置洗干仪中进行洗涤甩干。
将完成洗涤、甩干的芯片插入扫描仪插槽内,进行芯片扫描和结果判读,完成判读的芯片需室温避光保存,并详细记录判读结果和芯片信息。
1.4 统计学方法
采用SPSS 13.0统计软件进行数据分析,以罗氏比例法药敏结果作为金标准[3],计算基因芯片法检测RFP和INH耐药性的敏感性及特异性,并比较2种方法的符合率。应用χ2检验比较2种方法的差异性,P>0.05为差异无统计学意义。应用Kappa检验对2种检测方法进行一致性分析,0.75≤Kappa≤1提示高度一致,0.4≤Kappa<0.75提示中度一致,Kappa<0.4提示低度一致。
2 结果
2.1 罗氏比例法药敏试验结果
以罗氏比例法药敏试验的结果为金标准,基因芯片法检测RFP耐药的敏感性为85.0%(17/20),特异性为98.9%(178/180),符合率为97.5%(195/200)。基因芯片法检测INH耐药的敏感性为82.8%(24/29),特异性为92.4%(158/171),符合率为91.0%(182/200)。总符合率为94.3%(377/400)。经χ2检验,PRFP=0.866,PINH=0.281,提示这2种方法检验RFP和INH药敏结果差异无统计学意义。经Mcnemar检验,P=1.000,提示2种方法检验RFP药敏结果一致;经Mcnemar检验,P=0.096,提示2种方法检验INH药敏结果一致。
RFP和INH药敏结果一致性检验,Kappa= 0.858,提示2种方法检验RFP药敏结果高度一致;INH药敏结果一致性检验,Kappa=0.710,提示2种方法检验INH药敏结果中度一致。
2.2 基因芯片法检测结果
应用基因芯片法检测200株MTB临床分离株RFP耐药基因rpoB的6个位点、13种突变型,INH耐药基因katG的1个位点、2个突变型和INHinhA基因启动子-15位、1个C→T突变型。结果集中在6个突变型。具体表现在:rpoB基因突变位点531(C->T)占52.6%(10/19),rpoB基因突变位点526(C->T)占31.6%(6/19),rpoB基因突变位点526(C->G)占15.8%(3/19)。katG基因突变位点315(G->C)占80.0%(16/20),katG基因突变位点315(G->A)占20.0%(4/20),inhA基因突变位点-15(C->T)占100.0%(17/17)。
基因芯片法检测结果,敏感株152株、耐药株48株,单耐INH结核菌株占15.0%(30/200),单耐RFP 5.5%(11/200),耐多药结核菌株占3.5%(7/200)。罗氏比例法检测:敏感株161株、耐药株39株,单耐INH结核菌株占9.5%(19/200),单耐RFP 3.5%(7/200),耐多药结核菌株占5.0%(10/200)。
3 讨论
近年来,关于结核分枝杆菌耐药的分子机制已有一定的进展[4-5],研究发现结核分枝杆菌耐药性的产生与rpoB、katG、inhA、ahpC、ndh、rpsL、rrs、embCAB、PncA等基因突变有关。大量的研究证实[6],RFP耐药性的发生是由结核分枝杆菌编码RNA聚合酶β亚基的rpoB基因突变所致。PANG等[7]研究发现,INH耐药突变主要集中在katG基因和inhA的启动子区域。本课题所选研究样本来自青岛市胸科医院2013年1月-2014年12月门诊和住院患者,从其痰液和肺泡灌洗液中分离培养出结核菌株,同时检测每株菌株的rpoB、katG、inhA基因是否存在突变。对RFP的rpoB突变基因进行检测,结果显示基因芯片检测和罗氏比例法药敏试验检测RFP耐药性有高度一致性。本研究以罗氏比例法药敏试验为金标准,基因芯片法检测RFP耐药的敏感性为85.0%,与文献报道[8]相近。对INH的katG、inhA突变基因进行检测,结果显示2种方法检测INH耐药性结果中度一致,与文献报道结果相近[8]。以罗氏比例法药敏试验为金标准,通过基因芯片法检测INH耐药的敏感性为82.8%,略低于文献报道[7]。本研究中inhA-15(C->T)突变的菌株较多,但是23.5%的菌株药敏结果INH敏感,这也说明在结核分枝杆菌的分子耐药机制中inhA突变可能是引起INH耐药性的一个因素,但不一定是主要因素[9],也可能是由于存在本研究检测位点外的基因突变。陈杨等[10]报道,30例药敏试验耐RFP的结核分枝杆菌中有18株突变分离株,其中4株出现katG和inhA双基因联合突变。而本实验所分离出的200例菌株中未发现inhA和katG基因同时突变的菌株。这需要扩大样本进一步研究。
本研究显示,耐药基因检测结果与常规药敏试验结果并非完全一致,与王巍等[11]报道的相似,一些药敏试验提示耐药菌未检出耐药基因突变,少数敏感菌却检出了耐药基因突变,这体现出MTB菌株体外药敏试验的局限性,也表明结核分枝杆菌耐药机制具有多样性和复杂性,需要继续去探索和发现。
本研究中2号菌株315(G->A)位点突变,但罗氏药敏试验RFP和INH及其他一线药物均敏感,治疗3个月仍菌阳,空洞无缩小,再次痰菌培养RFP和INH仍敏感。调整治疗方案,3个月后痰菌阴转,空洞闭合。这也表明2种检测方法联合使用可及早制定出合理有效的治疗方案,以减少耐药菌在社会上的传播。
虽然传统的结核分枝杆菌药敏试验在目前的临床诊疗中尚不能被完全取代,基因芯片法仍需要进一步研究完善突变位点的检测以提高耐药基因检测率,但近年来的大量研究[7,12]显示,基因芯片技术检测结核杆菌耐药性具有很好的应用前景。本研究表明,基因芯片法检测RFP和INH耐药性结果与传统的药物敏感试验结果差异无统计学意义,结果一致性高,可缩短15 d,具有特异性高、符合率高等特点。采用改良罗氏培养方法成本较低,可减少患者的费用,再配合基因芯片法检测耐药基因,可早期预测结核菌的耐药情况。本课题是首次针对青岛市胸科医院(青岛市结核病定点收治医院)临床分离的结核菌株进行的研究,可用于指导本地区临床,及早制定出合理的抗结核方案,同时对周围地区的结核病防治也有指导意义。
[1]陈诚,李仁忠,陈明亭,等.全国结核病流行病学抽样调查及各省耐药监测中耐药结核病疫情资料分析[J].疾病监测,2013,28(4): 265-268.
[2]中华医学会.临床诊疗指南结核病分册[M].北京:人民卫生出版社,2006.
[3]World Health Orgnization.Guidelines for surveillance of drug resistance in tuberculosis.WHO/TB.1996.
[4]潘晞,何国钧.耐多药结核病的研究与进展.中华结核和呼吸杂志[J]. 2000,23(2):119-123.
[5]秦伟.结核分枝杆菌的耐药机制与治疗进展[J].中国医药指南, 2013,11:458-459.
[6]ZHANG Y,YEW W W.Mechanisms of drug resistance in mycobacterium tuberculosis[J].Int J Tuberc Lung Dis,2009,13(11): 1320-1330.
[7]PANG Y,XIA H,ZHANG Z,et al.Multicenter evaluation of genechip for detection of multidrug-resistant Mycobacterium tuberculosis[J].J Clin Microbiol,2013,51(6):1707-1713.
[8]刘厚明,陈建波,肖颜玉,等.利福平和异烟肼结核分枝杆菌药敏表型和基因型的关系[J].中国防痨杂志,2013,35(8):573-577.
[9]崔振玲,景奉香,胡忠义,等.基因芯片检测结核分枝杆菌利福平和异烟肼耐药性研究[J].中华结核和呼吸杂志,2004,27(7):439-441.
[10]陈杨,陈玲,张泓,等.耐异烟肼结核分枝杆菌及其katG与inhA基因突变的研究[J].中国抗生素杂志,2010,35(10):788-792.
[11]王巍,李洪敏,吴雪琼,等.结核分支杆菌五种耐药基因检测的临床应用及评价[J].中华结核和呼吸杂志,2002,25(11):670-673.
[12]SHI XC,LIU XQ,XIE X L,et al.Gene chip array for differentiation of mycobacterial species and detection of drug resistance[J].Chin Med J(Engl),2012,125(18):3292-3297.
(张西倩编辑)
Com parison of twomethods detect of M ycobacterium tuberculosis clinical isolates resistance to rifam pin and isoniazid*
Tong-xia Li1,Guo-feng Jiang2,Wen-jia Hao1,Jia-wei Cao2,Hai-tao Su1, Qian Xiao3,Bing-ruiWang4
(1.Department of tuberculosismedicine,2.Department of Laboratory,Qingdao Chest Hospital, Qingdao,Shandong 266043,China;3.Qingdao Ninth People's Hospital,Qingdao,Shandong 266000,China;4.Clinical Laboratory,ShandongWudi County Shejia Central Hospital,Wudi,Shandong 251900,China)
ObjectiveTo evaluate the use of gene chip,Lowenstein-Jensen(L-J)culturemethod and proportion method in detecting Mycobacterium tuberculosis(MTB)resistantof rifampinc(RFP)and isoniazid(INH).MethodsA total of 200 MTB clinical isolates were chosed,6 sites of resistant gene rpoB and 13 kinds ofmutant of RFP were detected,and 1 site of resistantgene katG,2 kinds ofmutant and inhA gene promoter-15,1 kind of C→Tmutantof INH were detected.Meanwhile drug susceptibility of the 200 MTB clinical isolateswith rapid culture and proportion method were detected.Then the sensitivity,specificity and accuracy were compared.ResultsA number of 152 sensitive isolates and 48 resistant isolates were detected by gene chip,and 161 sensitive isolates and 39 resistant were isolated by proportion method.If the result of proportion method was set as criteria,the sensitivity,specificity and accuracy of gene chip test RFP drug were 85%,98.9%and 97.5%,for INH they were 82.8%,92.4%,91%.ConclusionsGene chip method can be used to preliminarily screen the drug-resisitant strains of Mycobacterium tuberculosis.Joint detection with proportionmethod can improve the diagnostic rate.
mycobacterium tuberculosis;drug susceptibility;gene chip;proportionmethod;isoniazid;rifampin
R 446.5;R 52
A
10.3969/j.issn.1005-8982.2016.24.005
1005-8982(2016)24-0024-04
2016-02-19
青岛市科技局公共领域科技支撑计划课题(No:13-1-3-65-nsh)
江国峰,E-mail:qdxkyy@126.com;Tel:15653267267
