人TIMP-2基因的克隆及其原核表达
2017-01-10徐国强王伟孙达权黄小琼陈腾祥
徐国强 王伟 孙达权 黄小琼 陈腾祥
(1. 贵州医科大学生理学教研室; 2. 贵州医科大学生物化学与分子生物学教研室,贵州 贵阳 550004)
人TIMP-2基因的克隆及其原核表达
徐国强1王伟1孙达权2黄小琼1陈腾祥1
(1. 贵州医科大学生理学教研室; 2. 贵州医科大学生物化学与分子生物学教研室,贵州 贵阳 550004)
目的 构建人TIMP-2重组表达载体,并在大肠杆菌 BL21 (DE3) 中表达。方法 提取人肝癌细胞 (Hep G2)总RNA后, 经RT-PCR扩增获得目的片段,插入克隆载体pMD18-T;酶切鉴定和测序后将TIMP-2导入原核表达载体pGEX-4T-1中,构建重组质粒pGEX-TIMP-2。将重组质粒转化至大肠杆菌菌株BL21 (DE3)中,IPTG诱导融合蛋白表达后用SDS-PAGE电泳检测并用western blot验证(蛋白质印迹法)。结果 成功构建原核重组表达载体 pGEX-TIMP-2,并在原核宿主BL21中大量表达融合蛋白GST-TIMP-2。结论 克隆人TIMP-2基因并在原核生物中大量表达。
基质金属蛋白酶抑制因子2; pGEX-4T-1; 原核表达; 肝癌
基质金属蛋白酶抑制因子(TIMPs)是基质金属蛋白酶(MMPs)的天然抑制剂[1]。两者形成非共价复合物从而抑制MMPS的活性,减少细胞外基质的破坏,保持细胞间连接的完整性,降低肿瘤的转移,改善预后[2]。细胞外基质(ECM)由基底膜和间质基质构成,基底膜是ECM的关键结构,它不仅为ECM提供物理支撑,同时还为细胞提供代谢支持[3]。ECM是肿瘤重要的微环境之一,能够影响肿瘤细胞的生物学行为,包括调节细胞间的黏附以及肿瘤的发展和转移[4]。Ⅳ型胶原是基底膜的主要组成成分,主要位于上皮和内皮细胞的基底层[5],MMP-2是Ⅳ型胶原酶,能降解Ⅳ型胶原从而破坏ECM形成癌细胞侵袭和转移的通道[6]。相比较TIMPs其他家族成员而言,TIMP-2在大多数正常成人组织间隙有大量表达,能特异性抑制MMP-2的活性从而减少ECM的降解,降低癌细胞的迁移能力[5,7]。
越来越多的临床病理证据表明,肿瘤组织中TIMP-2的表达水平较低,这可能与肿瘤的侵袭性增加有关;相反,TIMP-2表达水平的增加,能抑制肿瘤的生长以及增强化疗药物的敏感性[7]。如在侵袭性胃癌以及肾透明细胞癌组织、食管癌、胃癌、非小细胞肺癌患者的血清中TIMP-2表达水平均较低[8-9];肿瘤抑癌基因E-cadherin表达上调与TIMP-2的过度表达有关,有助于维持细胞间的黏附及抑制肿瘤的生长[1]。因此有研究表明TIMP-2与肿瘤的发展有极大关系。本研究拟构建TIMP-2的原核表达载体pGEX-TIMP-2并进行诱导表达,为后期获取TIMP-2融合蛋白及探讨肝细胞癌微环境与肝细胞癌发生发展的关系提供前期支持。
1 资料与方法
1.1 材料
1.1.1 试剂 高保真酶 Pyrobest DNA Polymerase;兔抗人多克隆抗体TIMP-2,购于Bioworld公司;限制性内切酶EcoR I、Xho I、T4 DNA Ligase、1kb DNA Ladder 和200bp DNA Ladder购自TaKaRa公司;Trizol、质粒小提试剂盒、DNA回收试剂盒购自天根生物公司;琼脂糖购自Sigma公司;SDS PAGE制胶试剂盒购自索莱宝生物公司;冰醋酸、浓盐酸、异丙醇、氯仿等为分析纯AR级;反转录试剂盒购自TaKaRa公司;引物合成及测序由北京Biomed公司完成。
1.1.2 菌株、质粒和培养基 用于分子克隆的宿主E. coli DH5α由本实验室保存,用于表达的宿主 E. coli BL21(DE3)购自天根生物公司。克隆载体pMD18-T vector和原核表达载体pGEX-4T-1本实验室保存。YT液体培养基(细菌培养用胰蛋白胨16 g/L,细菌培养用酵母提取物 10 g/L,氯化钠5 g/L);LB液体培养基(细菌培养用胰蛋白胨10 g/L,细菌培养用酵母浸粉 5 g/L,氯化钠10 g/L, 固体培养基添加琼脂粉15 g/L)用于大肠杆菌的培养。
1.2 方法
1.2.1 目的基因的获取 根据GenBank中人TIMP-2的基因序列(NM_003255)和pGEX-4T-1原核表达载体的多克隆位点设计合成一对引物。上游引物5’端加入EcoR I酶切位点,下游引物5’端加入Xho I酶切位点。引物序列见表1。

表1 TIMP-2上下游PCR引物
1.2.2 RT-PCR获取目的片段与T载体的构建 提取人肝癌细胞(Hep G2)总RNA,经反转录的方法合成人源性cDNA第一链,以cDNA第一链为模板,以表1中核苷酸片段为引物,PCR扩增TIMP-2目的基因片段。琼脂糖凝胶电泳鉴定后,割胶回收目的片段,与pMD18-T 4 ℃过夜连接,产物转化E. coli DH5α感受态细胞并接种于含氨苄青霉素(Amp 100 mg/mL)的LB平板,筛选出阳性菌落,LB液体培养基37 ℃振荡培养10 h,抽提质粒后酶切(EcoR I、Xoh I)分析,1%的琼脂糖凝胶电泳检测,并将该菌落送至北京Biomed公司进行测序,测序结果与GenBank中 (NM_003255) 人TIMP-2基因序列比对,并命名为pMD18-TIMP-2保存备用。
1.2.3 原核表达载体的构建 将测序正确的pMD18-TIMP-2质粒双酶切,割胶回收TIMP-2基因片段与同样双酶切的原核表达载体pGEX-4T-1用T4连接酶4 ℃连接过夜。连接产物转化E. coli DH5α感受态细胞,涂于含Amp的LB平板,37 ℃过夜培养后,挑取单菌落接种于含Amp的LB液体培养基,37 ℃培养10 h。抽提质粒后双酶切分析,1%的琼脂糖凝胶电泳检测,并对菌落进行序列测定,结果与GenBank数据(NM_003255) 人TIMP-2基因序列比对。将阳性克隆子命名为pGEX-TIMP-2。
1.2.4 GST-TIMP-2蛋白的诱导表达 将重组质粒pGEX-TIMP-2转化BL21(DE3)感受态细胞,涂于含Amp的LB平板,37 ℃培养过夜,筛选出阳性菌落,接种于LB液体培养基,37 ℃、200r/min振摇培养过夜。按1∶500的比例取上述菌液接种于20 mL YT培养基中,37 ℃、200r/min振摇培养至OD600值达到0.6时,加入终浓度为0.2 mmol/L 异丙基硫代-β-D-半乳糖苷(IPTG), 24 ℃ 220 rpm/min诱导表达3 h,并取未加IPTG诱导的菌液3 mL留作对照。分别取各组菌液2 mL离心12 000r/min,5 min,收集菌体,PBS缓冲液重悬后加入 5×SDS上样缓冲液加热变性,12%的SDS-PAGE检测融合蛋白。
1.2.5 Western Blot鉴定 取诱导及未诱导的菌液1 mL,离心后搜集菌体,分别向菌体沉淀中加入PBS、5×SDS上样缓冲液振荡混匀,加热变性后12%的SDS-PAGE凝胶电泳,将蛋白转至PVDF膜上,经Westrn blotting封闭液封闭后依次加入兔多克隆一抗、羊抗兔二抗,最后用ECL-Plus化学发光试剂显色,于化学发光凝胶成像系统采集图像保存。
2 结 果
2.1 人TIMP-2基因的获取及重组载体pMD18-TIMP-2的构建与鉴定 (1)目的基因的获取:提取人肝癌细胞(Hep G2)总RNA,经PCR扩增获取TIMP-2基因片段,产物用1%的琼脂糖凝胶电泳检测,在约663 bp处有明显条带(图1),与预期的TIMP-2基因片段大小一致。(2)T载体的构建:将pMD18-TIMP-2载体阳性菌落,质粒抽提后用EcoR I、Xoh I进行双酶切,1%的琼脂糖凝胶电泳,鉴定为阳性克隆(图2)。(3)测序鉴定:将琼脂糖凝胶电泳鉴定正确的阳性菌落扩大培养12 h后,取1 mL送北京Biomed公司进行测序,经测序表明pMD18-TIMP-2中TIMP2的碱基序列与GenBank公布的(NM_003255)人TIMP-2基因序列一致,即TIMP-2基因成功克隆到pMD18-T载体。
2.2 人TIMP-2重组表达质粒pGEX-TIMP-2的构建 (1)人TIMP-2重组表达质粒的酶切鉴定:原核表达载体pGEX-TIMP-2的质粒酶切结果见图3,结果中有两条带,在约4900 bp处的表达载体及663 bp处的目的蛋白,由此可初步鉴定人TIMP-2重组表达载体构建成功。(2)测序鉴定:将初步鉴定的阳性菌落扩大培养后,菌液送至北京Biomed公司进行测序鉴定,原核表达载体pGEX-TIMP-2中TIMP-2的基因序列与GenBank公布的(NM_003255)人TIMP-2基因序列一致,表明原核表达载体pGEX-TIMP-2构建成功。
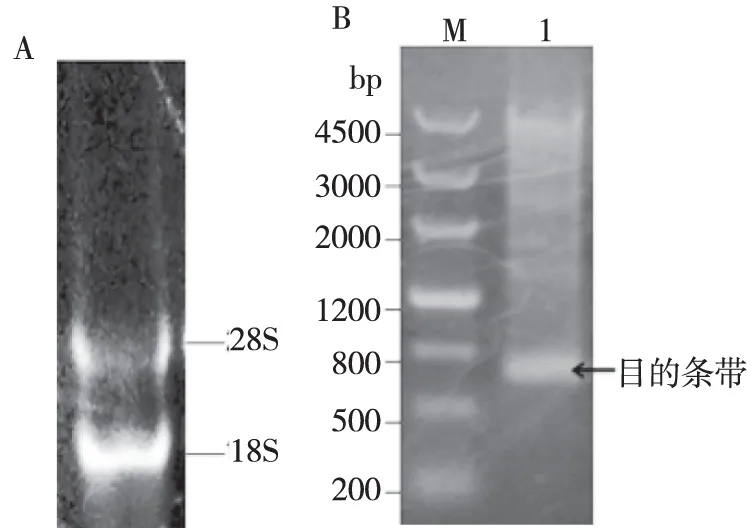
注:A为琼脂糖凝胶电泳检测人总RNA;B为TIMP-2基因的PCR产物,M:200 bp ladder marker;1:人TIMP-2基因cDNA片段。图1 RT-PCR扩增人TIMP-2 cDNA
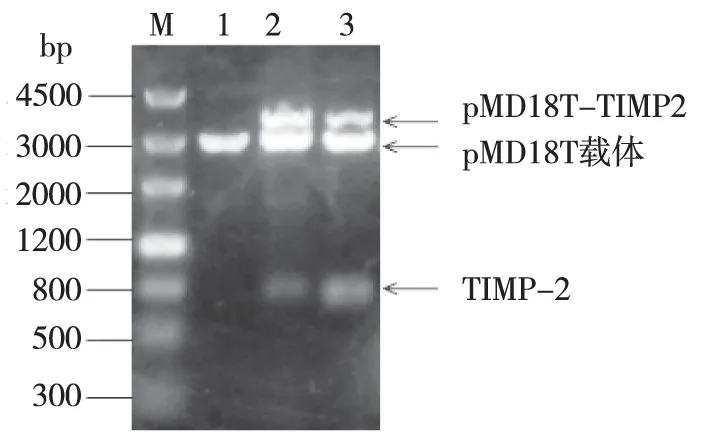
注:M:200 bp ladder marker; 1:pMD18T空载体; 2和3:pMD18T-TIMP-2用EcoR I、Xho I双酶切产物。图2 琼脂糖凝胶电泳鉴定重组质粒pMD18T-TIMP-2
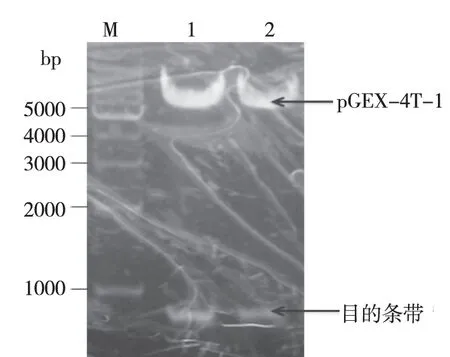
注;M:1000 bp ladder marker;1和2:pGEX-TIMP-2用EcoR I、Xho I进行双酶切产物。图3 琼脂糖凝胶电泳鉴定重组原核表达质粒
2.3 融合蛋白TIMP-2的诱导表达与鉴定 (1)诱导表达:将诱导表达的pGEX-TIMP-2菌体沉淀经12%的SDS-PAGE鉴定,pGEX-TIMP-2菌液样品在约48 kD处出现明显的目的蛋白条带,而未加IPTG诱导的菌体样品在48 kD处无明显条带。结果表明TIMP-2蛋白被成功诱导表达,结果见图4。(2)Western Blot鉴定GST-TIMP-2融合蛋白:一抗为TIMP-2多克隆抗体,二抗为羊抗兔IgG,进行Western Blotting免疫印迹分析,化学发光显色后结果见图5,GST-TIMP-2融合蛋白与兔多克隆抗体呈阳性反应,在约48 kD处有特异性蛋白反应条带。
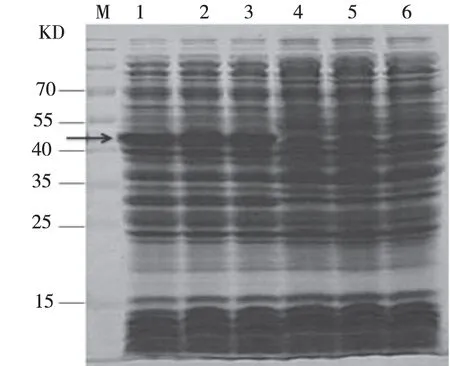
注:M:预染marker; 1、2、3均为在IPTG为0.2 mm/L时pGEX-TIMP-2菌株的表达产物;4、5、6均为未加IPTG诱导的pGEX-TIMP-2菌株。图4 考马斯亮蓝R-250检测融合蛋白TIMP-2

图5 Western Blot鉴定GST-TIMP-2蛋白
3 讨 论
不同的TIMPs对MMPs的亲和力不同且每一种TIMPs都可以与几种MMPs以非共价键形式生成1∶1的复合物,保持着相对的平衡状态,对组织的修复、重塑、胚胎的插入、肿瘤细胞的浸润及转移中有重要的意义[10]。 MMPs可通过调节ECM的合成与分解,使胶原的合成与降解处于平衡状态,当平衡遭到破坏,将导致ECM修复与重塑异常[11]。ECM的堆积容易造成组织纤维化,有研究[12-13]显示在肝脏TIMP-2 能抑制 MMP2的活性,阻止ECM的降解,促进肝纤维化的发生,随着肝纤维化的发展,MMPs的表达下降而TIMP-1和TIMP-2的表达升高,致使MMPs/TIMPs值降低,胶原降解减少,结果使总体ECM总量较正常肝脏增加3~8倍从而加剧了肝纤维化。肝动脉化疗栓塞术(TACE)是目前肝癌治疗中除手术切除外最常用的治疗方法。有研究[14]显示在肝动脉化疗栓塞术术后,血清中MMP-2高表达水平和MMP-2 / TIMP-2的比值,能预测预后较差的TACE,由此表明MMP-2以及MMP-2/TIMP-2水平对肝癌预后有重要意义。
本研究通过提取肝癌细胞(Hep G2)总RNA,设计TIMP-2引物,扩增含CDS的共663 bp的基因片段,将该片段进行T-A克隆,经测序表明pMD18-TIMP-2中TIMP-2的基因序列与GenBank公布的(NM_003255)人TIMP-2基因序列一致。将测序正确的TIMP-2成功构建原核表达载体pGEX-TIMP-2,测序结果与上述一致。实验中发现,pGEX-TIMP-2在IPTG浓度为0.2 mmol/L 24 ℃ 220 rpm/min诱导表达3 h,结果发现带有GST标签的目的蛋白在48 kD处得到大量表达。此外,由于表达载体上带有GST标签,有利于后期目的蛋白的纯化。本研究中pGEX-TIMP-2原核表达载体的成功构建对后期系统性的研究TIMP-2基因和蛋白功能奠定基础,并为后期探讨TIMP-2对肝癌发生、发展的研究提供数据支持。
[1] Dimitra Bourboulia,HuiYing Han,Stetler-Stevenson,et al. TIMP-2 modulates cancer cell transcriptional profile and enhances E-cadherin/beta-catenin complex expression in A549 lung cancer cells[J]. Oncotarget,2013,4(1):163-173.
[2] Lin Zhu,Hong Yu,Shi-Yuan Liu,et al. Prognostic value of tissue inhibitor of metalloproteinase-2 expression in patients with non-small cell lung cancer:a systematic review and meta analysis[J]. Plos one,2015,10(4):e0124230.
[3] Remillard T C,Bratslavsky G,Stetler-Stevenson W G,et al. Molecular mechanisms of tissue inhibitor of metalloproteinase 2 in the tumor microenvironment[J]. Molecular and Cellular Therapies,2014,2(1):17.
[4] Kumar A,El-Osta A,Hussain AA,et al. Increased sequestration of matrix metalloproteinases in ageing human Bruch’s membrane:Implications for ECM turnover[J]. Investig Ophthalmol Vis Sci,2010,51(5):2664-2670.
[5] Breitkreutz D,Koxholt I,Thiemann K,et al. Skin basement membrane: the foundation of epidermal integrity-BM functions and diverse roles of bridging molecules nidogen and perlecan[M]. Biomed Res Int, 2013:179784.
[6] Page-Mccaw A,Ewald AJ,Werb Z. Matrix metalloproteinases and the regulation of tissue remodeling[J]. Nat Rev Mol Cell Bio,2007,8(3):221-233.
[7] William G,Stetler-Stenenson,Noah Veis Gavil.Normalization of the tumor microenvironment:evidence for tissue inhibitor of metalloproteinase-2 as a cancer therapeutic[J].Connect Tissue Res,2014,55(1):13-19.
[8] Lu H,Yang Z,Zhang H,et al.The expression and clinical significance of matrix metalloproteinase 7 and tissue inhibitor of matrix metalloproteinases 2 in clear cell renal cell carcinoma[J].Exp Ther Med,2013,5(5):890-896.
[9] Groblewska M,Mroczko B,Kozlowski M,et al.Serum matrix metalloproteinase 2 and tissue inhibitor of matrix metalloproteinases 2 in esophageal cancer patients[J].Folia Histochem Cytobiol,2012,50(4):590-598.
[10] 石磊.西红花酸体内外抗氧化作用的研究[J].中国医药指南,2012,10(15):118-120.
[11] Cox TR,Erler JT.Remodeling and homeostasis of the extracellular matrix:implications for fibrotic diseases and cancer[J].Dis Model Mech,2011,4(2):165-178.
[12] 廖明,李彦,舒伟.Genistein 对大鼠肝星状细胞的增殖及TGF-β1、MMP-2和TIMP-2表达的影响[J].世界华人消化杂志,2010,18(3):229-233.
[13] 张斌.肝纤维化的发病机理研究进展[J].现代诊断与治疗,2004,15(6):354-359.
[14] Daniele A,Divella R,Quaranta M,et al.Clinical and prognostic role of circulating MMP-2 and its inhibitor TIMP-2 in HCC patients prior to and after trans-hepatic arterial chemo-emb olization[J].Clinical Biochemistry,2014,47(3):184-190.
Gene clone and expression of human tissue inhibitor of matrix metalloproteinases2 in Escherichia coli
XuGuoqiang1,WangWei1,SunDaquan2,HuangXiaoqiong1,ChenTengxiang1.
1.DepartmentofPhysiology,GuizhouMedicalUniversity,Guiyang550004,China. 2.DepartmentofBiochemicalandMolecularBiology,GuizhouMedicalUniversity,Guiyang550004,China.
Objective To construct the recombinant prokaryotic vector of human TIMP-2 (Tissue inhibitor of matrix metalloproteinases 2, TIMP-2), and then express it in E. coli BL21 (DE3). Methods Total RNA was extracted from human hepatoma cell line (Hep G2), and the TIMP-2 cDNA was obtained with RT-PCR. Then, the amplified TIMP-2 coding region by PCR technology was cloned into pMD18-T. After identification and sequence, the TIMP-2 DNA fragment was inserted into the prokaryotic expression vector of pGEX-4T-1, and the recombinant was transformed into E. coli BL21 (DE3) for expression. After induced by IPTG, the recombinant GST-TIMP-2 had been expressed and its molecular weight was approximately 48kD and identified by western blot. Results TIMP-2 gene coding region was cloned from Hep G2 cell and the recombinant plasmid of pGEX-TIMP-2 was successfully constructed and expressed fusion protein GST-TIMP-2 in BL21 induced by IPTG. Conclusion The pGEX-TIMP-2 recombinant vector was successfully constructed.
TIMP-2; pGEX-4T-1; Prokaryotic expression; Hepatocellular carcinoma
贵州省科学技术基金[黔科合LG字(2012)007];贵州省科学技术基金[黔科合J字(2014)2025]
R329.2+5
A
1002-6975(2016)04-0344-04
2015-09-25)
