谷氨酰胺对小细胞肺癌H446细胞增殖和生存的影响
2017-01-09徐鹏育李家印苗亚静高翠翠沈尧靳芳仇晓菲
徐鹏育,李家印,苗亚静,高翠翠,沈尧,靳芳,仇晓菲
谷氨酰胺对小细胞肺癌H446细胞增殖和生存的影响
徐鹏育,李家印,苗亚静,高翠翠,沈尧,靳芳,仇晓菲△
目的 观察谷氨酰胺(Gln)对小细胞肺癌H446细胞增殖和生存的影响,并探究其机制。方法应用CCK-8试剂盒检测Gln(+)组和Gln(-)组H446细胞在0、24、48、72、96 h的增殖情况,筛选出最佳时间,采用Annexin V-FITC/PI双染法、CellTiter-Glo®发光法和流式细胞仪分别检测这2组细胞的存活比例、三磷酸腺苷(ATP)和活性氧(ROS)水平;以Gln(-)组为对照组,实验组中加入草酰乙酸(OAA)或α-酮戊二酸二甲酯(DM-αKG),检测各组H446细胞的ATP水平、增殖和存活情况;以Gln(-)组为对照组,实验组中加入ROS清除剂N-乙酰-L-半胱氨酸(NAC),检测2组细胞的ROS水平、增殖、克隆和存活情况;在Gln(+)条件下,用0、2、5、10 μmol/L谷氨酰胺酶抑制剂BPTES处理H446细胞,通过克隆实验筛选最佳作用浓度,在此浓度下检测Gln(+)组和Gln(+)+BPTES组细胞的ATP、ROS水平和增殖水平。最后,单独应用BPTES或ROS诱导剂过氧化氢(H2O2)和二者联合应用情况下检测细胞的存活比例。结果相比Gln(+)组,Gln(-)组H446细胞的增殖水平在24、48、72、96 h均降低(P<0.05),72 h降低最明显,取72 h为最佳时间;Gln(-)组细胞的存活比例和ATP水平低于Gln(+)组(P<0.05),ROS水平高于Gln(+)组;相比Gln(-)组,Gln(-)+OAA组和Gln(-)+DM-αKG组H446细胞的ATP和增殖未升高,而存活比例升高(P<0.05);相比Gln(-)组,Gln(-)+NAC组ROS水平降低,增殖、克隆水平和存活比例均升高(均P<0.05)。克隆实验结果显示10 μmol/L BPTES为最佳浓度;相比Gln(+)组,Gln(+)+BPTES组细胞的ATP和增殖降低(均P<0.05),ROS水平升高;相比单独应用,BPTES+H2O2组H446细胞存活比例明显降低。结论Gln缺乏可通过提高ROS水平抑制H446细胞的增殖和生存;BPTES和H2O2对H446细胞有联合杀伤作用。
谷氨酰胺;肺肿瘤;癌,小细胞;腺苷三磷酸;活性氧;细胞增殖;细胞存活
小细胞肺癌是肺癌中最具侵袭性的一种类型,占肺癌患者的10%~15%[1],自1970年起小细胞肺癌的5年生存率一直维持在5%上下[2]。与正常细胞的代谢方式不同,大部分肿瘤细胞主要依赖有氧糖酵解产生所需的能量,这种现象被称为“沃伯格效应”[3]。此外,有些癌细胞系如人骨髓瘤细胞对谷氨酰胺(Gln)也有较高的依赖性[4]。在非小细胞肺癌中,Gln通过各种途径影响细胞的增殖、存活和药物敏感性,但在小细胞肺癌中的作用及机制尚不清楚。本研究主要从能量生成和活性氧(ROS)两方面探讨Gln影响H446细胞的增殖和生存的机制,并用谷氨酰胺酶抑制剂BPTES[5]和ROS生成剂H2O2[6]处理H446细胞,观察细胞增殖和存活情况,为小细胞肺癌的靶向治疗提供依据。
1 材料与方法
1.1 材料
1.1.1 细胞人小细胞肺癌细胞系H446购自美国菌种保藏中心(ATCC)。
1.1.2 试剂和仪器RPMI-1640培养基、胎牛血清和胰酶购自Biological Industries公司;L-谷氨酰胺(L-Gln)、无Gln的RPMI-1640培养基购自美国Life technologies公司旗下Gibco®;N-乙酰-L-半胱氨酸(NAC)购自阿拉丁公司;α-酮戊二酸二甲酯(DM-αKG)购自美国Sigma公司;CCK-8试剂盒购自东仁化学科技有限公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自南京凯基生物科技有限公司;CO2培养箱购自Thermo Forma公司;倒置显微镜购自Nikon ECLIPSE公司;恒温孵育箱购自上海精宏实验设备有限公司;低温高速离心机购自德国Eppendorf公司。
1.2 方法
1.2.1 细胞培养H446细胞用RPMI-1640培养基培养,内含10%胎牛血清,青霉素100 U/mL、链霉素100 mg/L,置于37℃,5%CO2孵育箱培养。
1.2.2 细胞增殖实验根据CCK-8试剂盒操作步骤,取对数生长期H446细胞,以3×104个/mL接种于96孔板,边缘用无菌PBS溶液填充,常规培养24 h后,将细胞分为2组,分别加入含Gln(Gln+)和不含Gln(Gln-)培养基,于0、24、48、72、96 h向每孔中加入10 μL CCK-8溶液,37℃孵育1.5 h,在酶标仪450 nm波长下检测光密度(OD)值,筛选出最佳时间。以Gln(-)组为对照组,在Gln(-)条件下,实验组中分别加入草酰乙酸(OAA)、DM-αKG(其作用是为细胞提供αKG)或ROS清除剂NAC[7-8],48 h后按CCK-8试剂盒操作步骤,用酶标仪检测OD值。以Gln(+)组为对照组,在Gln(+)条件下,实验组加入谷氨酰胺酶(GLS)抑制剂BPTES,48 h后同上方法用酶标仪检测OD值。
1.2.3 三磷酸腺苷(ATP)检测取对数生长期H446细胞,以1×105个/mL接种于6孔板中,常规培养24 h,细胞设Gln(-)、Gln(+)、Gln(-)+OAA、Gln(-)+DM-αKG、Gln(+)+ BPTES。根据1.2.2选取的最佳时间,按照CellTiter-Glo®试剂盒操作步骤,每组分别计数,调整细胞悬液密度为1×105个/mL,以每孔100 μL均匀接种于不透明96孔酶标板,背景孔只含有100 μL培养基,室温平衡30 min后,向每孔中加入100µL CellTiter-Glo®试剂,振荡混匀,室温孵育10 min,使荧光信号稳定,记录发光信号。
1.2.4 ROS检测取对数生长期H446细胞,以4×104个/mL接种于12孔板中,常规培养24 h,细胞设Gln(-)、Gln(+)、Gln(-)+NAC、Gln(+)+BPTES。在1.2.2选取的最佳时间,按照1∶1 000比例用无血清培养基稀释荧光素,使终浓度为10 μmol/L,每孔加入1 mL稀释好的荧光素,阴性对照孔加入1 mL不含探针的无血清培养基。37℃培养箱孵育30 min,每隔5 min混匀1次,使探针与细胞充分作用,用PBS洗涤3次,将细胞重悬至EP管中离心,用200 μL PBS溶液重悬细胞,用流式细胞仪检测ROS水平。
1.2.5 细胞凋亡实验取对数生长期H446细胞,以8×104个/mL接种于12孔板,常规培养24 h,实验分组同1.2.2,培养相应时间后收集细胞至离心管中,PBS洗涤2遍,1 000 r/min离心5 min,弃上清,加入500 μL的结合缓冲液重悬细胞,再加入5 μL异硫氰酸荧光素(Annexin V-FITC)和5 μL碘化丙啶(PI),混匀,室温避光反应15 min,1 h内用流式细胞仪检测细胞凋亡情况,计算存活比例;再以Gln(+)组为对照组,实验组分别为BPTES组、H2O2组和BPTES+H2O2组,48 h后检测细胞凋亡情况,计算其存活比例。
1.2.6 平板克隆形成实验取对数生长期H446细胞,以1× 104个/mL接种于12孔板中,常规培养24 h后,加浓度梯度0、2、5、10 μmol/L的BPTES于培养基中,第7天,终止培养,用80%甲醇固定细胞,0.4%结晶紫进行染色,在倒置显微镜下计数5个视野中至少包含50个细胞的克隆数,取其平均值,筛选出BPTES的最佳作用浓度。以Gln(-)组为对照组,实验组中加入NAC,第7天,同上计数克隆数量。
1.3 统计学方法采用SPSS 13.0统计学软件进行分析,符合正态分布的计量资料以均数±标准差表示,2组间均数比较采用独立样本t检验,多组间均数比较用单因素方差分析,多重比较用LSD-t法,所有实验独立重复至少3次,以P<0.05为差异有统计学意义。
2 结果
2.1 谷氨酰胺对H446细胞增殖和生存的影响相对于Gln(+)组,在24、48、72、96 h,Gln(-)组H446细胞的增殖能力均下降(P<0.05),其中,在72 h Gln(-)组细胞的增殖水平下降59.1%,最为显著。因此,取72 h为最佳时间。在72 h,相对于Gln(+)组,Gln(-)组细胞的存活比例下降17%(P<0.05),见表1、2,图1。
2.2 OAA和α-KG对H446细胞ATP水平、增殖和存活的影响在谷氨酰胺缺乏条件下细胞ATP水平下降16%(P<0.05),加入OAA或DM-αKG后,ATP和增殖水平没有得到恢复,加入OAA后存活比例升高约19%,加入DM-αKG后存活比例升高约13%(P<0.05),见图1,表2、3。
Tab.1 Comparison of the proliferation between two groups of cells表1 Gln(+)和Gln(-)组的细胞增殖能力的比较(n=6,OD450,)

Tab.1 Comparison of the proliferation between two groups of cells表1 Gln(+)和Gln(-)组的细胞增殖能力的比较(n=6,OD450,)
*P<0.05,**P<0.01
组别Gln(+)组Gln(-)组t 0 h 0.57±0.06 0.61±0.05 0.512 24 h 1.58±0.09 0.97±0.08 5.066**48 h 2.31±0.13 1.19±0.12 6.331**72 h 2.84±0.70 1.16±0.10 2.376*96 h 1.71±0.05 0.89±0.09 7.965**
Tab.2 Comparison of the survival and ATP level between two groups表2 Gln(+)和Gln(-)组的细胞存活能力和ATP水平的比较(n=5,)

Tab.2 Comparison of the survival and ATP level between two groups表2 Gln(+)和Gln(-)组的细胞存活能力和ATP水平的比较(n=5,)
**P<0.01
组别Gln(+)组Gln(-)组t存活比例(%)79.52±2.40 66.23±1.19 4.961**ATP(μmol/L)1.01±0.02 0.85±0.02 5.657**
2.3 NAC对H446细胞ROS水平、增殖、克隆和存活的影响谷氨酰胺缺乏条件下细胞中ROS水平升高,加入NAC后,ROS水平下降,细胞增殖水平升高25%(P<0.05),克隆数量有较明显的升高(P<0.05),存活比例升高10%(P<0.05),见图1~3,表4。

Fig.1 Effects of of OAA,α-KG or NAC on cell survival图1 OAA、α-KG或NAC对细胞存活的影响
Tab.3 Comparison of the proliferation,survival and ATP level between three groups表3 各组细胞增殖、存活能力和ATP水平的比较(n=5,)
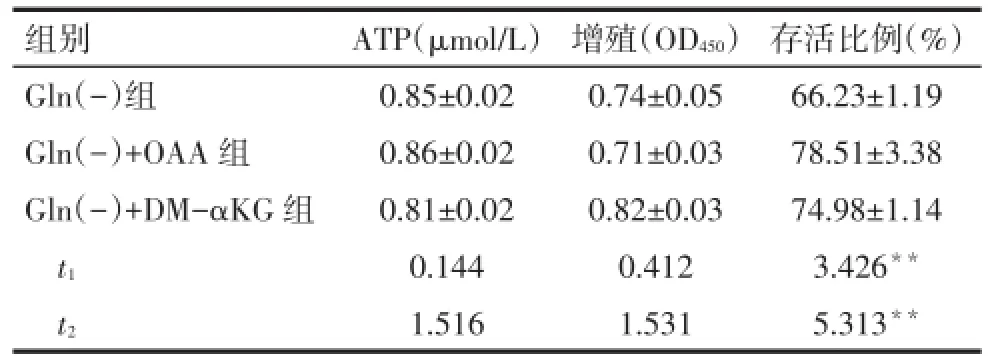
Tab.3 Comparison of the proliferation,survival and ATP level between three groups表3 各组细胞增殖、存活能力和ATP水平的比较(n=5,)
**P<0.01;t1、t2均与Gln(-)组比较
组别Gln(-)组Gln(-)+OAA组Gln(-)+DM-αKG组t1t2 ATP(μmol/L)0.85±0.02 0.86±0.02 0.81±0.02 0.144 1.516增殖(OD450)0.74±0.05 0.71±0.03 0.82±0.03 0.412 1.531存活比例(%)66.23±1.19 78.51±3.38 74.98±1.14 3.426**5.313**
2.4 不同浓度BPTES作用下H446细胞的克隆情况0、2、5、10 μmol/L BPTES作用下H446细胞克隆数量分别为26.88±1.87、25.50±1.67、19.75±2.02、17.88±1.69,差异有统计学意义(F=5.751,P<0.01)。在2 μmol/L BPTES时克隆水平无明显变化,5 μmol/L BPTES时开始出现下降,10 μmol/L BPTES时,明显下降。以10 μmol/L BPTES为最佳实验浓度。2.5BPTES对H446细胞的ATP、ROS水平和增殖水平的影响相对于Gln(+)组,Gln(+)+BPTES组细胞内ATP水平降低24%左右(P<0.05),ROS水平升高,细胞增殖水平降低约16%(P<0.05),见表5、图4。

Fig.2 The effect of NAC on the cellular ROS level in H446 cells图2 NAC对H446细胞内ROS水平的影响

Fig.3 The effect of NAC on cell colony(Crystal violet,×40)图3 NAC对细胞克隆水平的影响(结晶紫染色,×40)
Tab.4 Comparison of the proliferation,colony and survival between two groups表4 各组细胞增殖、克隆和存活能力的比较(n=5,)

Tab.4 Comparison of the proliferation,colony and survival between two groups表4 各组细胞增殖、克隆和存活能力的比较(n=5,)
*P<0.05,**P<0.01
组别Gln(-)组Gln(-)+NAC组t增殖(OD450)0.65±0.04 0.81±0.03 3.051*克隆(个)6.20±0.73 22.60±0.68 16.400**存活比例(%)67.63±0.64 74.43±0.58 7.882**
Tab.5 Comparison of cell proliferation and ATP level between two groups表5 2组细胞的ATP和增殖能力的比较(n=5)

Tab.5 Comparison of cell proliferation and ATP level between two groups表5 2组细胞的ATP和增殖能力的比较(n=5)
*P<0.05,**P<0.01
组别Gln(+)Gln(+)+BPTES t ATP(μmol/L)0.99±0.03 0.75±0.01 8.099**增殖(OD450)0.58±0.02 0.51±0.02 2.308*
2.6 单独应用BPTES或H2O2和联合应用情况下细胞的存活情况相对于对照组,单独应用BPTES或H2O2,细胞存活比例有所下降,联合应用时细胞存活比例有较明显的降低,见图5。

Fig.4 The effect of BPTES on the cellular ROS level图4 BPTES对细胞内ROS水平的影响

Fig.5 The survival ratio of H446 cells treated with BPTES, H2O2or the combination of them图5 单独应用BPTES或H2O2和联合应用情况下细胞的存活比例
3 讨论
Gln参与细胞生长的多个环节,例如能量生成、提供氮源、合成抗氧化物质维持氧化还原平衡状态等。有研究指出在非小细胞肺癌中,Gln促进谷胱甘肽的合成,影响细胞增殖和放疗敏感性[9],抑制Gln代谢可以增加细胞对某些药物如厄罗替尼[10]以及芹菜素[11]的敏感性,从而促进细胞凋亡。但Gln在小细胞肺癌中的作用目前尚不清楚。
本实验结果显示,Gln缺乏抑制H446细胞的增殖和生存。相对于Gln(+)组,Gln缺乏条件下细胞中ATP水平降低。有研究表明,在Ras突变导致的癌细胞中,Gln参与三羧酸循环回补过程[12]。而本实验中,在Gln缺乏条件下加入三羧酸循环中间产物OAA或α-KG后,发现H446细胞中ATP水平和增殖水平并没有得到恢复,提示H446细胞中Gln不通过三羧酸循环回补途径影响细胞增殖,推测可能通过糖异生或者其他途径影响细胞增殖。但是加入三羧酸循环中间产物OAA或α-KG后存活比例升高,其原因目前尚不清楚。此外,相关研究指出,Gln不仅参与细胞的能量生成,还作为谷胱甘肽的前体,参与自由基清除,维持氧化还原平衡[13]。本研究结果显示,Gln缺乏条件下细胞中ROS水平升高,加入NAC后,ROS水平下降,增殖、克隆水平和存活比例都有不同程度的恢复,提示Gln缺乏可通过提高ROS水平影响细胞增殖和生存。GLS可使Gln转化为谷氨酸,其在哺乳类细胞中有2种类型:GLS1和GLS2,其中,GLS1在癌症发生过程中有重要作用。在本实验中,结果显示BPTES抑制H446细胞的增殖和存活。目前,也有其他研究表明,在前列腺癌和肝细胞癌组织中,GLS1的表达水平高于正常组织,BPTES作为GLS1的特异性抑制剂,可抑制一些肿瘤的生长[14]。本实验结合临床上常用的放疗手段和放疗原理,选择用H2O2来模拟放疗[15-16],结果显示相对于单独用BPTES或H2O2,联合应用BPTES和H2O2可以更有效地抑制细胞的生存,推测Gln代谢的抑制可以增强放疗敏感性。
综上所述,Gln缺乏可通过增高ROS水平抑制小细胞肺癌H446细胞的增殖和生存,联合应用GLS抑制剂BPTES和H2O2可有效抑制H446细胞的生长。但其中可能还存在其他相关的作用机制,需待进一步深入研究。
[1]Kim DW,Wu N,Kim YC,et al.Genetic requirement for Mycl and efficacy of RNA Pol I inhibition in mouse models of small cell lung cancer[J].Genes Dev,2016,30(11):1289-1299.doi:10.1101/ gad.279307.116.
[2]Weiskopf K,Jahchan NS,Schnorr PJ,et al.CD47-blocking immunotherapies stimulate macrophage-mediated destruction of small-cell lung cancer[J].J Clin Invest,2016,126(7):2610-2620.doi:10.1172/JCI81603.
[3]Vander Heiden MG,Cantley LC,Thompson CB.Understanding the Warburg effect:the metabolic requirements of cell proliferation[J]. Science,2009,324(5930):1029-1033.doi:10.1126/science.1160809.
[4]Bolzoni M,Chiu M,Accardi F,et al.Dependence on glutamine uptake and glutamine addiction characterize myeloma cells:a new attractive target[J].Blood,2016,128(5):667-679.doi:10.1182/ blood-2016-01-690743.
[5]Chakrabarti G,Moore ZR,Luo X,et al.Targeting glutamine metabolism sensitizes pancreatic cancer to PARP-driven metabolic catastrophe induced by β-lapachone[J].Cancer Metab,2015,3: 12.doi:10.1186/s40170-015-0137-1.
[6]Molavian HR,Goldman A,Phipps CJ,et al.Drug-induced reactive oxygen species(ROS)rely on cell membrane properties to exert anticancer effects[J].Sci Rep,2016,6:27439.doi:10.1038/ srep27439.
[7]Draghiciu O,Lubbers J,Nijman HW,et al.Myeloid derived suppressor cells-An overview of combat strategies to increase immunotherapy efficacy[J].Oncoimmunology,2015,4(1):e954829.doi:10.4161/21624011.2014.954829.
[8]Cao L,Chen X,Xiao X,et al.Resveratrol inhibits hyperglycemiadriven ROS-induced invasion and migration of pancreatic cancer cells via suppression of the ERK and p38 MAPK signaling pathways[J].Int J Oncol,2016,49(2):735-743.doi:10.3892/ ijo.2016.3559.
[9]Sappington DR,Siegel ER,Hiatt G,et al.Glutamine drives glutathione synthesis and contributes to radiation sensitivity of A549 and H460 lung cancer cell lines[J].Biochim Biophys Acta,2016,1860(4):836-843.doi:10.1016/j.bbagen.2016.01.021.
[10]Xie C,Jin J,Bao X,et al.Inhibition of mitochondrial glutaminase activity reverses acquired erlotinib resistance in non-small cell lung cancer[J].Oncotarget,2016,7(1):610-621.doi:10.18632/ oncotarget.6311.
[11]Lee YM,Lee G,Oh TI,et al.Inhibition of glutamine utilization sensitizes lung cancer cells to apigenin-induced apoptosis resulting from metabolic and oxidative stress[J].Int J Oncol,2016,48(1):399-408.doi:10.3892/ijo.2015.3243.
[12]White E.Exploiting the bad eating habits of Ras-driven cancers[J].Genes Dev,2013,27(19):2065-2071.doi:10.1101/ gad.228122.113.
[13]Hudson CD,Savadelis A,Nagaraj AB,et al.Altered glutamine metabolism in platinum resistant ovarian cancer[J].Oncotarget,2016,7(27):41637-41649.doi:10.18632/oncotarget9317.
[14]Lee SY,Jeon HM,Ju MK,et al.Dlx-2 and glutaminase upregulate epithelialmesenchymaltransitionandglycolyticswitch[J]. Oncotarget,2016,7(7):7925-7939.doi:10.18632/oncotarget.6879.
[15]Ogawa Y.Paradigm shift in radiation biology/radiation oncologyexploitation of the"H(2)O(2)effect"for radiotherapy using low-LET(Linear Energy Transfer)radiation such as X-rays and highenergy electrons[J].Cancers(Basel),2016,8(3).pii:E28.doi:10.3390/cancers8030028.
[16]Ogawa Y,Ue H,Tsuzuki K,et al.New radiosensitization treatment(KORTUC I)using hydrogen peroxide solution-soaked gauze bolus for unresectable and superficially exposed neoplasms[J].Oncol Rep,2008,19(6):1389-1394.doi:10.3892/or.19.6.1389.
(2016-06-26收稿 2016-10-26修回)
(本文编辑 李国琪)
Glutamine regulates the proliferation and survival of small cell lung cancer H446 cells
XU Pengyu,LI Jiayin,MIAO Yajing,GAO Cuicui,SHEN Yao,JIN Fang,QIU Xiaofei△
Tianjin Medical University,Tianjin 300070,China△
ObjectiveTo investigate the effects of glutamine(Gln)on proliferation and survival of small cell lung cancer H446 cells,and further to explore the potential mechanism.MethodsThe proliferation of H446 cells was detected at different time points(0,24,48,72 and 96 h)by CCK-8 assay in Gln(+)group and Gln(-)group,and an optimal time was selected.Under the optimal time,Annexin V-FITC/PI staining,CellTiter-Glo®assay kit and flow cytometer were used to detect cell survival,cellular adenosine triphosphate(ATP)and reactive oxygen species(ROS)levels.Gln(-)group was used as the control group,under the condition of Gln deficiency,cellular ATP,cell proliferation and survival were detected after adding oxaloacetic acid(OAA)or dimethyl-α-ketoglutarate(DM-αKG).Gln(-)group was used as the control group, cellular ROS,cell proliferation,colony and survival were detected after treated with ROS scavenger N-acetyl cysteine (NAC).With different concentrations(0,2,5,10 μmol/L)of glutaminase inhibitor BPTES,the optimal concentration was selected through the colony assay.The cellular ATP and ROS levels and cell proliferation were detected under the optimal concentration.H446 cells were treated with bis-2-(5-phenylacetamido-1,2,4-thiadiazol-2-yl)ethyl sulfide(BPTES),ROS inducer hydrogen peroxide(H2O2)or the combination of them,and cell survival ratio was compared between two groups.ResultsThe proliferation levels of H446 cells at 24,48,which were decreased most significantly in 72 h in Gln(-)group. When 72 h was used as the optimal time,the cell survival ratio and ATP level were decreased,and the ROS level was increased,in Gln(-)group compared with those of Gln(+)group(P<0.05).There was a higher survival ratio in H446 cellsin Gln(-)+OAA group and Gln(-)+DM-αKG group than that of Gln(-)group(P<0.05),but there were no significant differences in cell proliferation and ATP levels between Gln(-)group,Gln(-)+OAA group and Gln(-)+DM-αKG group. The ROS level was reduced,the cell proliferation,colony level and survival ratio were increased in Gln(-)+NAC group compared with those of Gln(-)group(P<0.05).Cloning assay showed that 10 μmol/L was the optional concentration.Under this concentration,the proliferation and ATP level were decreased in Gln(+)+BPTES group(P<0.05),and cellular ROS level was up-regulated compared with Gln(+)group.The survival ratio was significantly lower in BPTES+H2O2group compared with BPTES(+)group or H2O2(+)group.ConclusionGlutamine deficiency inhibits the proliferation and survival ratio of H446 cells through enhancing ROS level.BPTES and H2O2show synergistically inhibitory effect on the survival of H446 cells.
glutamine;lung neoplasms;carcinoma,small cell;adenosine triphosphate;reactive oxygen species;cell proliferation;cell survival
R734.2
A
10.11958/20160592
天津市应用基础与前沿技术研究计划重点项目(14JCZDJC35500)
天津医科大学(邮编300070)
徐鹏育(1991),女,硕士在读,主要从事肿瘤分子病理学研究
△通讯作者E-mail:qiouxf@tijmu.edu.cn
