雌激素受体对乳腺癌细胞截短型神经激肽受体-1的调控作用
2017-01-09刘晓彬仝颖娜张露芳周云丽
刘晓彬,仝颖娜,张露芳,周云丽
雌激素受体对乳腺癌细胞截短型神经激肽受体-1的调控作用
刘晓彬,仝颖娜,张露芳,周云丽△
目的 探讨雌激素受体α(ERα)阳性的乳腺癌细胞中ERα对神经激肽受体-1截短型变异体(NK1R-Tr)的调控作用,以及ERα是否通过调控NK1R-Tr的表达,间接调控细胞的增殖能力。方法染色质免疫共沉淀(CHIP)实验验证ERα是否可以结合到NK1R-Tr启动子上游的ERα反应元件,直接调控NK1R-Tr的表达;荧光素酶报告基因实验验证ERα是否对NK1R-Tr的表达起正性调控作用。Western blot实验和RT-PCR实验检测乳腺癌细胞系MCF-7和T47D的ERα和NK1R-Tr在蛋白水平和mRNA水平的表达情况;以及在ERα激动剂雌二醇(E2)刺激的条件下,小干扰RNA敲除ERα后,NK1R-Tr在不同水平的表达情况;小干扰RNA敲除NK1R-Tr后,CCK-8和克隆形成实验检测敲除NK1R-Tr的乳腺癌细胞的增殖能力。结果在NK1R-Tr基因启动子上游存在ERα的反应元件,ERα在E2存在条件下作用于该反应元件,对NK1R-Tr的表达起正性调控作用。同样在E2刺激的条件下,敲除乳腺癌细胞MCF-7内源性ERα后,NK1R-Tr在蛋白水平和mRNA水平的表达均下降;且敲除NK1R-Tr的MCF-7细胞增殖能力较未敲除组明显降低。结论在ERα阳性的乳腺癌细胞中,ERα正性调控NK1R-Tr的表达,从而增强细胞的增殖能力。
乳腺肿瘤;细胞系,肿瘤;雌激素受体α;受体,神经激肽1;RNA,小分子干扰;染色质免疫沉淀法;细胞增殖;荧光素酶报告基因
乳腺癌(breast cancer,BC)作为全球女性最常见的恶性肿瘤,正日益受到全社会的关注,其致死率在各种女性肿瘤中位列第二[1]。Ho等[2]研究显示大约70%的乳腺癌患者存在雌激素受体α(ERα)过表达,且对内分泌治疗敏感[3]。在分子水平上,ERα作为转录因子,在其配体17β-雌二醇(E2)存在的条件下,可以调控靶基因的表达,参与到包括乳腺癌在内的多种生理和病理活动中[4]。前期研究表明,神经激肽受体-1(NK1R)主要有2个亚型:全长型亚型NK1R-FL和截短型亚型NK1R-Tr,并且NK1R-Tr的表达量随肿瘤恶性程度的增高而增高[5-7],促进了乳腺癌细胞的远处转移[8]。尽管有大量关于ERα所参与的病理生理过程的报道[9],但ERα与NK1RTr之间的调控机制却鲜有研究。在乳腺癌细胞中,ERα是否能通过基因和非基因组途径与NK1R-Tr相互作用,从而调控乳腺癌细胞的增殖能力尚不明确,本研究将对这一问题进行分析,旨在为乳腺癌的治疗与判断预后提供新的理论依据。
1 材料与方法
1.1 细胞系与主要试剂乳腺癌细胞系MDA-MB-231、MCF-7和T47D与人肾脏HEK-293工具细胞均购自美国典型菌种保藏中心(ATCC)。β-actin、ERα与NK1R-Tr PCR引物,NK1R-Tr和ERα的小干扰RNA(siRNA-NK1R-Tr,siRNA-ERα)均购自广州锐博生物科技有限公司。鼠源βactin单克隆抗体购自美国Sigma-Aldrich公司;兔源ERα单克隆抗体购自美国CST公司;羊抗鼠和羊抗兔HRP标记的IgG购自英国的Upstate公司;反转录试剂盒、RT-PCR试剂盒购自美国Thermo公司。染色质免疫共沉淀(CHIP)试剂盒购自美国CST公司。CCK-8试剂盒购自日本同仁化学试剂公司。转染试剂Lipofectamine2000(lipo2000)购自美国Invitrogen公司。
1.2 方法
1.2.1 ERα阳性的乳腺癌细胞系的选择和蛋白免疫印迹(Western blot)实验采用常规提取细胞总蛋白方法提取乳腺癌MDA-MB-231、MCF-7和T47D细胞总蛋白,MDAMB-231细胞蛋白作为ERα的阴性对照蛋白,MCF-7和T47D细胞蛋白为ERα阳性待检测蛋白。以同样的方法提取野生型和干扰型(敲除NK1R-Tr和ERα)乳腺癌细胞MCF-7和T47D总蛋白,在4%SDS-PAGE浓缩凝胶和10% SDS-PAGE分离凝胶电泳分离;电泳结束后切去浓缩胶部分,250 mA、90 min电转移蛋白至PVDF膜,牛奶常温封闭1 h;TBST轻轻冲洗,裁剪ERα、NK1R-Tr和β-actin目的条带分别置于ERα特异性一抗(1∶2 000),NK1R的N末端特异性一抗(1∶100)和β-actin特异性一抗(1∶5 000)中孵育,4℃过夜。二抗1∶8 000稀释,将PVDF膜置于二抗孵育液中室温振摇孵育1 h,用ECL发光剂显示阳性条带。
1.2.2 CHIP培养乳腺癌MCF-7细胞,在培养上清液中加入ERα激动剂E2,待细胞生长覆盖率为80%~90%时,收集细胞,冰PBS洗3次,用1%甲醛交联10 min,加甘氨酸中和甲醛,弃废液,冰PBS重复洗3次。加入Micrococcal Nuclease 37℃孵育20 min,加0.5 mol/L EDTA终止消化。超声波细胞粉碎机(ScientzⅡD)20%输出功率,超声破碎细胞后离心,取上清并分为实验组与阴性对照组。实验组加入Anti-ERα抗体,阴性对照组加入非特异性IgG,均4℃孵育过夜,待抗体与ERα-DNA复合物相互结合后,加入Protein G磁珠,沉淀抗体-ERα-DNA复合物,并对沉淀下来的复合物进行清洗。洗脱,得到可能富集ERα-DNA的复合物,解交联,用DNA纯化柱纯化并富集被沉淀下来的DNA片段,对包括NK1R 5′侧旁区ERα的反应元件在内的NK1R-Tr的DNA进行实时定量(RT)-PCR分析。
1.2.3 荧光素酶报告基因实验培养乳腺癌MCF-7细胞,提取细胞总RNA后,反转录为cDNA,扩增可能含有ERα的反应元件在内的NK1R-Tr的DNA启动子片段,将此片段插入到荧光素酶报告基因质粒中,形成pMIR-luciferase-NK1R-Tr-WT质粒;并用突变试剂盒构建pMIR-luciferase-NK1R-Tr-MUT质粒。将表达ERα的质粒ERα-plasmid与pMIR-luciferase-NK1R-Tr-WT质粒共转染入HEK-293细胞作为实验组,将不表达ERα的阴性对照质粒ERα-HK与pMIR-luciferase-NK1R-Tr-WT质粒共转染入HEK-293细胞作为阴性对照组,加入特定的荧光素酶底物,荧光素酶与底物反应,检测荧光强度,将实验组的结果与对照组进行比较。
1.2.4 小干扰RNA的转染培养乳腺癌细胞MCF-7和T47D,对数生长期时将细胞接种于6 cm培养皿中,饥饿过夜。将10 μL lipo2000和10 μL溶好的siRNA分别加入400 μL无血清培养液中,各自孵育10 min后混合孵育20 min,缓慢滴加于培养皿中,边滴加边混匀。于转染后6 h换含10%胎牛血清的培养液,并观察细胞生长状态。敲除ERα的siRNA和敲除NK1R-Tr的siRNA分别有3个序列,只选取2个最有效的序列进行实验,敲除ERα的siRNA标记为siRNA-#1、siRNA-#2,敲除NK1R-Tr的siRNA标记为siRNA-*1、siRNA-*2。
1.2.5 RT-PCRTrizol处理对数生长期的乳腺癌细胞,提取野生型和干扰型(敲除ERα)MCF-7细胞总RNA,逆转录为cDNA,采用特异性引物进行RT-PCR。NK1R-Tr引物上游5′-GACCATCTACATACACAGTGGC-3′,下游5′-GGCT⁃GAGTTGTGTGATGATAAG-3′,ERα引物上游5′-TCCAG⁃CACCCTGAAGTCTCT-3′,下游5′-AGATGCTCCATGCCTTT⁃GTT-3′,内参照β-actin引物上游为5′-TTGCCGACAGGAT⁃GCAGAAGGA-3′,下游为5′-AGGTGGACAGCGAGGCCAG⁃GAT-3′。每次实验重复3次。NK1R-Tr的相对表达量(RQ)=2-ΔΔCt,其中ΔΔCt=ΔCt样品-ΔCt对照=(Ct样品NK1R-Tr-Ct样品β-actin)-(Ct对照NK1R-Tr-Ct对照βactin)。
1.2.6 CCK-8比色法检测细胞的增殖能力培养siRNA-*1敲除NK1R-Tr的MCF-7细胞和T47D细胞,对数生长期时进行消化计数,接种于96孔板,接种密度为2 000个/孔。于贴壁后每孔加8%的CCK-8溶液,37℃孵育3 h后测0 day的光密度(OD)值,以同样的方法检测1、2、3、4、5 d的OD值。每天每个细胞做8个复孔,取其OD值的平均值,每个实验重复3次。
1.2.7 克隆形成实验培养siRNA-*1敲除NK1R-Tr的MCF-7细胞和T47D细胞,对数生长期时进行消化计数后接种于6 cm培养皿中,摇匀。接种密度为500个/培养皿,37℃、5%CO2环境培养7~14 d。甲醇固定10 min,0.005%的结晶紫染色20 min。以大于50个细胞作为1个克隆,显微镜下计数。每种处理的细胞做3个重复。
1.3 统计学方法采用SPSS 19.0软件处理,计量资料进行正态性检验以及方差齐性检验,以表示,两个样本均数的组间比较采用独立样本的t检验,P<0.05为差异有统计学意义。
2 结果
2.1 Western blot结果验证乳腺癌细胞系ERα的表达情况在内参β-actin表达量一致的条件下,MDA-MB-231细胞的ERα表达为阴性,MCF-7和T47D细胞的ERα的表达为阳性,且MCF-7的表达量较T47D细胞高,见图1。
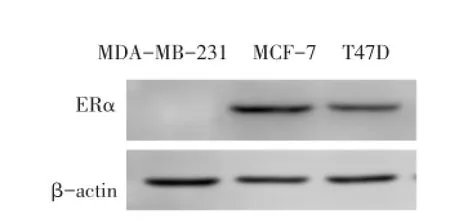
Fig.1 ERα expression in breast cancer cells detected by Western blot assay图1 ERα在乳腺癌细胞系表达的Western blot检测
2.2 CHIP与荧光素酶报告基因实验证明ERα对NK1R-Tr的正调控作用在ERα阳性的乳腺癌细胞MCF-7中进行实验。CHIP结果显示在E2刺激的条件下,Anti-ERα组的NK1R-Tr表达量较IgG阴性对照组明显升高(t=6.495,P<0.01),见图2。荧光素酶报告基因实验结果显示,在共转染了NK1R-Tr-WT报告基因质粒与表达ERα质粒ERα-piasmid的HEK-293细胞中,荧光素酶活性较转染NK1R-Tr-WT报告基因和ERα-HK的对照组明显升高(t=3.289,P<0.05);而转染了NK1R-Tr-MUT和ERα-plasmid组,转染了NK1R-Tr-MUT和ERα-HK组的荧光素酶活性均较转染NK1R-Tr-MUT和ERα-HK的对照组没有明显差异,见图3。
2.3 敲除MCF-7细胞内源性ERα,NK1R-Tr表达明显下降siRNA转染敲除乳腺癌细胞MCF-7和T47D的内源性ERα后,在E2刺激的条件下Western blot结果显示,转染siRNA-#1和siRNA-#2的细胞中,ERα的蛋白表达量较转染对照序列的细胞明显下降,并且NK1R-Tr的蛋白表达量较转染对照序列的细胞也有明显的下降趋势,见图4。RTPCR检测敲除ERα的MCF-7细胞中内源性ERα和NK1R-Tr的mRNA表达水平,结果显示,同样在E2刺激的条件下,转染siRNA-ERα组细胞中的ERα和NK1R-Tr的表达在mRNA水平较转染对照序列的细胞均明显降低,差异有统计学意义(tERα= 5.549,tNK1R-Tr=4.933,均P<0.01),见图5。

Fig.2 CHIP assay in MCF-7 cells图2 乳腺癌细胞系MCF-7细胞中染色质免疫共沉淀产物的RT-PCR检测(**P<0.01)
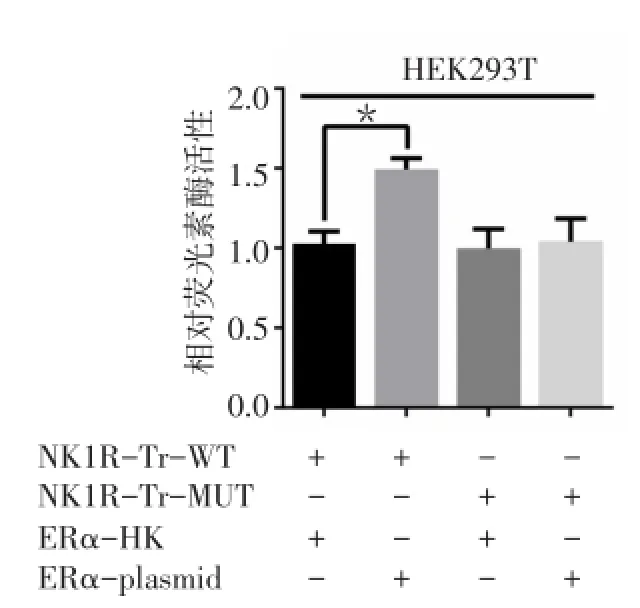
Fig.3 Luciferase reporter gene assay of ERα and NK1R-Tr图3 ERα与NK1R-Tr荧光素酶报告基因实验(*P<0.05)

Fig.4 The expression of NK1R-Tr detected by Western blot assay图4 敲除ERα的乳腺癌细胞NK1R-Tr表达的Western blot检测
2.4 敲除乳腺癌细胞NK1R-Tr的表达,其增殖能力下降siRNA转染敲除乳腺癌细胞MCF-7和T47D的内源性NK1R-Tr,Western blot结果显示,在转染了siRNA-*1和siRNA-*2的细胞中,NK1R-Tr的蛋白表达量较转染对照序列的细胞明显下降,见图6。在E2刺激的条件下,CCK-8结果显示,从检测的第4天开始,敲除NK1R-Tr组的MCF-7和T47D乳腺癌细胞的增殖能力明显低于对照组,差异有统计学意义(4 d时,tMCF-7=3.700,tT47D=3.535,均P<0.05;5 d时,tMCF-7=4.563,tT47D=4.316,均P<0.05),见图7。同样在E2刺激的条件下,克隆形成实验结果示,敲除NK1R-Tr组的MCF-7和T47D乳腺癌细胞的克隆形成能力较对照组明显降低,差异有统计学意义(tMCF-7=4.028,tT47D=4.234,均P<0.05),见图8。

Fig.5 ERα and NK1R-Tr expressions in MCF-7 cells detected by RT-PCR图5 ERα与NK1R-Tr在乳腺癌MCF-7细胞中表达的RT-PCR检测(**P<0.01)

Fig.6 NK1R-Tr expression in breast cancer cells detected by Western blot assay图6 敲除NK1R-Tr的乳腺癌细胞Western blot检测

Fig.7 Results of CCK-8 assay of breast cancer cells after knocking out NK1R-Tr图7 敲除NK1R-Tr的乳腺癌细胞的CCK-8实验(*P<0.05)

Fig.8 Colony formation assay of breast cancer cells after knocking out NK1R-Tr图8 敲除NK1R-Tr的乳腺癌细胞的克隆形成实验(*P<0.05)
3 讨论
根据ERα的表达情况可以将乳腺癌分为ERα阴性和ERα阳性两大类,激活状态的ERα会以同源二聚体的形式进入细胞核,与其靶基因启动子上游的反应元件结合,从而调控靶基因的表达,促进细胞增殖[3,10]。ERα在乳腺癌早期的进展过程中扮演着重要的角色,了解ERα调控网络的机制有助于建立针对ERα阳性乳腺癌的治疗方案。有报道称ERα通过调控E2依赖的转录作用提高了乳腺癌的患病风险,但由于对雌激素受体拮抗剂治疗敏感,所以ERα阳性乳腺癌患者的生存率更高[11]。
速激肽家族的重要成员P物质(SP)通过激活并结合其偏嗜性受体NK1R发挥生物学效应,并且这种受体-配体复合物已被证实是抗肿瘤的独立靶点[12-14]。NK1R主要分布在中枢神经和周围组织,在乳腺组织也呈广泛分布[15]。目前在mRNA和蛋白水平所发现的人NK1R只有2种:由5个外显子组成的全长型受体(full-length,NK1R-FL)和C-末端缺乏96个氨基酸残基的截短型受体(Truncated,NK1R-Tr),前期研究显示其全长型变异体NK1RFL与乳腺癌细胞的侵袭转移呈负相关;截短型变异体NK1R-Tr则随着乳腺癌的进展表达不断升高[16]。在ERα阳性的乳腺癌细胞中,ERα是否可以通过调控NK1R-Tr的表达,进而影响乳腺癌细胞的增殖能力尚不清楚。
本研究显示,在ERα阳性的MCF-7和T47D细胞中敲除ERα后,NK1R-Tr在蛋白水平和mRNA水平的表达确有下降,说明ERα对NK1R-Tr有一定的调控作用,但是这种调控作用是如何实现的还不得而知。CHIP实验结果证明在NK1R-Tr启动子上游存在ERα的反应元件,结合荧光素酶报告基因实验的结果可知,ERα可以通过结合到该反应元件上,对NK1R-Tr的表达起正性调控的作用。另外值得注意的是,敲除ERα组细胞在E2刺激的条件下,NK1R-Tr的表达略有所增高,可能是因为除ERα外,E2还可以通过其他旁路作用于NK1R-Tr,并升高其表达,但这种升高作用较经典的E2-ERα-NK1R的作用弱。CCK-8增殖实验和克隆形成实验结果显示,小干扰敲除乳腺癌细胞内源性NK1R-Tr后,MCF-7和T47D细胞的增殖能力明显降低,这说明NK1R-Tr的高表达确实与癌细胞高增殖能力相关。总之,本项研究所有结果均指向E2-ERα-NK1R的正性调控机制,并且这一机制可以增强癌细胞的增殖能力。
综上所述,将NK1R-Tr调控细胞增殖的能力与ERα调控细胞增殖的机制联系在一起,就是把SPNK1R所参与的体内神经调节与E2-ERα为代表的体内内分泌调控系统交联起来,这一调控机制当中的任一环节出现异常调节,任一指标出现异常表达,均可以成为乳腺癌发生发展的潜在因素,所以明确这一调控网络的确切机制可能为临床乳腺癌患者的治疗和判断预后提供一定的理论依据。尽管E2-ERα-NK1R与乳腺癌进展之间的关系以及NK1R抑制剂的作用还有待进一步深入验证,但ERα-NK1R-Tr调控通路已成为乳腺癌治疗重要的潜在新靶点。
[1]Fleisher B,Clarke C,Ait-Oudhia S.Current advances in biomarkers for targeted therapy in triple-negative breast cancer[J]. Breast Cancer(Dove Med Press),2016,8:183-197.
[2]Ho JY,Chang FW,Huang FS,et al.Estrogen enhances the cell viability and motility of breast cancer cells through the ERα-ΔNp63-Integrin β4 signaling pathway[J].PLoS One,2016,11(2):e0148301.doi:10.1371/journal.pone.0148301.
[3]Park UH,Kang MR,Kim EJ,et al.ASXL2 promotes proliferation of breast cancer cells by linking ERα to histone methylation[J]. Oncogene,2016,35(28):3742-3752.doi:10.1038/onc.2015.443.
[4]Noh H,Park J,Shim M,et al.Trichostatin A enhances estrogen receptor-alpha repression in MCF-7 breast cancer cells under hypoxia[J].Biochem Biophys Res Commun,2016,470(3):748-752.doi:10.1016/j.bbrc.2016.01.022.
[5]Rosso M,Muñoz M,Berger M.The Role of neurokinin-1 receptor in the microenvironment of inflammation and cancer[J].Scientific World Journal,2012,2012:381434.doi:10.1100/2012/381434.
[6]Muñoz M,Coveñas R.Neurokinin-1 receptor:a new promising target in the treatment of cancer[J].Discov Med,2010,10(53):305-313.
[7]Ilmer M,Garnier A,Vykoukal J,et al.Targeting the neurokinin-1 receptor compromises canonical Wnt Signaling in hepatoblastoma[J].Mol Cancer Ther,2015,14(12):2712-2721.doi:10.1158/ 1535-7163.MCT-15-0206.
[8]Page NM.New challenges in the study of the mammalian tachykinins[J].Peptides,2005,26(8):1356-1368.
[9]Flach KD,Zwart W.The first decade of estrogen receptor cistromics in breast cancer[J].J Endocrinol,2016,229(2):R43-56.doi: 10.1530/JOE-16-0003.
[10]Fong TM,Anderson SA,Yu H,et al.Differential activation of intracellular effector by two isoforms of human neurokinin-1 receptor[J].Mol Pharmacol,1992,41(1):24-30.
[11]Caberlotto L,Hurd YL,Murdock P,et al.Neurokinin 1 receptor and relative abundance of the short and long isoforms in the human brain[J].Eur J Neurosci,2003,17(9):1736-1746.
[12]Tuluc F,Lai JP,Kilpatrick LE,et al.Neurokinin 1 receptor isoforms and the control of innate immunity[J].Trends Immunol,2009,30(6):271-276.doi:10.1016/j.it.2009.03.006.
[13]Zeng H,Xu W.Ctr9,a key subunit of PAFc,affects global estrogen signaling and drives ERα-positive breast tumorigenesis[J].Genes Dev,2015,29(20):2153-2167.doi:10.1101/gad.268722.115.
[14]Dalvai M,Bystricky K.The role of histone modifications and variants in regulating gene expression in breast cancer[J].J Mammary Gland Biol Neoplasia,2010,15(15):19-33.doi: 10.1007/s10911-010-9167-z.
[15]Pinto FM,Bello AR,Gallardocastro M,et al.Analysis of the expression of tachykinins and tachykinin receptors in the rat uterus during early pregnancy[J].Biol of Reprod,2015,93(2):51.doi: 10.1095/biolreprod.115.130617.
[16]Steinhoff MS,Von MB,Geppetti P,et al.Tachykinins and their receptors:contributionstophysiologicalcontrolandthe mechanisms of disease[J].Physiol Rev,2014,94(1):265-301. doi:10.1152/physrev.00031.2013.
(2016-10-18收稿 2016-11-07修回)
(本文编辑 李国琪)
Study on the regulation of ERα on NK1R-Tr in breast cancer cells
LIU Xiaobin,TONG Yingna,ZHANG Lufang,ZHOU Yunli△
Department of Clinical Laboratory,Cancer Institute and Hospital,Tianjin Medical University,National Clinical Research Center of Cancer,Tianjin Key Laboratory of Cancer Prevention and Therapy,Tianjin 300060,China△
ObjectiveTo analyze the regulation of estrogen receptor α(ERα)on truncated neurokinin-1 receptor (NK1R-Tr),and the influence of this regulation on cell proliferation in estrogen receptor-positive breast cancer cell lines.MethodsThe chromatin immune coprecipitation(CHIP)was used to observe the transcriptional regulation function of ERα on NK1R-Tr in breast cancer cells.Luciferase reporter gene assay was used to verify whether ERα played a positive regulatory role in the expression of NK1R-Tr.Western blot assay and real-time-PCR were used to detect the expression of ERα and NK1R-Tr in breast cancer cells,MCF-7 and T47D,as well as the expression of NK1R-Tr protein and mRNA level.NK1R-Tr levels were also detected after using estradiol(E2,ERα agonist)and small interfering RNA(knock out ERα).CCK-8 and clone formation experimen were used to detect the proliferation ability of breast cancer cells after knocking out NK1R-Tr with small interfering RNAs.ResultsCHIP test and Luciferase reporter gene assay proved that ERα can positively regulate the expression of NK1R-Tr via the ERα sequences in the upstream of the NK1R-Tr gene promoter.The expression of NK1R-Tr at both protein level and mRNA level dropped in the estrogen receptor-positive breast cancer cell line MCF-7 upon knocking out ERα.After knocking out NK1R-Tr,the proliferation ability of estrogen receptorpositive breast cancer cells was lower than that of the control group.ConclusionThe ERα positively regulates the expression of NK1R-Tr,resulting in the increased cell proliferation in estrogen positive breast cancer cells.
breast neoplasms;cell line,tumor;estrogen receptor alpha;receptors,neurokinin-1;RNA,small interfering;chromatin immunoprecipitation;cell proliferation;luciferase reporter
R737.9
A
10.11958/20161193
国家自然科学基金资助项目(81201653)
天津医科大学肿瘤医院检验科,国家肿瘤临床医学研究中心,天津市恶性肿瘤临床医学研究中心,天津市“肿瘤防治”重点实验室(邮编300060)
刘晓彬(1990),女,硕士研究生,主要从事乳腺癌神经激肽受体表达调控的研究
△通讯作者E-mail:zhouyunli@tjmuch.com
