不同免疫亲和柱对饲料中黄曲霉毒素检测结果的影响研究
2017-01-08司慧民穆伟峰吴志明
■司慧民 穆伟峰 吴志明*
(1.河南省兽药饲料监察所,河南郑州450008;2.新乡市畜产品质量监测检验中心,河南新乡453200)
黄曲霉毒素(Aflatoxin AFT)是由黄曲霉(Aspergil⁃lus flavus)、寄生曲霉(A.parasiticus)、特异曲霉(A.nomius)和假溜曲霉(A.pseudotamarii)这四种曲霉属真菌产生的次级代谢产物,是一组化学结构类似的化合物,主要有黄曲霉B1、B2、G1、G2(Aflatoxin B1、B2、G1、G2),其中AFB1在饲料中最为常见,毒性最强,其毒性是氰化钾的10倍,砒霜的68倍。黄曲霉毒素早在1993年就被世界卫生组织(WHO)划定为Ⅰ类致癌物,畜禽食入后,能迅速破坏肝脏、肾脏、脾脏等解毒和免疫器官,降低免疫力,抑制生长,并能在动物组织中蓄积,严重危害动物健康和畜产品安全。因此,对饲料及饲料原料中黄曲霉毒素的检测工作显得尤为重要,目前常用的检测方法有薄层层析(TLC)、高效液相色谱(HPLC)、质谱分析(MS)和酶联免疫吸附法(ELISA)等。TLC法前处理繁琐,提取净化不够理想,提取液杂质较多时影响展开斑点的荧光强度,而双向展开虽避免了杂质干扰,但增加了操作步骤和时间。ELISA方法操作简单,但容易出现假阳性。由于免疫亲和层析柱根据抗原抗体结合反应,可特异性的将真菌毒素从提取液中分离出来,提高了荧光分析的灵敏性,降低检测限,所以近几年来被广泛应用于霉菌毒素的净化处理。随着国家标准《饲料中黄曲霉毒素B1、B2、G1、G2的测定免疫亲和柱净化——高效液相色谱法》(GB/T 30955—2014)的发布实施,更促进了免疫亲和柱在饲料霉菌毒素检测的广泛推广。国际、国内的生物技术公司也纷纷推出各自的免疫亲和层析柱,但不同品牌柱子的特异性、重现性和稳定性也良莠不齐,故笔者选取两家公司的黄曲霉毒素免疫亲和柱进行对比试验。
1 仪器与材料
1.1 仪器与设备
Waters2695高效液相色谱仪(美国Waters公司)、荧光检测器(美国Agilent公司)、光化学衍生系统(美国Romer公司)、振荡器(金坛市信诚试验仪器制造厂)、玻璃纤维滤纸(英国Whatman公司)、PL403IC型电子分析天平(梅特勒上海有限公司)。
1.2 试验材料
A公司、B公司相同批次黄曲霉毒素免疫亲和柱各一盒(25支装);黄曲霉毒素阳性检出饲料两份,编号:Y1、Y2;空白饲料一份,编号为K;甲醇,乙腈,氯化钠。AFB1、B2、G1、G2混合标准品(上海安普科学仪器有限公司),PBS缓冲溶液。实验室用水符合GB/T—6682中二级用水规定,标准溶液和流动相用水符合一级用水规定。提取所需试剂为分析纯,其他试剂均为色谱级。
2 试验方法
2.1 液相色谱条件
色谱柱:C18柱(4.6 mm×150 mm,5 μm),流动相:甲醇∶水(45∶55)溶液,流速:0.8 ml/min。检测波长:激发波长360 nm;发射波长440 nm。光化学衍生系统:光化学衍生器(连接于色谱柱后,然后通向荧光检测器)。柱温30℃。进样量20 μl。
2.2 阳性样品制备
准确移取适量的黄曲霉毒素混合贮备液,50℃水浴下,将苯吹干,用适量的甲醇∶水(45∶55)溶液定容为混合标准工作液,AFB1、B2、G1、G2浓度分别为10、3、10、3 ng/ml,准确移取该工作液加入到两份空白饲料中做AFB1、B2、G1、G2含量分别为10、3、10、3 μg/kg的阳性添加,样品编号分别为T1、T2。
2.3 提取
准确称取样品K、Y1、Y2、T1、T2(精确至0.1mg)25 g于250 ml具塞锥形瓶中,加入5.0 g氯化钠及准确加入125 ml甲醇∶水(8∶2)溶液,振荡30 min。定量滤纸过滤,准确移取5 ml滤液并加入15 mlPBS溶液稀释,用玻璃纤维滤纸过滤1~2次,至滤液澄清,以备A、B公司免疫亲和柱用。
2.4 净化
将以上两组提取液分别按照A、B两公司免疫亲和柱说明书进行净化处理,最终定容于进样瓶中,供色谱检测用。
2.5 色谱测定
将标准工作溶液B和以上两组试液按照“试验方法 2.1”液相色谱条件进行检测,经过与AFB1、B2、G1、G2标准溶液谱图比较响应值得到试样中的质量浓度。
3 结果与分析
3.1 液相图谱结果与分析
将以上样品通过高效液相色谱检测获得图谱见图1~图6,其中图3和图5为用空白饲料K做阳性添加后分别用A、B两公司黄曲霉毒素免疫亲和柱净化后的结果。图3和图5对比显示:图3杂峰较多,杂质峰面积较大,AFB2拖尾严重,四种毒素的峰型较差;图4和图6为同一个阳性样品Y1分别用A、B两公司免疫亲和柱净化后的结果,对比显示:该饲料为AFB1检出,但图4基本未检出且很难对其进行定量。据此分析:虽然同为黄曲霉毒素免疫亲和柱,但A公司免疫亲和柱净化作用较差,对毒素的特异性吸附能力弱,从而影响样品的检测结果。

图1 AFB1、B2、G1、G2标准品图谱

图2 空白样品K图谱

图3 T1图谱(A公司柱子净化)

图4 Y1图谱(A公司柱子净化)
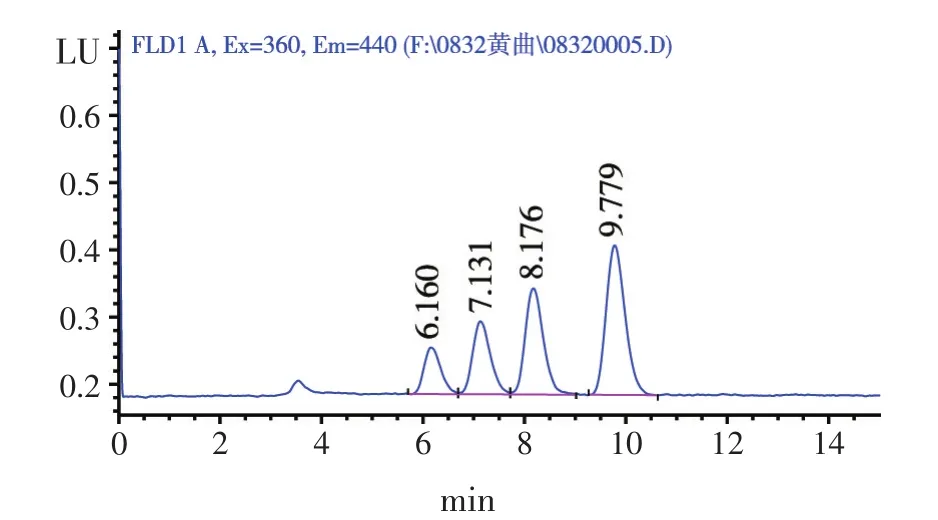
图5 T1图谱(B公司柱子净化)

图6 Y1图谱(B公司柱子净化)
3.2 数据结果与分析(见表1、表2)
将以上样品图谱进行积分处理并与标准品图谱响应值比较,可获得最终样品残留量,从表1和表2的对比可知:使用A公司柱子的样品检测结果明显低于B公司,其中阳性添加样品T1用A公司柱子净化后AFB1、B2、G1、G2的回收率通过检测结果并经添加量计算分别为67.3%、74.3%、68.2%、77.7%;而用B公司柱子净化后回收率分别为104.3%、97.3%、97.7%、98.3%,A公司免疫亲和柱的回收率远低于B公司柱子,这也导致表1、表2中阳性样品Y1、Y2的最终检测结果差别较大。

表1 A公司柱子净化后检测结果(μg/kg)
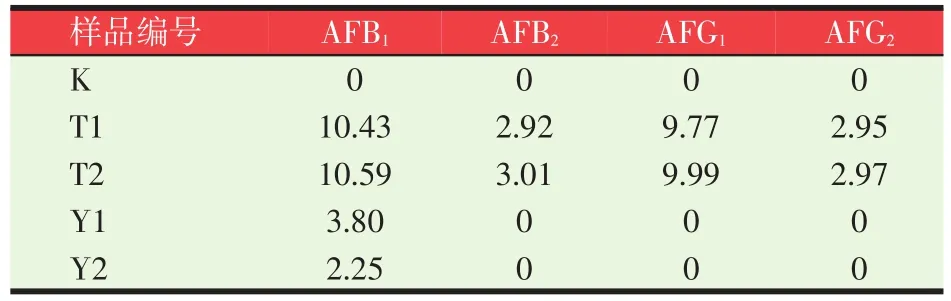
表2 B公司柱子净化后检测结果(μg/kg)
4 讨论
免疫亲和柱净化样品原理是真菌毒素单克隆抗体通过免疫亲和吸附作用特异性地将毒素分子从待检样品的复杂组分中分离出来,所以单克隆抗体的特异性直接影响到免疫亲和柱的净化作用。一些公司生产单克隆抗体大多是通过动物直接免疫获得的抗体产品,多数没有实现规模制备,所以抗体产量低、特异性差、产品不稳定。抗体与活化基体的偶联方式也影响抗体的亲合力,随机偶联时,基体与抗体的结合位点不固定,抗体的抗原结合位点可能被占用,或者挤占了抗原结合位点的空间结构,导致与抗体失去亲和力。所以随机偶联后的免疫活性一般较低;定向偶联是先将protein A或protein G固定在基体上,protein A或protein G只与IgG的Fc区相结合,然后用二甲基庚二酸酯等化学交联剂使抗体(多抗或单抗)与pro⁃tein A或protein G定向偶联,抗体上的抗原结合位点则处于游离状态。黄昕等的试验研究表明,使用protein A的定向偶联抗原结合容量是随机偶联的1.8倍,说明定向偶联有助于提高免疫亲和吸附剂的抗原结合容量。所以,同样是免疫亲和柱但其净化效果却大相径庭,导致检测结果出现较大偏差,在按照GB/T 30955—2014进行试验操作时很难发现免疫亲和柱对样品检测结果的影响,所以其它检测机构在使用该方法时务必考察免疫亲和柱的各种性能后再决定是否购买使用,选择使用正确的免疫亲和柱来保证检测结果的科学公正。
