纤维素纳米纤维增强丝素体系的相界面研究
2017-01-07邵惠丽胡学超张耀鹏
陈 建,张 超,邵惠丽,胡学超,张耀鹏
(纤维材料改性国家重点实验室,东华大学材料科学与工程学院,上海 201620)
研究论文
纤维素纳米纤维增强丝素体系的相界面研究
陈 建,张 超,邵惠丽,胡学超,张耀鹏*
(纤维材料改性国家重点实验室,东华大学材料科学与工程学院,上海 201620)
以丝素蛋白为基体,以细菌纤维素纳米纤维束(BCNRs)为增强体,通过冷冻干燥制备出具有插层结构且力学性能显著增强的复合支架。通过同步辐射原位小角X-射线散射研究了BCNRs丝素蛋白混合溶液在剪切下的相界面结构变化,考察了两相之间的界面厚度和均方旋转半径变化过程,并通过软件模拟得到聚集体的三维结构变化,进而从微观角度探究其增强机理。
丝素蛋白 细菌纤维素 纳米纤维 小角X-射线散射 微观结构 相界面
丝素蛋白(SF)因具有良好的生物相容性、可控的降解性能、无免疫原性等成为制备组织工程支架的绝佳材料。SF同时具有较高的机械强度[1],但是作为骨组织等硬组织修复支架材料,其机械强度仍不能满足医用要求。细菌纤维素(BC)是木醋杆菌等菌种发酵产生的纤维素纳米纤维。与其他植物纤维素相比,细菌纤维素具有高纯度、精细的纳米三维网状结构,良好的生物相容性,极高的结晶度和拉伸强度。但是作为组织修复支架,细菌纤维素纳米级的小孔径不利于细胞的迁移长入,进而限制了其进一步应用[2-5]。基于此,将细菌纤维素通过机械打碎制备成亚三维结构的纳米纤维束,然后将一定浓度的SF溶液与BCNRs混合,通过搅拌剪切将溶液混合均匀,经冷冻干燥可制备成力学性能显著增强的SF/BCNRs复合支架。本文通过研究复合支架的微观结构和两相之间的界面结构的变化,为了解BCNRs增强SF复合支架的机理奠定基础。
1 试 验
1.1 原料
家蚕茧,浙江省桐乡县;细菌纤维素,海南省椰国食品有限公司;碳酸钠,分析纯,国药集团化学试剂有限公司;溴化锂,分析纯,上海市中锂实业有限公司;透析袋,截留分子量14 000±2 000,上海市源聚生物科技有限公司。
1.2 SF溶液的制备
将家蚕茧剪开后剥成薄片状,放于煮沸的质量分数为0.5%的NaCO3溶液中30 min脱胶,然后用去离子水洗净,之后再重复上述操作一次以确保脱胶干净,最后风干备用。配制9 mol/L的溴化锂溶液,恒温水浴40 ℃下溶解脱胶丝,随后离心、过滤,使用去离子水透析三天,最后将SF溶液浓缩到质量分数为12%。
1.3 BCNRs的制备
将细菌纤维素块体用0.5%的NaCO3溶液煮沸30 min以除去内部的菌体,然后用去离子水清洗浸泡至中性,用均质机(T18DS25,德国IKA公司)在10 000 r/min下将细菌纤维素块体破碎制备成均匀的BCNRs悬浮液,然后冷冻干燥制备成干态的BCNRs。
1.4 复合支架的制备
将浓度为12%的SF溶液和BCNRs按照10∶1的质量比混合,然后通过磁力搅拌器在1 000 r/min下将BCNRs均匀分散在SF溶液中(该溶液简记为S1),在-25 ℃下预冷6 h,而后在-80 ℃下冷冻6 h,最后将冻实的溶液放在冷冻干燥机(FD-1A-50,北京博医康实验仪器有限公司)中处理24 h即得到所需要的支架(简记为S1支架)。未加BCNRs的纯SF溶液(该溶液简记为S0)按照上面的步骤也做成支架(简记为S0支架)作为空白对照。
1.5 分析测试
透射电镜(TEM)测试:将均质好的BCNRs用去离子水稀释至0.01 mg/ml,超声30 min使其在水中分散均匀,然后吸取少量溶液用铜网接收后在室温下烘干。采用日本电子株式会社的JEM-2100型透射电镜进行观察。使用Nano Measurer 1.2软件测量BCNRs的直径分布。
扫描电镜(SEM)测试:将冷冻干燥制备的SF/BCNRs复合支架放于体积分数为90%的乙醇中浸泡6 h以提高支架在水中的不溶性。烘干后将支架放在液氮中淬断,然后喷金处理,使用日本电子株式会社的JSM-5600LV型环境扫描电镜观察支架的断面微观形貌。
小角X-射线散射(SAXS)测试:在上海同步辐射光源小角散射线站(BL16B1)进行SAXS测试,X-射线的波长和光斑大小分别为0.124 nm和1 mm×1 mm,探测器的型号为Rayonix165型。静态测试时直接将少许溶液滴在表面包覆Kapton的金属垫圈里,然后将其置于样品测试架上进行测试。采用光学流变剪切台(Cryo-CSS450,英国Linkam科学仪器公司)进行溶液的原位剪切,曝光时间为30 s,每100 s采集一次数据,总剪切时间为600 s,样品到探测器的距离为5 003 mm,剪切速率为2 s-1。以去离子水的散射数据作为背景散射扣除背景,使用FIT2D软件进行数据处理。
2 结果与讨论
2.1 BCNRs的形貌
图1、图2为细菌纤维素纳米纤维素束形貌和直径统计。

图1 细菌纤维素纳米纤维素束形貌
细菌纤维素是一种具有精细三维网状结构的纳米纤维素,在均质机的高速剪切下其三维结构被破坏,形成一种具有亚三维结构的纳米束,如图1所示。从图2 BCNRs的直径分布直方图可以看到,其直径绝大多数分布在20~45 nm之间,分布范围较窄,而且从TEM图像中也可以观察到,BCNRs有枝杈状结构,这种枝杈结构相比于纤维短纤更有利于SF支架的增强。
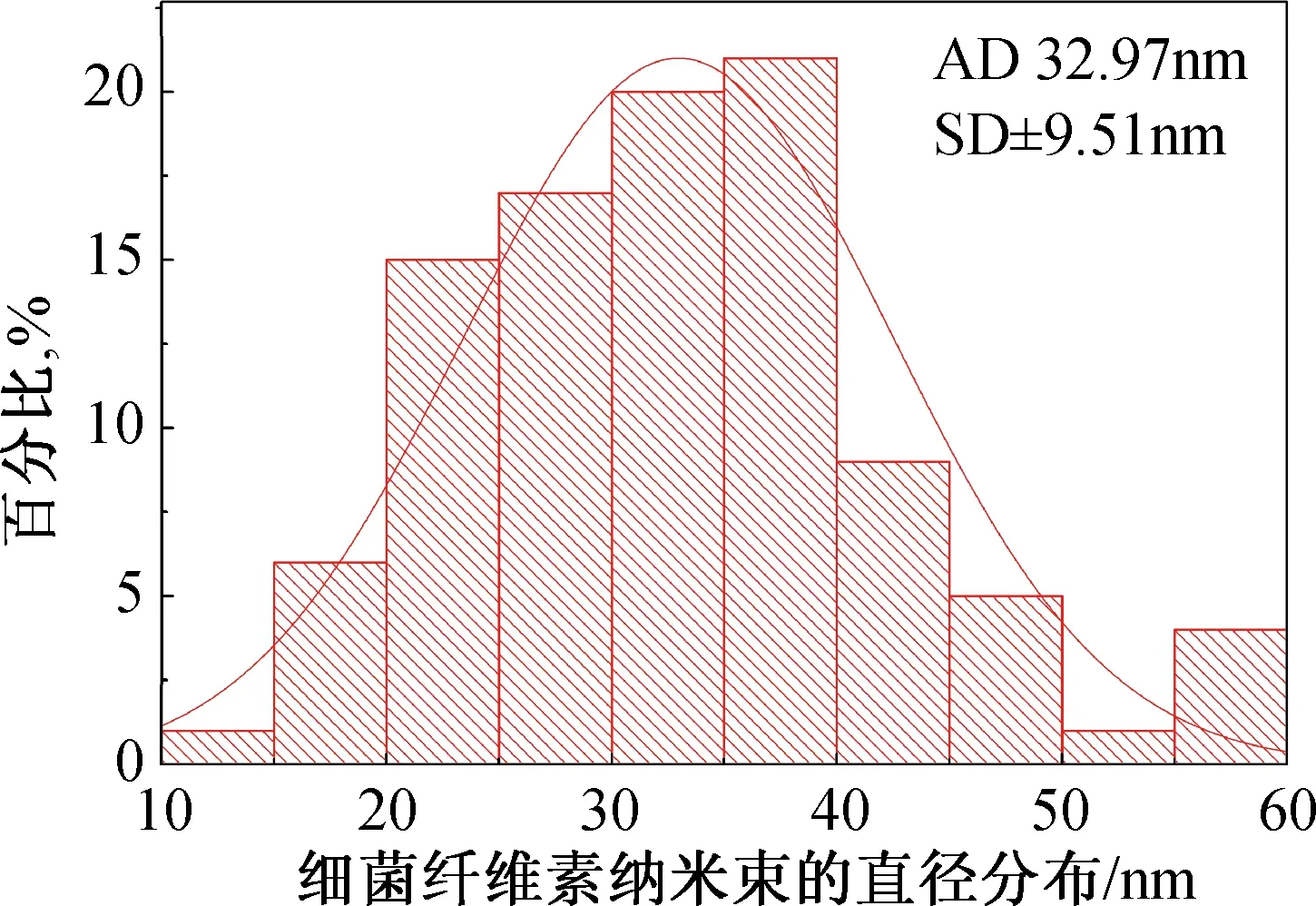
图2 细菌纤维素纳米纤维素束直径统计
2.2 支架的微观形貌
图3为SF/BCNRs复合支架的SEM图。

图3 SF/BCNRs支架的SEM图
从SEM图片可以看出,纯的SF支架与加有BCNRs的复合支架都具有相似的片层结构,但是后者在片层之间形成了一道道“桥梁”连接。这种结构加强了片层之间的稳固性,防止材料在受力时出现应力集中,从而提高了支架的机械强度。而且这种结构直接增多了支架的可粘附位点,有利于接种细胞在支架上的迁移生长[6]。
2.3 SF/BCNRs混合溶液的界面相和聚集体结构分析
复合支架机械强度的大小很大程度上取决于两相界面的结合情况[7]。界面相是指连接SF与BCNRs的中间过渡区域,其对于复合材料的机械性能具有显著的影响[8]。如果复合支架的界面结合的越好,其机械强度越高。在制备支架的过程中,为了将BCNRs与SF溶液混合均匀,实验过程中采用了机械搅拌剪切对混合溶液进行处理。因此,有必要研究在剪切作用下SF/BCNRs混合溶液的界面相变化情况。
图4为SF/BCNRs溶液在剪切条件下的SAXS图、界面厚度和均方旋转半径。
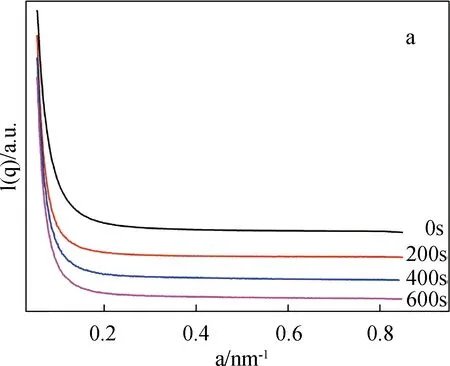
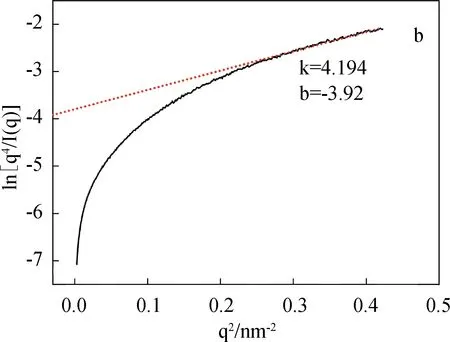




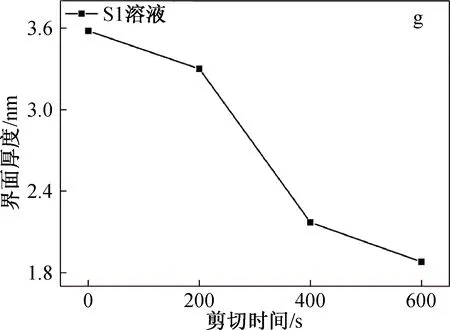
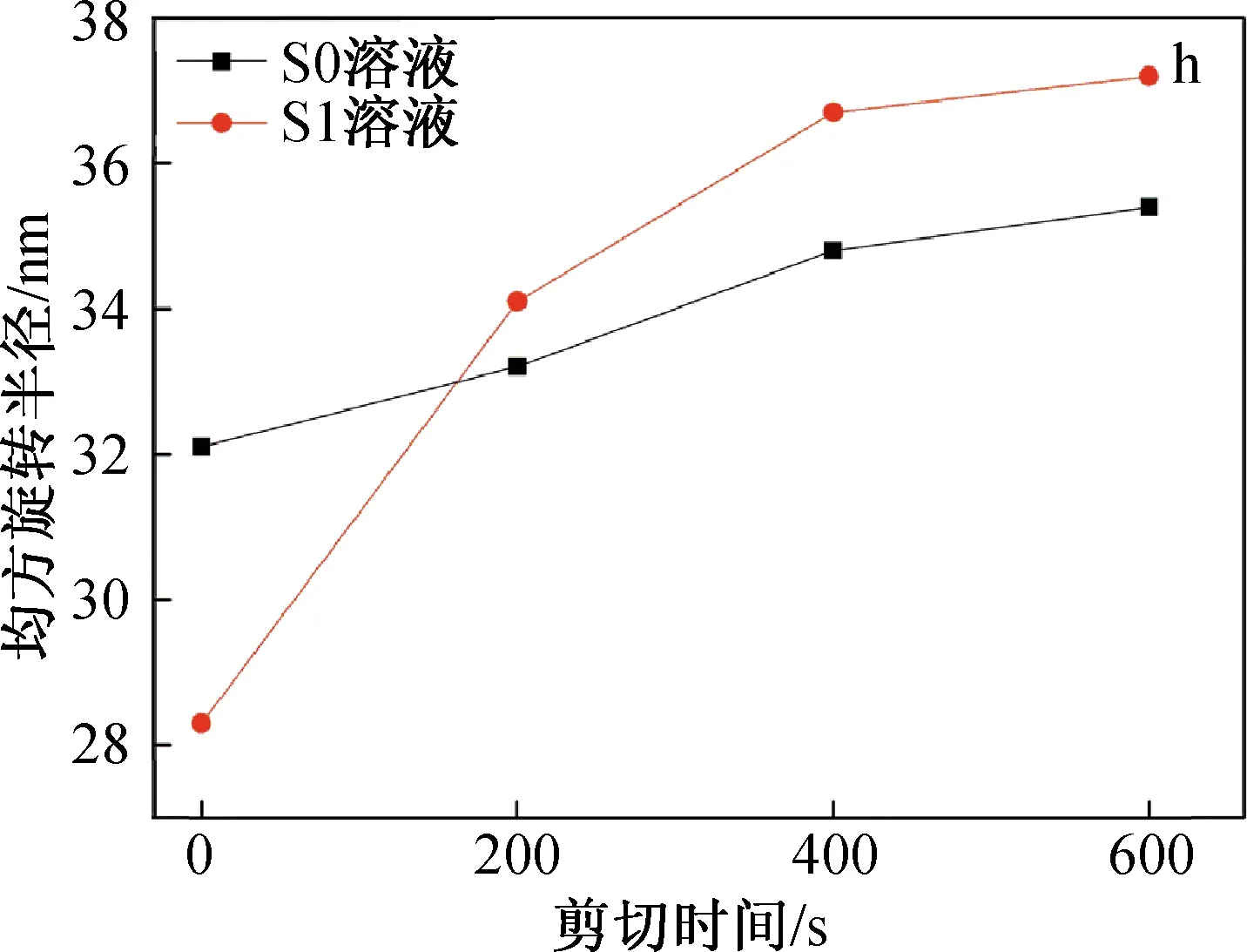
图4 SF/BCNRs溶液在剪切条件下的SAXS图、界面厚度和均方旋转半径
从S1溶液的二维SAXS图(c)可以看出,在未剪切之前溶液表现出明显的各向同性,随着剪切作用的发生,从(d)~(f)谱图中可以看到溶液的各向异性开始显现出来。根据Porod公式,将(a)中0 s剪切的一维SAXS曲线计算得到图4(b)的ln[q4I(q)]-q2曲线,再通过线性拟合得到图4(b)中的红色曲线,则S1溶液的界面厚度ΔR(图4(g))可由经验公式求得[9-11]:
式中k为拟合直线的斜率,b为拟合直线在Y轴的截距(取绝对值)。
从图4(g)可以看到,溶液S1的界面厚度介于1.8~3.6 nm之间,随着剪切时间的进行逐渐减小。但是相比于剪切的初始阶段0~200 s,在200~400 s时S1溶液的界面厚度出现大幅度下降。这可能是由于在剪切的初始阶段,剪切作用可极大地促使两相均匀混合和接触,SF高分子链上的羟基,氨基和羧基与BCNRs上的大量羟基产生强烈的氢键作用[12],这使得两相之间的界面厚度下降不多。随着剪切的进一步进行,高强度的剪切作用使SF开始变性,SF分子链开始从BCNRs表面剥离,界面厚度急剧下降。虽然剪切作用对于两相界面有一定的破坏作用,但可使两相混合更加均匀,从而减少所得支架的界面缺陷。因此,混合溶液的最佳搅拌时间为200 s左右。
SF的均方旋转半径(Rg)可以使用Guinier公式通过外推法得到,如图4(h)所示。由图可知,Rg随着剪切时间的增加而增加,这表明SF对于外界的机械扰动比较敏感,在剪切的作用下极易自组装成较大尺寸的聚集体。
图5为不同剪切时间下S0/S1溶液的三维聚集结构模拟图。(a~c)和(d~f)是由DAMMIN(ATSAS 5.3)与Pymol (Schrodinger 2009-2010)软件模拟S1和S0溶液在不同剪切时间得到的聚集体结构[13]。
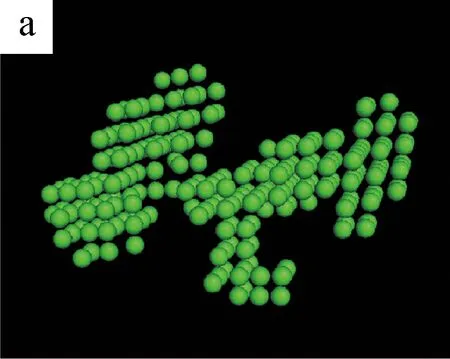
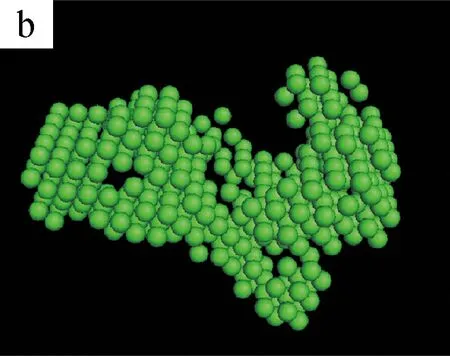
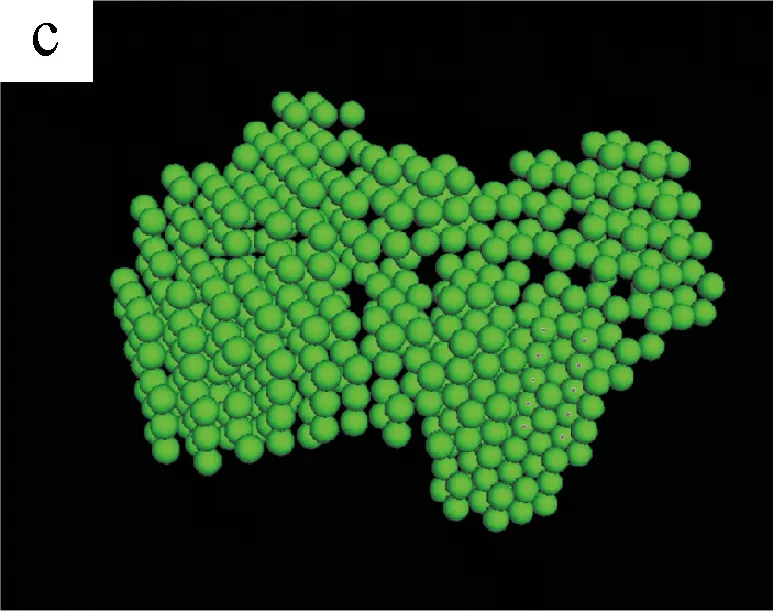
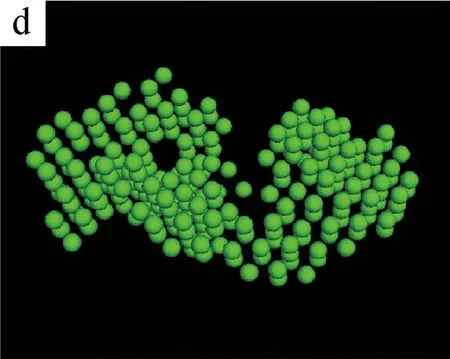
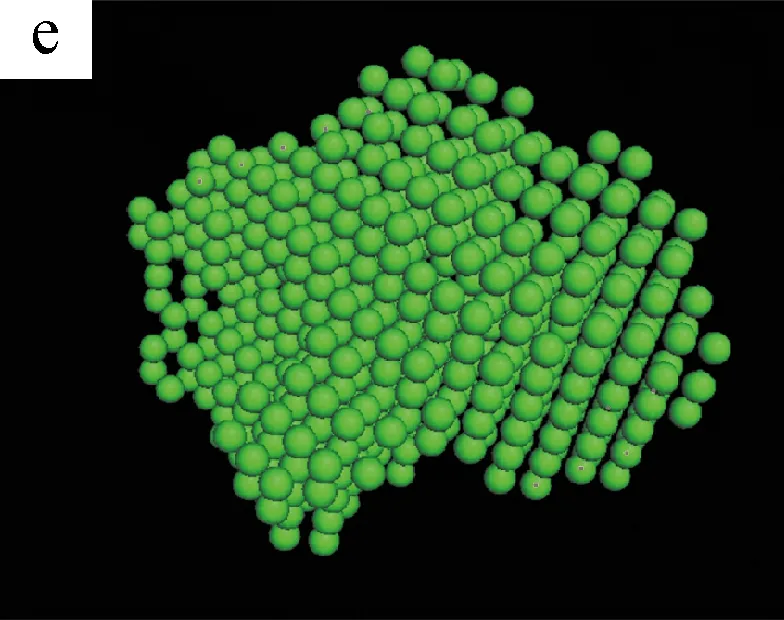
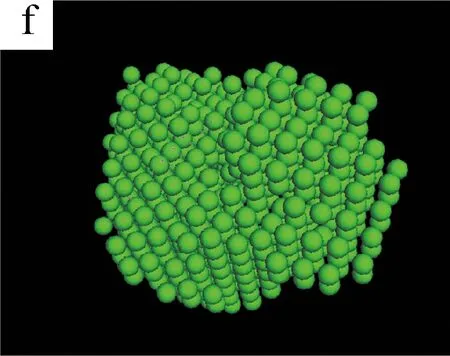
图5 不同剪切时间下S0/S1溶液的三维聚集结构模拟图
从(a)和(d)可以看出,无剪切条件下,纯SF溶液S0和加入BCNRs的混合溶液S1的聚集体结构都是杂乱且无序的。当剪切时间为400 s时,两种溶液的聚集体结构开始变得密实,但有显著的区别:S0溶液的聚集态结构呈圆球状,而S1溶液的聚集态结构呈棒状。这可能是因为SF分子链是以BCNRs为晶核进行聚集的,SF通过氢键作用包覆在棒状的BCNRs的表面,从而形成棒状聚集体结构;而S0溶液中的SF分子链在剪切作用下自组装成类似球状聚集体结构[14]。
3 结 论
a) 细菌纤维素纳米束穿插在片层之间加固了片层之间牢固度,限制了支架在受力时片层之间的滑脱,同时起到分散应力的作用,防止应力集中导致的材料破坏失效。
b) 剪切作用对于SF/BCNRs溶液的界面厚度具有一定的破坏作用,但可以促进SF聚集体尺寸的增大,有利于SF与BCNRs两相之间的均匀混合。在剪切时间为200 s时,BCNRs可以很好地分散于SF溶液中,并与其形成较好的界面结构,有利于复合支架力学性能的提高。
[1] Pan H, Zhang Y, Shao H, et al. Nanoconfined crystallites toughen artificial silk [J]. Jmaterchemb, 2014, 2(10): 1408-1414.
[2] Na Y, Stilwell M D, Santos T M A, et al. Agarose particle-templated porous bacterial cellulose and its application in cartilage growth in vitro [J]. Acta Biomaterialia, 2014, 12(1): 129-138.
[3] Ul-islam M, Khan T, Park J K. Water holding and release properties of bacterial cellulose obtained by in situ and ex situ modification [J]. Carbohydrate Polymers, 2012, 88(2): 596-603.
[4] Backdahl H, Esguerra M, Delbro D, et al. Engineering microporosity in bacterial cellulose scaffolds [J]. Journal of Tissue Engineering & Regenerative Medicine, 2008, 2(6): 320-330.
[5] Chen X, Yuan F, Zhang H, et al. Recent approaches and future prospects of bacterial cellulose-based electroconductive materials [J]. Journal of Materials Science, 2016, 51(12): 5573-5588.
[6] Chang B S, Lee C K, Hong K S, et al. Osteoconduction at porous hydroxyapatite with various pore configurations [J]. Biomaterials, 2000, 21(12): 1291-1298.
[7] Wang G, Chen G, Wei Z, et al. A comparative study of TiO2and surface-treated TiO2nanoparticles on thermal and mechanical properties of poly(ε-caprolactone) nanocomposites [J]. Journal of Applied Polymer Science, 2012, 125(5): 3871-3879.
[8] Fossey S A, Tripathy S. Atomistic modeling of interphases in spider silk fibers [J]. International Journal of Biological Macromolecules, 1999, 24(2-3): 119-125.
[9] Martel A, Burghammer M, Davies R J, et al. Thermal behavior of Bombyx mori silk: evolution of crystalline parameters, molecular structure, and mechanical properties [J]. Biomacromolecules, 2007, 8(11): 3548-3556.
[10] Miller L D, Putthanarat S, Eby R K, et al. Investigation of the nanofibrillar morphology in silk fibers by small angle X-ray scattering and atomic force microscopy☆[J]. International Journal of Biological Macromolecules, 1999, 24(24): 159-165.
[11] 朱育平.小角射线散射-理论、测试、计算及应用[M].北京:化学工业出版社, 2008:112.
[12] Park D J, Choi Y, Heo S, et al. Bacterial cellulose nanocrystals-embedded silk nanofibers [J]. Journal of Nanoscience & Nanotechnology, 2012, 12(7): 6139-6144.
[13] Jin Y, Hang Y, Peng Q, et al. Influence of shear on the structures and properties of regenerated silk fibroin aqueous solutions [J]. Rsc Advances, 2015, 5(77): 62936-62940.
[14] 张冰. 含纳米纤维样组份的丝素多孔材料的研究[D].苏州大学, 2011.
Interface of bacterial cellulose nanoribbon reinforced silk fibroin system
Chen Jian,Zhang Chao, Shao Huili, Hu Xuechao, Zhang Yaopeng*
(StateKeyLaboratoryforModificationofChemicalFibersandPolymerMaterials,ColleteofMaterialsScienceandEngineering,DonghuaUniversity,Shanghai201620,China)
Bacterial cellulose nanoribbons (BCNRs) reinforced silk fibroin composite scaffolds with intercalation structure were prepared by lyophilization. The interface structure of the BCNRs/silk fibroin solution were studied by synchrotron radiation small angle X-ray scattering. Interface thickness and mean square radius of gyration were calculated, and the 3D structure was simulated to investigate the reinforcement mechanism from microscale.
silk fibroin; bacterial cellulose; nanofiber; SAXS; microstructure; phase interface
2016-11-18
国家自然科学基金(21674018),中央高校基本科研业务费专项资金,东华大学励志计划( A201302),上海市曙光人才计划(15SG30)。
陈建(1991-),山东泰安人,在读硕士研究生,研究方向为生物质材料的加工和制备。
TQ352.1
A
1006-334X(2016)04-0013-04
*通讯作者:张耀鹏,zyp@dhu.edu.cn。
