氧化石墨烯对L-色氨酸荧光猝灭及机理研究
2017-01-07弓巧娟王永东杨海英原梅妮
弓巧娟, 王永东, 杨海英, 原梅妮
(1.运城学院 应用化学系,山西 运城044000;2.山西大学 化学化工学院,山西 太原030006;3.中北大学 机电工程学院,山西 太原030051)
氧化石墨烯对L-色氨酸荧光猝灭及机理研究
弓巧娟1,2, 王永东2, 杨海英1, 原梅妮3
(1.运城学院 应用化学系,山西 运城044000;2.山西大学 化学化工学院,山西 太原030006;3.中北大学 机电工程学院,山西 太原030051)
采用改进的Hummers 法制备氧化石墨烯,并用红外、拉曼光谱和扫描电镜等手段对氧化石墨烯的结构及形貌进行表征,考察了不同溶剂对L-色氨酸荧光光谱的影响;分别以L-色氨酸、氧化石墨烯为荧光剂和荧光猝灭剂,借助荧光光谱法研究了氧化石墨烯对L-色氨酸的荧光猝灭作用。根据紫外吸收光谱、Stern-Volmer 方程和Lineweawer-Burk 双倒数曲线方程,得出了氧化石墨烯对L-色氨酸荧光猝灭类型、猝灭速率常数(kq)和结合常数(K)等参数。结果表明,氧化石墨烯对L-色氨酸的荧光有较强的猝灭作用,其荧光猝灭机理是氧化石墨烯与L-色氨酸形成复合物的静态猝灭。
氧化石墨烯; L-色氨酸; 荧光猝灭
1 前言
石墨烯自发现以来,其优良的机械性能、热学性质、电学性质及化学性能引起了科技工作者极大关注[1,2]。基于这些优良的性能,石墨烯在超级电容器、电化学传感器、场效应晶体管、储能等领域有较广泛的研究[3-5]。
由于石墨烯在水中的分散性差和易团聚等缺点,有关氧化石墨烯的研究有大量报道。氧化石墨烯(GO)是石墨烯的前驱物,主要由石墨经氧化剥离制得,是一种重要的石墨烯衍生物,其一般结构见图1。GO表面含有大量环氧基、羟基和羧基等含氧亲水基团,易在水中形成稳定的分散液[6],进而扩大了其应用范围。

图 1 氧化石墨烯结构Scheme 1 Structure illustration of GO.
L-色氨酸(L- tryptophan,L-Trp)又名α-氨基-β-吲哚丙酸(图2),是人和动物必不可少的8种氨基酸之一,被称为第二必需氨基酸,同时,L-Trp也是一种高效的荧光物质,具有很强的荧光强度。目前,GO对量子点和荧光染料的猝灭行为研究已有报道,Swathi[7]报道了氧化石墨烯猝灭染料分子的荧光;高原等研究小组[8]研究发现,GO通过荧光能量共振转移和非辐射偶极-偶极相互作用有效猝灭量子点的荧光;翟秋阁[9]发现GO对带正电荷的荧光染料亚甲基蓝有荧光猝灭作用,加入Bi3+可使体系的荧光增强,从而可灵敏测定Bi3+,检出限为1×10-8mol·L-1;Huang[10]等将适体固定于荧光KGdF4纳米粒子上,利用GO作为荧光猝灭剂,灵敏的测定了蓖麻蛋白,检出限为8 pg·mL-1,Ji[11]等将GO作为荧光猝灭剂,可使荧光标记的探针DNA荧光猝灭,目标DNA与探针DNA形成双链DNA后从GO表面脱落,荧光得以恢复,从而灵敏的检测了去甲基化酶;Shi[12]等通过GO与多肽的荧光共振能量转移超灵敏的检测了肉毒神经毒素。Huang[13]等采用GO猝灭钌配合物电致发光标记的发夹探针定量检测DNA。GO对L-Trp的荧光猝灭及其猝灭机理研究尚未报道。

图 2 L-色氨酸的分子结构Scheme 2 Molecular structure of L-tryptophan.
本文利用Hummers法合成了GO,研究GO对L-Trp的荧光猝灭效应,并得出GO猝灭L-Trp荧光的猝灭速率常数(kq)、结合常数(K),进一步研究了荧光猝灭形态机制。由于许多蛋白质含有色氨酸残基[14,15],具有内源荧光,进行GO与L-Trp的荧光猝灭效应的研究,对GO与生物分子相互作用研究具有重要的现实意义。
2 实验
2.1 仪器与试剂
F4600荧光分光光度计(日本日立公司);Cary5000紫外可见分光光度计(美国安捷伦公司);PHS-3C型pH计(上海大普公司);JEM-2010HR 200 kV 透射电子显微镜(日本电子株式会社);显微共焦拉曼光谱仪(英国雷尼绍公司)。
石墨粉(上海试剂厂);二甲基亚砜(DMSO)、硝酸钠、高锰酸钾、双氧水(分析纯,天津瑞金特化学品公司);L-色氨酸(上海生工生物公司)。
2.2 氧化石墨的制备
采用改进的Hummers方法制备氧化石墨[16]。
2.3 氧化石墨的表征及对L-Trp的荧光猝灭
采用英国雷尼绍公司的inVia显微共焦拉曼光谱仪对GO结构进行分析;采用德国布鲁克公司的TENSOR27型傅里叶变换红外谱仪对GO表面官能团进行定性分析;采用JEM-2010HR 200 kV 透射电子显微镜对GO的形貌及片层进行表征。
将氧化石墨超声分散在蒸馏水中,得到GO悬浮液,用DMSO作为L-Trp的研究GO对L-Trp的荧光猝灭效应。
3 结果与讨论
3.1 氧化石墨烯的表征



图3 石墨与氧化石墨烯的(a)红外光谱与(b)拉曼光谱Fig. 3 (a) FT-IR spectra, (b) Raman spectra of graphite and GO.
由图4a可以看出,GO为不规则片状半透明结构,表面有微米级褶皱,平面结构使其上下面均可接触目标分子,有效提高反应效率。图4b为GO的水溶液,可以看出,GO在水溶液中呈典型的棕黄色,且在水中分散较好,说明成功制备了GO。

图 4 GO的(a)透射电镜照片和(b)水溶液中的分散效果照片Fig. 4 (a) TEM image of GO and (b) dispersion effect diagram(a′-d′ GO concentration: 0.2, 0.1, 0.05, 0.01 mg·mL-1).
3.2 荧光光谱分析
3.2.1 溶剂对L-Trp荧光光谱的影响
分别以水和DMSO作为L-Trp溶剂,研究了L-Trp在不同溶剂中的荧光效应。以279 nm为激发波长测定不同浓度下L-Trp的荧光强度,从图5a、5b可见,L-Trp在两种溶液中均有较强的荧光。随着溶液中L-Trp浓度的增加,其荧光强度均显著增加。在浓度相同的情况下,L-Trp在DMSO中的荧光强度较以水做溶剂的荧光强度高5倍左右,作为对照,测定了DMSO在λex=279 nm,λem=360 nm下的荧光光谱,发现给定条件下,DMSO无明显荧光,说明DMSO对L-Trp有荧光增强效应,这是由于L-Trp及其衍生物的发光特性具有很强的微环境依赖性,其在溶液中的荧光强度取决于溶剂的极性、粘度以及激发波长,L-Trp溶于DMSO后,二者之间的基团发生了相互作用,从而增强了L-Trp的荧光强度[17]。
3.2.2 GO对L-Trp荧光光谱的影响
由图6可知,在加入GO之前,L-Trp在279 nm光激发下,其荧光发射峰在360 nm处(a曲线),当L-Trp的浓度为2×10-5mol·L-1时,其荧光强度F=1019,固定L-Trp浓度不变,当向L-Trp溶液中加入GO溶液后,L-Trp的荧光被极大的猝灭,但发射峰形及峰位变化不大,随着GO浓度的增大,荧光强度逐渐减小,猝灭效率逐渐增大,L-Trp荧光的显著猝灭,表明二者之间发生了较强烈的相互作用。

图 5 L-Trp在(a)二甲基亚砜(DMSO)与(b)水溶液中的荧光光谱图Fig. 5 The fluorescence of L-Trp in (a) DMSO and (b) H2O (a-f: 1×10-4, 5×10-5, 4×10-5, 3×10-5, 2×10-5, 1×10-5 mol·L-1, λex=279 nm, λem=360 nm).
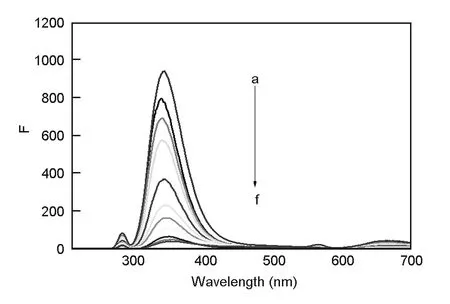
图 6 不同浓度GO对L-Trp荧光发射光谱的影响Fig. 6 Effects of concentrations of GO on fluorescence emission spectra of L-Trp. GO concentration a-f: 0, 0.5×10-5, 1×10-5, 2×10-5, 4×10-5, 6×10-5, 8×10-5, 10×10-5, 12×10-5, 14×10-5, 16×10-5 g·mL-1, L-Trp concentration: 2×10-5 mol·L-1,λex=279 nm, λem=360 nm.
荧光猝灭主要可分为两种类型,即动态猝灭和静态猝灭[18]。动态猝灭是猝灭剂与激发态荧光分子之间发生碰撞而使荧光分子的荧光消失;静态猝灭是荧光分子与猝灭剂形成复合物而使荧光消失。由紫外吸收光谱分析,发生动态猝灭时吸收光谱不发生变化,而发生静态猝灭时吸收光谱发生变化[19],从图7的紫外吸收光谱曲线发现,GO与L-Trp相互作用后,L-Trp在279 nm处的吸光度显著增强,而且峰形变宽,可能是由于带正电荷的L-Trp通过静电引力和π-π作用吸附在GO表面,形成了GO-L-Trp复合物,从而使荧光猝灭,由猝灭后的吸收光谱发生变化,可初步推断GO对L-Trp的荧光猝灭属于静态猝灭。

图 7 (a)GO, (b)L-Trp, (c)GO/L-Trp紫外吸收光谱Fig. 7 UV spectra of (a) GO, (b) L-Trp and (c) GO/L-Trp.
要具体判定一种猝灭反应属于静态猝灭还是动态猝灭,需要计算出猝灭剂与荧光物质之间的动态荧光猝灭速率常数(kq)、 结合常数(K)等。若GO对L-Trp的猝灭过程是由于分子之间碰撞所引起的动态猝灭,应符合Stern-Volmer方程[20,21]:
F0/F=1+kqτ0[Q]=1+Ksv[Q]
(1)
式(1) 中,F0为未加入猝灭剂时的荧光强度,F为加入猝灭剂后的荧光强度,[Q] 为猝灭剂浓度,g·mL-1,τ0为猝灭剂不存在时荧光分子平均寿命,根据文献报道,对于一般生物分子来说,其τ0= 10- 8s,kq为动态荧光猝灭速率常数,mL·(g·s)-1,Ksv为Sterm-Volmer动态猝灭常数,其中:
Ksv=kqτ0
(2)
根据不同温度下L-Trp荧光猝灭光谱,可得F0/F-[Q]的Stern-Volmer 关系图(图8)。

图 8 GO对L-Trp 荧光猝灭的Stern-Volmer 图Fig. 8 Stern-Volmer figure of GO on fluorescence quenching to L-Trp.
若该猝灭过程为彼此之间形成复合物的静态猝灭,应符合Lineweaver-Burk 方程[17- 18]
(F0-F)-1=F0-1+K-1F0-1[Q]-1
(3)
式(3)中K为GO与L-Trp结合常数。
根据不同温度下L-Trp荧光猝灭光谱,可得(F0-F)-1-[Q]-1Lineweaver-Burk 关系图,见图9。
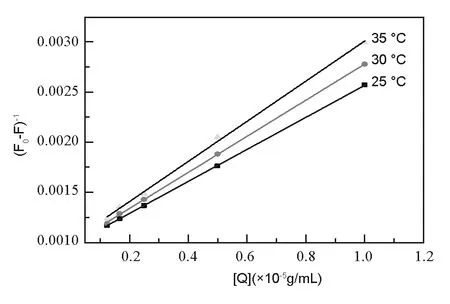
图 9 GO对L-Trp荧光猝灭的Lineweaver-Burk 图Fig. 9 Lineweaver-Burk figure of GO on fluorescence quenching to L-Trp.表 1 不同温度下GO与L-Trp相互作用常数Table 1 Interaction constants of GO and L-Trp at different temperatures.

t(℃)kSV(mL·g-1)kq(mL·(g·s)-1)r(Stern⁃Volmer)k(mL·g-1)r(Lineweaver⁃Burk)256.65×1046.65×10120.99822.03×1050.9978305.74×1045.74×10120.99411.83×1050.9998355.17×1045.17×10120.99771.63×1050.9998
由图8、9可看出,F0/F与[Q]及(F0-F)-1与[Q]-1线性关系良好。由图8、9 及式(1)、(2)、(3)可分别得出不同温度下GO与L-Trp相互作用的Ksv、kq和K值(表1)。
当猝灭过程为动态猝灭时,温度升高,分子活化能增大,增加了猝灭剂和荧光分子之间的有效碰撞,从而使猝灭速率加快,kq、Ksv均增大( Stern-Volmer 直线斜率增大),且最大散射碰撞猝灭速率常数为2.0×1010L·( mol·s)- 1[22]。而对于静态猝灭,是由于猝灭剂和荧光分子之间发生非辐射能量转移而生成不发荧光的复合物。温度升高,导致复合物稳定性下降,K值减小( Lineweaver-Burk直线斜率增大)。
由图8、9 和表1 可知, 随温度升高, Stern-Volmer 图直线斜率逐渐减小,kq和Ksv值均减小,在本实验中猝灭剂GO的单位为g·mL-1,由前文GO的基本结构单元可知,GO的式量远大于1 000 g·mol-1,故其荧光猝灭速率常数kq值远大于动态猝灭中的最大散射碰撞猝灭速率常数2.0×1010L·(mol·s)- 1, 这表明GO对L-Trp的荧光猝灭不是由碰撞所引起的动态猝灭。Lineweaver Burk 图直线斜率增大,K值减小,该荧光猝灭与Lineweaver Burk方程相吻合,由图8和图9可知,GO对L-Trp的荧光猝灭不是由碰撞所引起的动态猝灭, 而是由于形成复合物所引起的静态猝灭。从表1 可看出, GO和L-Trp的结合常数K值较大, 说明 GO与L-Trp所形成的复合物十分稳定。另外,由GO的红外光谱图可知,GO结构中含有大量的羟基、羧基等含氧官能团,L-Trp中的氨基与GO中的羧基可部分发生酰胺缩合反应,L-Trp、GO分子中的氨基、羟基等可以相互作用形成氢键,再加上二者分子间的静电吸引作用以及范德华力的作用,使两种分子可以紧密结合,形成稳定的复合物。
3.3 实验条件对荧光猝灭的影响
3.3.1 反应时间对荧光猝灭的影响
为了考察实验条件的变化对荧光猝灭的影响,在实验中考察了反应条件对荧光猝灭效应的影响。图10显示了GO与L-Trp经不同反应时间后的荧光强度变化值,当GO与L-Trp相互作用后,其荧光强度瞬间达到最低值,继续增加反应时间,其荧光信号强度基本保持不变,因此在实验过程中待二者混合均匀后即可检测其荧光强度。
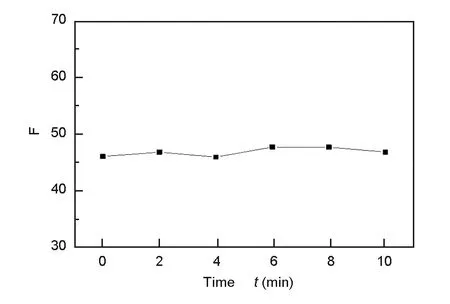
图 10 反应时间对荧光猝灭的影响Fig. 10 Effect of reaction time on the fluorescence quenching.
3.3.2 反应温度对荧光猝灭的影响
实验过程中还探究了不同反应温度对荧光猝灭效应的影响,其结果如图11所示,随着温度的升高,猝灭效率逐渐减小,反应后的荧光强度逐渐增大,说明随着温度的升高,不利于GO与L-Trp形成复合物,这一结果与上述Stern-Volmer、Lineweaver Burk方程讨论的结果相一致,更进一步说明此荧光猝灭属于静态猝灭。

图 11 反应温度对荧光猝灭的影响Fig. 11 Effect of reaction temperature on the fluorescence quenching.
4 结论
基于Hummers 法制备氧化石墨,经超声剥离制得GO,将GO作为荧光猝灭剂,考察了其对L-Trp的猝灭效率,实验结果表明,GO能有效的猝灭L-Trp的荧光,当L-Trp的浓度为2×10-5mol·L-1,GO浓度为16×10-5g·mL-1时,猝灭效率为95.6%,且猝灭所用时间较短,几乎可以在瞬间将其荧光猝灭。其猝灭机理为静态猝灭,作用过程中两者发生了非辐射能量转移,形成了复合物,且结合常数较大,说明GO对L-Trp的作用非常牢固。本文对GO与L-Trp之间的相互作用研究,可为石墨烯材料在生物及其相关领域的应用提供重要的参考数据。
[1] Song Y J, Qu K G, Zhao C, et al. Graphene oxide: Intrinic peroxidase catalytic activity and its application to glucose detection[J]. Advanced Materials, 2010, 22, 2206-2210.
[2] Guo S J, Dong S J. Graphene nanosheet: Synthesis, molecular engineering, thin film, Hybrids, and energy and analytical applications[J]. Chemical Society Reviews, 2011, 40, (5), 2644-2672.
[3] LI Chen, ZHANG Xiong, WANG Kai, et al. Three dimensional graphene networks for supercapacitor electrode materials[J]. New Carbon Materials, 2015, 30 (3): 193-206.
[4] Yang W R, Ratinac K R, Ringer S P, et al. Carbon nanomaterials in biosensors:should you use nanotubes or graphene[J]. Angewandte Chemie International Edition, 2010, 49(12): 2114-2138.
[5] WANG Xu-zhen, LIU Ning, HU Han, et al. Fabrication of three-dimensional MoS2-graphene hybrid monoliths and their catalytic performance for hydride sulfurization[J]. New Carbon Materials, 2014, 29(2): 81-88.
[6] Han X W, Fang X, Shi A Q, et al. An electrochemical DNA biosensor based on gold nanorods decorated graphene oxide sheets for sensing platform[J]. Anaytical Biochemistry, 2013, 443(2): 117 -123.
[7] Swathi R S, Sebastian K L. Distance dependence of fluorescence resonance energy transfer[J]. Journal of Chemical Sciences, 2009, 121, 777-787.
[8] 高 原, 李 艳, 苏星光. 基于石墨烯的光学生物传感器的研究进展[J]. 分析化学, 2013, 441(2): 174-180. (GAO Yuan, LI Yan, SU Xing-guang. Development of graphene-based optical biosensor[J]. Chinese Journal of Analytical Chemistry, 2013, 441(2): 174-180.)
[9] 翟秋阁, 郭 鹏, 周 琳, 等. 氧化石墨烯-亚甲基蓝体系荧光光度法灵敏测定铋(Ⅲ)离子[J]. 光谱学与光谱分析, 2014, 8: 2152-2156. (ZHAI Qiu-ge, GUO Peng, ZHOU Lin, et al. Sensitive determination of Bi3+by spectrofluorimetry based on graphene oxide-methylene blue system[J]. Spectrescopy and Spectral Analysis, 2014, 8: 2152-2156.)
[10] Huang Y K, Chen X J, Wu S J, et al. Homogeneous time-resolved fluorescence assay for the detection of ricin using an aptamer immobilized on europium-doped KGdF4nanoparticles and graphene oxide as a quencher[J]. Microchim Acta , 2015, 182: 1035-1043.
[11] Ji L J, Qian Y D, Wu P, et al. Fluorescence quenching of graphene oxide combined with the site-specific cleavage of restriction endonuclease for deoxyribonucleic acid demethylase activity assay[J]. Analytica Chimica Acta , 2015, 869: 74-80.
[12] Shi J Y, Guo J B, Bai G X, et al A graphene oxide based fluorescence resonance energy transfer (FRET) biosensor for ultrasensitive detection of botulinum neurotoxin A (BoNT/A) enzymatic activity[J]. Biosensors and Bioelectronics, 2015, 65: 238-244.
[13] Huang X, Huang X P, Zhang A, et al. Quenching of the electrochemiluminescence of RU-complex tagged shared-stem hairpin probes by graphene oxide and its application to quantitative turn-on detection of DNA[J]. Biosensors and Bioelectronics, 2015, 70: 441-446.
[14] Hu Y J, Liu Y, Zhao R M, et al. Spectroscopic studies on the interaction between methylene blue and bovine serum albumin[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2006, 179(3): 324-329.
[15] Zhou B, Qi Z D, Xiao Q, et al. Interaction of loratadine with serum albumins studies by fluoresence quenching method[J]. Journal of Biochemical and Biophysical Method, 2007, 70(5): 743-747.
[16] William S, Hummers J R, Richard E. Offeman. Preparation of graphitic oxide[J]. Journal of the American Chemical Society, 1958, 80(6):1339-1339.
[17] Liu H Y, Zhang H R, Jin B. Fluorescence of tryptophan in aqueous solution[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2013, 106: 54-59.
[18] 张丽娜, 陈 欣, 夏 阳, 等. 荧光光谱法研究四苯基-锌金属卟啉与蛋白质的相互作用机理[J]. 光谱学与光谱分析, 2009, 29(3), 773-776.(ZHANG Li-na, CHEN Xin, XIA Yang, et al. Study on interaction mechanism between Meso-Tetra- (4-Hydroxyphenyl)-Zn Porphyrin and Bovine Serum albumin by fluorescence method[J]. Spectroscopy and Spectral Analysis, 2009, 29(3), 773-776.)
[19] Jayaraman J, Venugopal T, Natesan S, et al. Luminescent study on the binding interaction of bioactive imidazole with bovine serum albumin-A static quenching mechanism[J]. Spectrochimica Acta Part A, 2011, 84: 233-237.
[20] Jiang M, Xie M X, Zheng D Liu Y, et al. Spectroscopic studies on the interaction of cinamic acid and its hydroxyl derivatives with human serum albumin[J]. Journal of Molecular Structure, 2004, 692(1-3): 71-80.
[21] Jiang C Q, Gao M X, He H X. Study of the interaction between terazosin and serum albumin synchronous fluorescence determination of terazosin[J]. Analytica Chimica Acta, 2002, 452(2): 185-189.
[22] 陈小睿, 徐沉思, 王 平, 等. 荧光猝灭法研究大黄酚与牛血清白蛋白的相互作用[J]. 世界科学技术. 中医药现代化, 2011, 13(6): 999-1004. (CHEN Xiao-rui, XU Chen-si, WANG Ping, et al. Investigation of interaction between chrysophanol and bovine serum albumin by fluorescence quenching method[J]. World Science and Technology/Modernization of Traditional Chinese Medicine and Materia Medica, 2011, 13(6): 999-1004.)
The mechanism of the fluorescence quenching of L-tryptophan by graphene oxide
GONG Qiao-juan1,2, WANG Yong-dong2, YANG Hai-ying1, YUAN Mei-ni3
(1.DepartmentofAppliedChemistry,YunChengUniversity,YunCheng044000,China;2.CollegeofChemistryandChemicalEngineering,ShanxiUniversity,Taiyuan030006,China;3.SchoolofMechatronicsofEngineering,NorthUniversityofChina,Taiyuan030051,China)
Graphene oxide (GO) was prepared by the modified Hummers method and used as a fluorescence quenching reagent of L-tryptophan (L-Trp). The structure of GO was characterized by FT-IR and Raman spectroscopy. The binding mechanism of L-Trp on GO and their reaction were investigated by UV spectroscopy and the fluorescence method. Results show that GO has a strong fluorescence quenching ability for L-Trp. The quenching efficiency is 95.6% for L-Trp with a concentration of 2×10-5mol·L-1when the GO concentration is 16×10-5g·mL-1. The binding constants of L-Trp on GO were 2.03×105, 1.83×105and 1.63×105mL·g-1at 25, 30 and 35 ℃, respectively, as revealed by the Lineweawer-Burk equation, indicating a strong interaction between GO and L-Trp. GO quenches the intrinsic fluorescence of L-Trp by the formation of a complex, and is a static quenching mechanism. The quenching rate constant was 6.65×1012mL·(g·s)-1at 25 ℃ as determined by the Stern-Volmer equation.
Graphene oxide; L- tryptophan; Fluorescence quench
GONG Qiao-juan, Ph. D, Professor. E-mail: gqjuan@163.com
1007-8827(2016)06-0639-07
TQ127.1+1
A
2016-06-27;
2016-10-24
山西省“131”领军人才工程项目; 山西省自然科学基金项目(2012011007-1); 运城市科技局项目(2060499).
弓巧娟, 博士, 教授. E-mail: gqjuan@163.com
Foundationitem: Financial support from the Science Foundation of “131” Leading talents project of Shanxi Province.; Science Foundation of Shanxi (2012011007-1); Science Foundation of Bureau of Science and Technology of Yuncheng(2060499).
猜你喜欢
杂志排行
新型炭材料的其它文章
- Al-Si-C改性C/C复合材料的微结构特征与烧蚀行为
- Microstructure and molten salt impregnation characteristics of a micro-fine grain graphite for use in molten salt reactors
- Rheological behavior of fresh cement pastes with a graphene oxide additive
- 含空位缺陷单壁碳纳米管断裂行为的有限元模拟
- Microstructures of carbon nanoscrolls characterized by polarized micro-Raman spectroscopy
- 纳米MnO2/膨胀石墨复合材料的制备及其电化学性能
