双水平正压通气联合珂立苏治疗晚期早产儿呼吸窘迫综合征效果观察
2017-01-06张浩王小虎
张浩,王小虎
(淄博市妇幼保健院,山东淄博255000)
双水平正压通气联合珂立苏治疗晚期早产儿呼吸窘迫综合征效果观察
张浩,王小虎
(淄博市妇幼保健院,山东淄博255000)
目的 探讨双水平正压通气(DuoPAP)联合牛肺表面活性物质珂立苏在晚期早产儿呼吸窘迫综合征(RDS)治疗中的临床应用价值。方法 选择晚期早产RDS患儿38例,随机分为DuoPAP组、经鼻持续正压通气(NCPAP)组各19例。两组均于确诊RDS后即刻采用气管插管内单次注射珂立苏70 mg/kg,然后DuoPAP组采用DuoPAP模式进行呼吸支持,NCPAP组采用NCPAP模式进行呼吸支持。比较两组治疗前及治疗12 h时动脉血气指标(包括PO2、PCO2)、氧合指数(OI)、X线胸片评分。记录治疗期间需行有创呼吸支持的患儿数、新生儿持续性肺动脉高压(PPHN)发生率、氧疗时间以及气胸、腹胀发生率。 结果 治疗后,两组PO2、OI均较治疗前升高,PCO2、X线胸片评分均较治疗前降低(P均<0.05)。治疗后DuoPAP组PO2、OI均高于NCPAP组,PCO2、X线胸片评分均低于NCPAP组(P均<0.05)。DuoPAP组行有创呼吸支持率低于NCPAP组(P<0.05)。DuoPAP组PPHN的发生率低于NCPAP组(P<0.05)。两组疗效、氧疗时间、住院时间及腹胀、气胸发生率差异均无统计学意义(P均>0.05)。结论 对于晚期早产儿RDS给予DuoPAP联合珂立苏可明显改善患儿的氧合功能,减少行有创呼吸支持的比例,且不会增加发生并发症的风险。
双水平正压通气;经鼻持续正压通气;肺表面活性物质;晚期早产儿;呼吸窘迫综合征
新生儿呼吸窘迫综合征(RDS)是因肺表面活性物质缺乏导致新生儿早期死亡的严重疾病[1],主要见于早产儿,出生后出现进行性呼吸困难、青紫和呼吸衰竭。近年来,晚期早产儿(即出生胎龄在34~36周的早产儿)RDS病例在临床上出现的越来越多,相对于胎龄小于34周的早期早产儿RDS,其表现为病情进展快、氧合差、并发症多,目前临床大多仍采取经鼻持续正压通气(NCPAP)联合肺表面活性物质的方式作为初始治疗措施。但晚期早产儿发生RDS时使用NCPAP效果并不理想,存在因支持力度不够、病情进展需使用有创呼吸支持及发生持续性肺动脉高压(PPHN)等严重并发症的问题。2015年1月~2016年1月,我们对晚期早产RDS患儿采用双水平正压通气(DuoPAP)联合肺表面活性物质珂立苏治疗,并与NCPAP联合珂立苏治疗方法进行比较,探讨DuoPAP联合珂立苏对晚期早产儿RDS的临床应用价值。现报告如下。
1 资料与方法
1.1 临床资料 选择同期我院NICU收治的晚期早产RDS患儿38例,男20例、女18例,胎龄34~36周,入院时间为出生24 h内,X线胸片评分<2分。RDS诊断标准参照《实用新生儿学》中新生儿RDS诊断依据[2]。入选标准:胎龄34~36周;入院时间为出生24 h内;经吸氧吸入氧浓度(FiO2)≥0.4仍有气促、三凹征;排除重度窒息、先天性心脏病、胎粪吸入、严重感染等引起的呼吸困难及进入NICU时即需使用有创通气的患儿。按随机表法分为DuoPAP组、NCPAP组各19例。两组患儿性别、胎龄、体质量、入院日龄、病变严重程度等差异均无统计学意义。本研究经医院伦理委员会批准,患儿家属均知情同意。
1.2 治疗方法 两组均于确诊RDS后即刻采用气管插管内单次注射珂立苏70 mg/kg,然后使用T组合复苏器加压通气5~10 min。DuoPAP组使用菲萍新生儿呼吸机,采用DuoPAP模式,初始参数吸气峰压(PIP)10~12 cmH2O,呼气末正压(PEEP)4~6 cmH2O,呼吸频率(RR) 20~30次/min,吸气时间(Ti)0.3~0.4 s,流量(Flow)8~10L/min,FiO20.3~0.45;NCPAP组使用STEPHAN CPAP呼吸机,采用CPAP模式,初始参数Flow 8~10 L/min,PEEP 4~6 cmH2O,FiO20.3~0.45。如无明显呼吸道阻塞症状,用药后4~6 h内不做吸痰操作[3]。治疗时间12 h,病情加重者(X线胸片评分>3)给予有创通气并再次给予珂立苏。
1.3 观察指标 两组患儿均于治疗前及治疗12 h时检测动脉血气指标(包括PO2、PCO2)。记录呼吸机参数,计算氧合指数(OI)=PO2/FiO2。拍摄胸片进行X线评分评价RDS进展,根据《实用新生儿学》(第四版)中对胸片标准进行分级,Ⅰ级为1分,Ⅱ级为2分,Ⅲ级为3分,Ⅳ级为4分,无RDS为0分。记录治疗期间需行有创呼吸支持的患儿数、新生儿PPHN发生数、氧疗时间以及气胸、腹胀并发症的发生率。
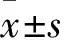
2 结果
2.1 两组治疗前后血气指标及X线胸片评分比较 治疗后,两组PO2、OI均较治疗前升高,PCO2、X线评分均较治疗前降低(P均<0.05)。治疗后DuoPAP组PO2、OI均高于NCPAP组,PCO2、X线评分均低于NCPAP组(P均<0.05)。见表1。
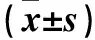
表1 两组治疗前后血气指标及X线胸片评分比较
注:与同组治疗前比较,*P<0.05;与NCPAP组治疗后比较,△P<0.05。
2.2 两组行有创通气支持率比较 DuoPAP组、NCPAP组行有创呼吸支持的例数分别为3、10例,DuoPAP组行有创呼吸支持率低于NCPAP组(P<0.05)。
2.3 两组疗效比较 DuoPAP组、NCPAP组治愈例数分别为19、16例,两组疗效差异无统计学意义(P>0.05)。DuoPAP组、NCPAP组氧疗时间分别为(6.7±1.5)、(8.2±2.1)d,住院时间分别为(10.8±1.9)、(9.2±2.3)d,两组氧疗时间、住院时间差异均无统计学意义(P均>0.05)。
2.4 两组并发症比较 DuoPAP组发生腹胀7例、PPHN 2例、气胸2例,NCPAP组分别为5、8、2例,DuoPAP组PPHN的发生率低于NCPAP组(P<0.05)。两组腹胀、气胸发生率差异均无统计学意义(P均>0.05)。
3 讨论
新生儿RDS是由于出生时或生后短期内肺泡功能不成熟,导致肺表面活性物质缺乏及肺结构不成熟所致的疾病。在最初2 d逐渐加重,如果处理不及时,可因进行性缺氧、呼吸衰竭而死亡,存活者在生后2~4 d内得以改善。管理目的是通过治疗,最大限度地提高存活率,同时将可能的风险降至最低[4]。晚期早产儿是指出生胎龄在34~36周的早产儿[5]。近年来,晚期早产儿RDS发病率呈逐年增加趋势[6]。多项研究显示,男性新生儿、产妇妊娠糖尿病、剖宫产、感染等是晚期早产儿RDS发生的高危因素[7]。晚期早产儿发生RDS时,因呼吸系统代偿能力相对较强,故RDS早期症状相对不典型,但一旦病情进展往往迅速发生严重呼吸衰竭,引起PPHN等并发症。目前临床上对晚期早产儿RDS病情发展的认识不足,大多仍采取NCPAP模式联合肺表面活性物质做为首选呼吸支持方式。NCPAP可增加功能残气量、改善肺顺应性,同时具有无创、操作简单的特点,因此在临床被广泛用于RDS患儿的初始治疗。使用足量外源性肺表面活性物质可改善晚期早产RDS患儿的氧合功能,缩短用氧和机械通气时间[8]。但临床治疗中发现,对一些晚期早产RDS患儿,在使用NCPAP及给予足量肺表面活性物质后,仍可能因支持力度不够而导致需使用有创呼吸支持,临床疗效欠佳,因此在其发病初期给予更为有效的治疗方式,对于防止发生失代偿性呼吸衰竭具有重要意义。
Duo PAP是一种新型的呼吸支持模式,其工作原理是两级CPAP水平,呼吸机上显示的PEEP就是基础CPAP压力,PIP就是间歇叠加的上限压力[9,10];RR是每分钟叠加PIP的次数,PIP/PEEP切换由时间决定,患儿可在两种压力下自由呼吸,类似于双相气道正压(BIPAP)模式[11]。在DuoPAP模式中,呼吸机会在正气道压力(PIP)和CPAP之间转换,可以设定呼吸次数及吸气时间等,使吸气和呼气时都有压力支持。研究表明,DuoPAP较NCPAP可更好地防止人机对抗和二氧化碳潴留,产生更好的呼吸支持作用[12]。在治疗新生儿RDS时,nDuo PAP在nCPAP的基础上增加一定频率的间歇正压通气,提高平均气道压,增加潮气量和分钟通气量,能有效改善低氧血症和CO2潴留[13],同时保持呼吸道的扩张状态,防止小气道塌陷,减少呼吸作功,属于nIPPV模式,治疗效果与nSIMV相似[14]。本研究显示,治疗后DuoPAP组PO2、OI均高于NCPAP组,PCO2、X线评分均低于NCPAP组,提示DuoPAP组在治疗晚期早产儿RDS时可以以更低的FiO2提高患儿PaO2,从而使患儿的氧合指数提高,促进病情转归。
有创呼吸支持是RDS患儿病情进展后的治疗手段,相对于无创模式其可能导致呼吸机相关性肺炎(VAP)、气漏等。因此在治疗RDS时行有创通气支持率是评价治疗方法有效性的重要指标。本研究发现,DuoPAP组行有创呼吸支持的发生率低于NCPAP组,提示DuoPAP联合珂立苏较NCPAP联合珂立苏可显著降低总有创呼吸支持率,从而降低感染、减少气压伤,缩短通气时间、氧疗时间及住院时间[15]。
PPHN是RDS的严重并发症,一旦发生往往会导致治疗费用增加甚至使治疗失败,其发生机制与生后缺氧、酸中毒等导致的肺循环阻力增加有关。本研究发现,DuoPAP组PPHN的发生率均较NCPAP组低,考虑DuoPAP组PPHN发生率降低的原因可能与双相压力支持使患儿呼吸做功更低、缺氧酸中毒等改善更快有关。此外,本研究发现,两组气胸、腹胀发生率差异无统计学意义,提示DuoPAP联合肺表面活性物质没有增加发生气胸、腹胀等并发症的风险。
综上所述,晚期早产儿 RDS在发病早期给予足量肺表面活性物质联合DuoPAP进行呼吸支持,与NCPAP相比可以更快地改善患儿氧合,降低有创呼吸支持率及PPHN发生率,并且不会增加发生腹胀、气胸等并发症的风险,同时其操作简单,易于在基层医院推广使用。
[1] 杨娟,柏进,周婷,等.不同通气方式联合肺表面活性物质治疗新生儿呼吸窘迫综合征疗效评价[J]. 山东医药, 2010,50(9):74-75.
[2] 邵肖梅,叶鸿瑁,丘小汕.实用新生儿学[M].4版.北京人民卫生出版社,2010:396-397.
[3] Wirbelauer J, Thomas W, Speer CP. Preterm and term infants with acute respiratory distress syndrome (ARDS): what is the role of surfactant substitution[J]. Z Geburtshilfe Neonatol, 2009,213(2):33-41.
[4] 孙秀静,王丹华.新生儿呼吸窘迫综合征的管理[J].中国新生儿科杂志, 2010,25(6):378-380.
[5] Raju TN, Higgins RD, Stark AR, et al. Optimizing care and outcome for late-preterm (near-term) infants: a summary of the workshop sponsored by the National Institute of Child Health and Human Development[J]. Pediatrics, 2006,118(3):1207-1214.
[6] 徐发林,白琼丹,庄芳莉,等.早期、晚期早产儿与足月新生儿呼吸窘迫综合征临床比较分析[J].中国实用儿科杂志, 2012,27(1):34-38.
[7] 易海英,徐舒,杨树杰,等.足月儿呼吸窘迫综合征发病相关因素分析[J].中国新生儿科杂志, 2011,26(5):319-321.
[8] 王小虎,姜红,牛世平.不同剂量牛肺表面活性物质治疗晚期早产儿呼吸窘迫综合征的临床研究[J].中国新生儿科杂志, 2014,29(1):43-45.
[9] Bhandari V. Nasal intermittent positive pressure ventilation in the newborn: review of literature and evidence-based guidelines[J]. Perinatol, 2010,30(8):505-512.
[10] Di Blasi RM. Neonatal noninvasive ventilation techniques: do we really need to intubate[J]. Respir Care, 2011,56(9): 1273-1294.
[11] 解立新,刘又宁.回复孙凤春医师关于Bi PAP和BIPAP的概念问题[J].中华结核和呼吸杂志, 2005,28(3): 208.
[12] 孔令凯,李丽华,孔祥永,等.双水平正压通气和经鼻持续气道正压通气在早产儿呼吸窘迫综合征撤机后应用的比较[J].中国新生儿科杂志, 2014,29(1):14-18.
[13] Lista G, Castoldi F, Fontana P, et al. Nasal continuous positive airway pressure (CPAP) versus bi-level nasal CPAP in preterm babies with respiratory distress syndrome: a randomised control trial[J]. Arch Dis Child Fetal Neonatal Ed, 2010,95(2):85-89.
[14] 吴杰斌,蒋红侠,田贞尚,等.鼻塞式同步间歇指令通气在新生儿肺透明膜病撤机中的临床效果分析[J].中国全科医学, 2013,16(9): 1047-1049.
[15] 王保刚,盛红玲,马燕,等.N-BiPAP、NCPAP辅助PS气管内给药治疗新生儿胎粪吸入综合征疗效比较[J].山东医药, 2015,55(22):61-62.
10.3969/j.issn.1002-266X.2016.46.025
R722.1
B
1002-266X(2016)46-0083-03
2016-05-30)
