秋水仙素处理甘草种子染色体加倍研究
2017-01-06杨振华
杨振华
(杨凌职业技术学院生物工程分院,陕西杨凌712100)
秋水仙素处理甘草种子染色体加倍研究
杨振华
(杨凌职业技术学院生物工程分院,陕西杨凌712100)
在低温下,用0.05%,0.20%,0.40%秋水仙素水溶液分别处理甘草的萌动种子1,2,3 d,干种子4,6,8 d,比较不同质量分数处理和不同处理时间对种子的萌发率、加倍率及嵌合率的影响。结果表明,用0.40%秋水仙素处理萌动种子3 d染色体加倍效果最好,加倍率可达66.67%;萌发率随处理时间的延长有降低的趋势;嵌合率因秋水仙素质量分数和时间的不同而各异,最高可达34.62%。
甘草;秋水仙素;萌动种子;干种子;染色体加倍
甘草属于豆科(Leguminosae)甘草属(Glycyrrihizal)灌木状多年生草本植物,因具有极强的药用价值而被广泛应用于临床医学中。此外,因特殊的生理性能,甘草可在寒冷、干旱环境中生长,在植被破坏严重已开始沙化的地区还有防风固沙的巨大生态效益[1-2]。
甘草通过多倍体育种有2个明显效果:一是可增加药材产量,如国外用秋水仙素点滴曼陀罗的腑芽,育成四倍体植株,其植株形态大小及质量都超过了二倍体曼陀罗。二是可提高药材化学成分。曼陀罗四倍体叶中的生物碱含量大致是二倍体的2倍。薄荷的挥发油含量、茼蒿的山道年含量、除虫菊精的含量多倍体也都比二倍体高[3]。
本试验对多倍体育种中的化学诱导多倍体进行研究,采用秋水仙素对甘草种子进行处理,通过比较秋水仙素不同质量分数处理和不同处理时间对种子萌发率、加倍率及嵌合率的影响,观察染色体变异情况。
1 材料和方法
1.1 供试材料
选择甘肃产地的胀果甘草为试验材料,其染色体数目为2n=2x=14[4]。
1.2 试验方法
试验设在杨凌职业技术学院生物遗传实验室。
1.2.1 浸种法处理干种子试验选取300粒大小一致的甘草种子平均分配于10个培养皿中,其中,1个培养皿以蒸馏水处理作对照,另外9个培养皿分为3组加入不同质量分数(0.05%,0.20%,0.40%)秋水仙素,给予不同时间(4,6,8 d)低温冷藏,测定萌发率。之后再用自来水冲洗干净后置于常温下,待胚根长至0.5~1.0cm时,切取根尖进行倍性检查[5-7]。
1.2.2 浸种法处理萌动种子试验选取300粒大小一致的甘草种子平均分配于10个培养皿中,其中一个培养皿以蒸馏水处理作为对照,另外9个培养皿分为3组加入不同质量分数(0.05%,0.20%,0.40%)的秋水仙素处理刚露白的萌动种子,给予不同时间(1,2,3 d)低温冷藏后测定萌发率,萌发率=萌发种子/待测种子×100%。之后再用自来水冲洗干净后置于常温下,待胚根长至0.5~1.0 cm时,切取根尖进行倍性检查。
1.3 染色体数目鉴定的方法
待胚根长至0.5~1.0cm时,于10:00—10:30切取根尖,放入装有2 mg/L8-羟基喹啉的小瓶中预处理2 h左右。经蒸馏水冲洗再用卡诺固定液固定根尖4 h。倒去固定液,用蒸馏水浸洗根尖3~5次,每次5~10min。然后在装有根尖的小瓶中加入1mol/L HCl数滴后,放入(60±0.5)℃的水浴锅中酸解8~9 min。最后再用蒸馏水冲洗根尖并吸取根尖的水分,用改良苯酚品红进行染色,压片镜检。记录每个根尖10个细胞染色体数目,以计算加倍率和嵌合率。加倍率=加倍种子数/处理种子数×100%;嵌合率=嵌合体数/处理种子数×100%。
2 结果与分析
2.1 秋水仙素对甘草种子萌发率的影响
由图1可知,萌动种子在秋水仙素处理下的萌发率均达到75%以上,尤其是0.20%秋水仙素处理2 d的萌发率最高,达到93%以上。
从图2可以看出,所有处理干种子的萌发率均偏低,其萌发率在60.0%~76.67%,其中,以0.05%秋水仙素处理干种子6 d的萌发率最高,达到76.67%。秋水仙素处理萌动种子的萌发率明显高于干种子。
2.2 秋水仙素对甘草染色体加倍率的影响
由图3可知,随着秋水仙素质量分数的增加,处理1,3 d的萌动种子加倍率明显增加;0.20%,0.40%秋水仙素处理萌动种子3 d的加倍率较高,分别为52.17%,66.67%。

由图4可知,处理4 d的干种子染色体加倍率随着秋水仙素质量分数的升高而升高,从15%增加到63.64%;处理6 d秋水仙素质量分数为0.20%的加倍率仅为25%,质量分数0.40%时其加倍率最高,为33.33%;处理8 d的染色体加倍率在秋水仙素3个质量分数下呈现低—高—低的趋势,并以0.20%质量分数时的加倍率最高(45%)[8]。说明在不同秋水仙素质量分数水平下,当质量分数较低时,随着处理时间的延长,加倍率明显增加,而在较高质量分数下,随着处理时间的延长,加倍率却明显下降。

2.3 秋水仙素诱导染色体加倍中的嵌合体表现
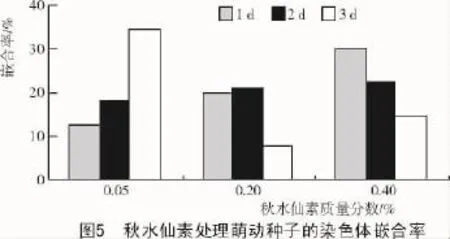
虽然秋水仙素处理甘草种子能够导致细胞倍性的增加,但同时也会使细胞产生倍性嵌合现象。由图5可知,当处理时间为1,2 d时,随着秋水仙素质量分数秋水仙素的升高,嵌合率呈渐增趋势;而第3 d时,随着秋水仙素质量分数的升高,嵌合率反而降低,其中,以0.05%秋水仙素处理萌动种子3 d的嵌合率最高,达到34.62%。
由图6可知,嵌合率以秋水仙素处理干种子6 d较高,而0.20%秋水仙素处理4 d最高,达27.78%。说明秋水仙素的质量分数不同对嵌合率有较大影响,但嵌合率与秋水仙素质量分数不成简单的线性关系,嵌合率的增加还与其他影响因子如处理时间、温度等相关,它们之间的影响规律有待进一步研究。

3 结论与讨论
秋水仙素本身是有毒物质[9],在处理种子时会对种子的萌发产生毒害作用,从而影响种子的萌发率。本研究结果表明,随着秋水仙素处理时间的延长,种子萌发率有下降的趋势,尤其是干种子的萌发率。秋水仙素处理时,药剂质量分数的大小与处理时间的长短直接影响处理效果[10-11]。一般情况,质量分数高时处理时间短,反之处理时间长。处理方法的不同也会影响处理效果。浸种法处理时,一般会对根系产生毒害作用[9]。本试验采用浸种法,当秋水仙素处理干种子4 d时,随着秋水仙素质量分数的增加,萌发率下降。用秋水仙素处理时,要选择最佳时间对材料进行固定、解离、染色和压片[12-15]。而何时固定材料是影响试验成败的一个主要因素。本试验中,取胚根时间为10:00—10:30,这段时间正是甘草种子细胞分裂最旺盛时期。秋水仙素处理种子时,选取材料的染色体数目多少也是试验成败的一个因素[7]。本试验中,选取的材料是胀果甘草种子(2n=2x=14),染色体数目不多,易观察其有无加倍。秋水仙素诱变育种时还存在嵌合体问题。植物的茎尖分生组织由2种或2种以上遗传型不同的细胞组成,并由这些细胞共同发育成完整的植株,称为嵌合体[16-19]。有研究通过顶芽切割和丛生芽技术,诱导再生苗来分离秋水仙素诱导罗汉果四倍体中形成的嵌合体。在本试验中,嵌合率随着秋水仙素处理质量分数和时间的不同而各异,有研究表明,嵌合率的变化受处理温度、处理时间、秋水仙素质量分数互作的影响[20-22],其规律有待进一步研究。
[1]梁冰,黄凤兰.甘草属(Glycyrrhiza)化学成分及药理作用研究发展[J].东北农业大学学报,2006,37(1):115-119.
[2]陈发棣,蒋甲福.秋水仙素诱导菊花脑多倍体的研究[J].上海农业学报,2002,18(1):46-50.
[3]詹忠根,徐程.秋水仙素诱导铁皮石斛多倍体研究[J].浙江农业科学,2011(3):321-325.
[4]张健.木薯离体培养诱导多倍体育种技术研究[D].海口:海南大学,2012.
[5]张志胜,黎扬辉,姜蕾,等.红掌四倍体的离体诱导及其鉴定[J].园艺学报,2007,34(3):729-734.
[6]张宝恒.甘草药理作用研究的发展[J].药学学报,1963,2(10):688-700.
[7]曹孜义.玉米单倍体胚性细胞无性二倍化的研究[J].遗传学报,1983,10(4):274-279.
[8]吴玉香.刺果甘草多倍体诱变育种的研究[J].山西农业大学学报:自然科学版,2004(2):38-42.
[9]蔡旭.植物遗传育种学[M].2版.北京:科学出版社,1996:536-569.
[10]赵永华.现代中药植物资源生产技术[M].北京:化学工业出版社,2004:192-193.
[11]庄文庆.药用植物育种学[M].北京:农业出版社,1993:100-108.
[12]李懋学,张赞平.作物染色体及其研究技术[M].北京:中国农业出版社,1996:23-37.
[13]翟晓巧.木本植物组织培养褐化控制策略[J].河南林业科技,2008,28(1):38-40.
[14]杜建中,王景雪.影响芸苔属植物(Brassica)组织培养过程中外植体褐化的因素[J].山西农业科学,2004,32(1):29-32.
[15]姜伟贤,孙世菊.中国花卉科技信息全书[M].大连:大连出版社,1988:61.
[16]国家中医药管理局中华本草编委会.中华本草[M].上海:上海科学技术出版社,1999:8671-8672.
[17]侯鸣.清新雅致鹤顶兰[J].植物资源,2009(8):79.
[18]季必霞.大花蕙兰的倍性育种研究[D].合肥:安徽大学,2011.
[19]蒋洪恩.枣多倍体诱导研究[D].保定:河北农业大学,2003.
[20]姜丹.刺槐子叶不定芽再生及多倍体诱导的研究[D].北京:北京林业大学,2012.
[21]匡全.宝塔菜四倍体新种质的快速培育研究[D].重庆:西南大学,2004.
[22]兰芹英,何惠英,张艳军,等.鹤顶兰的组织培养和快速繁殖[J].广西农业生物科学,2001,20(4):307-308.
Study on Doubling Chomosomes of Licorice Seeds Treated by Colchicine
YANGZhen-hua
(Department ofBiological Engineering,YanglingVocational and Technical College,Yangling712100,China)
The dry seeds and germinating seeds of the licorice were treated with 0.05%,0.20%,0.40%colchicines under low temperature for 4,6,8 d and 1,2,3 d,respectively.To study the influence of different concentration and time of colchicines to the germinatingrates,the chromosome-doubled rates and the embedded rates.The results showed that the highest chromosome-doubled rate was got after germinating seeds were treated with 0.40%colchicines for 3 d,it was up to 66.67%.With time prolonging,the germinating rates had the trend to decline;the embedded rates were different at different concentration of colchicines and treatment time,the highest rate was up to34.62%.
licorice;colchicin;the germinatingseeds;the dryseeds;doublingchromosome
R282
A
1002-2481(2016)03-0294-03
10.3969/j.issn.1002-2481.2016.03.05
2015-10-28
杨凌职业技术学院校内研究基金项目(201400020)
杨振华(1981-),男,甘肃白银人,讲师,硕士,主要从事生物技术应用教学及研究工作。
