小偃麦渗入系耐盐性鉴定及其在F2群体中的遗传分析
2017-01-06张蕾侯雅静张晓军李欣乔麟轶畅志坚
张蕾,侯雅静,张晓军,李欣,乔麟轶,畅志坚
(山西省农业科学院作物科学研究所,作物遗传与分子改良山西省重点实验室,山西太原030031)
小偃麦渗入系耐盐性鉴定及其在F2群体中的遗传分析
张蕾,侯雅静,张晓军,李欣,乔麟轶,畅志坚
(山西省农业科学院作物科学研究所,作物遗传与分子改良山西省重点实验室,山西太原030031)
小麦耐盐品种选育对于改良和利用盐碱地、增加粮食产量具有重要意义。CH7124是由小麦和中间偃麦草Z1141杂交、回交而来的高代渗入系,在苗期对盐胁迫环境表现出高度耐受性,耐盐表现与其外源亲本Z1141和小偃麦TAI8335相似。对CH7124/绵阳11的F1及F2群体耐盐鉴定结果表明,CH7124的耐盐性可能受2个以上QTL控制。采用分离群体分组分析法,以100个SSR标记对亲本CH7124和绵阳11以及F2群体的耐盐/敏感池进行筛选,结果获得2个多态性标记Xwmc175和Xgwm213。根据中国春缺体-四体鉴定结果,推测CH7124的2B和5B染色体上可能各存在一个耐盐相关QTL。
小麦;中间偃麦草;耐盐;遗传分析
土壤盐渍化是全球农业面临的严重挑战,目前世界上15%的土地由于盐害而无法耕种。在我国,盐渍化和次生盐渍化土地高达4 000万hm2以上,约占全国总耕地面积的10%[1]。大水漫灌、施用改良剂等方法虽能在一定程度上降低土壤的含盐量,但成本较高,不适于大范围推广,而培育耐盐品种可最大程度地利用盐渍化土壤[2]。小麦是我国乃至世界的主要的粮食作物,广泛发掘耐盐种质、选育小麦耐盐品种,是充分改良和利用盐碱地、解决世界粮食危机的一个重要途径。
在小麦耐盐品种选育过程中,杂交育种仍是较为普遍和有效的方法。国内利用杂交手段已育成TBT6号、鲁麦10号、轮抗6号、轮抗7号、新春16、新春29、沧6001和新冬34等耐盐小麦品种[3-5]。其中,小麦近缘种属在杂交育种中为优异耐盐性的重要来源。已有研究将多枝赖草(Leymus multicaulis Kar.et Kir.Tzvel.)的耐盐性状成功导入普通小麦品种中国春[6]。此外,来源于一粒小麦(Triticum monococcum)的耐盐基因Nax1和Nax2已被导入硬粒小麦品系Tamaroi,可使该品系在盐碱地条件下增产达25%[7]。
中间偃麦草(Th.intermedium,2n=42)是多年生小麦野生近缘草本植物,原产于东欧,适应性极强,在中轻度盐化土壤上仍能很好地生长[8],已成为小麦耐盐性遗传改良中的宝贵资源[9]。亓晓蕾[10]利用中间偃麦草与小麦品种烟农15杂交,获得具有高耐盐性的3个八倍体小偃麦材料和1个附加系山农120211[11]。
作物遗传与分子改良山西省重点实验室利用中间偃麦草Z1141与普通小麦杂交获得小偃麦材料,将其再与小麦品种杂交,先后获得一批小偃麦异附加系、异代换系、易位系[12-14]。CH7124是由八倍体小偃麦TAI8335[12]与普通小麦品种杂交、回交得到的新品系[13,15],本研究旨在通过对CH7124及其遗传群体进行苗期耐盐鉴定和分子标记检测,推断CH7124所携带的耐盐基因/QTL数目以及所在染色体的位置,为小麦抗逆育种提供种质资源和分子标记。
1 材料和方法
1.1 小麦材料
用于耐盐鉴定的材料包括中间偃麦草Z1141、八倍体小偃麦TAI8335(晋春5号/Z1141//晋麦33)、小偃麦渗入系CH7124(晋麦33/TAI8335//冀麦26*2)、普通小麦品种绵阳11以及CH7124/绵阳11的F1和F2群体(包含112个单株),同时以中国春作为对照品种。上述材料均由山西省农业科学院作物科学研究所提供。用于分子标记检测的中国春缺体-四体材料由美国农业部种质研究中心惠赠。
1.2 耐盐性鉴定
1.2.1 幼苗培养选取籽粒饱满的材料种子,用1%的NaClO浸泡15 min,之后于28℃浸种,种子露白后移至泡沫板上的海绵孔中,每孔放置1粒种子。将泡沫板放在注有清水(盐酸调节pH值为5.5)的塑料盒中。除F2群体材料外,每个试验材料设置10次重复。
1.2.2 盐分胁迫处理幼苗长至两叶一心期后移到含140 mmol/LNaCl的Yoshida营养液[16]中。胁迫期间室温控制在25~30℃,湿度60%~70%,营养液pH值为5.5。
1.2.3 盐害级别鉴定在盐分胁迫处理后第7天和第14天调查盐害级别[17]。根据幼苗生长状况将苗情分为6级:0级,无受害症状,生长正常;1级,生长基本正常,含3片绿叶;2级,生长基本正常,含3片绿叶,叶尖青枯或叶片变黄;3级,幼苗生长受抑制,有2片绿叶;4级,严重受害,仅有1片绿叶或仅心叶存活;5级,整株枯死或接近死亡。将0~2级定义为耐盐(tolerance,T),3~5级定义为盐敏感(sensitivity,S)。用SAS8.0作卡方适合性检测。
1.3 SSR标记分析
在第1次耐盐鉴定后,剪取幼苗部分叶片,采用SDS法提取基因组总DNA。采用分离群体分组分析法(bulked segregant analysis,BSA)在F2群体中选取10株耐盐植株(0级或1级)和10株盐敏感植株(4级或5级),分别将DNA等量混合建池。选取100对分布于小麦21条染色体的SSR引物[18],先后在亲本和性状池间筛选多态性,之后利用缺体-四体材料对差异标记进行染色体定位。
PCR扩增体系为20 μL:2 μL10×Buffer,0.4 μL 10 mmol/L dNTP,0.2 μL 1 U Takara Taq酶,2.5 μL 10 mmol/L引物和2 μL 40 ng模板DNA和12.9 μL双蒸水。反应扩增程序为:95℃变性5 min;95℃变性40 s,50~60℃复性45 s,72℃延伸1 min,35个循环;72℃延伸10 min。对扩增产物用8%非变性聚丙烯酰胺凝胶(Acr∶Bis=29∶1)进行电泳,经硝酸银染色后观察照相。
2 结果与分析
2.1 CH7124的苗期耐盐性鉴定
从表1可以看出,对照品种中国春表现为盐敏感,表明盐胁迫处理所用的溶液浓度均较为合理,鉴定结果可以使用;CH7124的10株幼苗均表现为耐盐,其中,5株0级、4株1级、1株2级,耐盐表现与其野生亲本中间偃麦草Z1141和TAI8335相似,初步推断CH7124耐盐性状来自于中间偃麦草;小麦品种绵阳11表现为盐敏感。
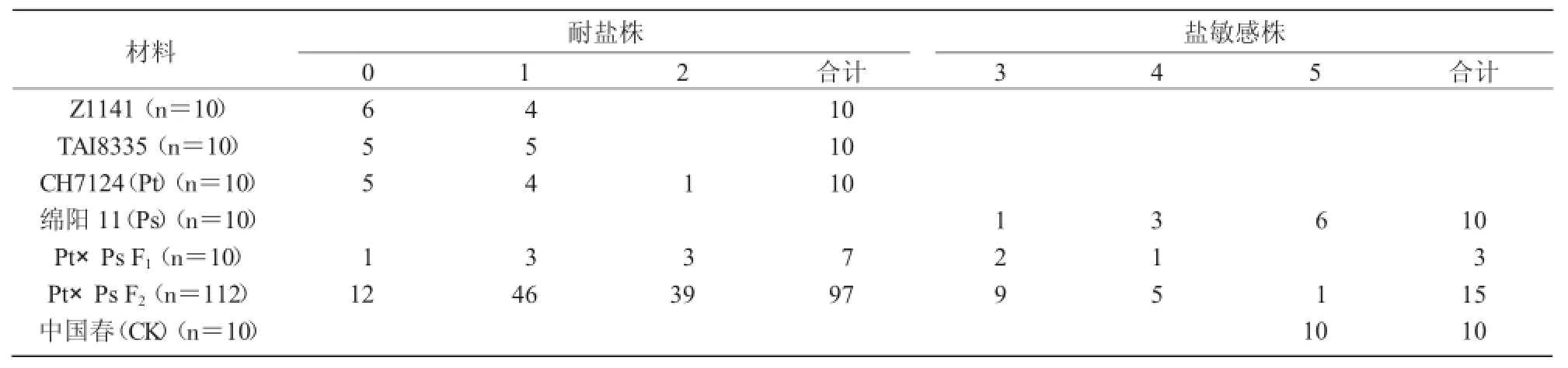
表1 供试材料苗期耐盐性鉴定
2.2 群体耐盐性遗传分析
CH7124/绵阳11的F1植株在苗期表现为耐盐(7株)和盐敏感(3株),表型介于其亲本CH7124(Pt)和绵阳11(Ps)之间;在CH7124/绵阳11的F2群体中,耐盐(0~2级)个体为97株,敏感(3~5级)个体为15株,分离比不符合孟德尔遗传中3∶1的理论比例(χ2=0.005,P>0.05)。初步推断CH7124的耐盐性由2个以上的QTL控制。
2.3 耐盐QTL的染色体定位
在所选的100对SSR引物中,有28对在亲本CH7124和绵阳11间存在多态性,其中,只有Xwmc175-2B和Xgwm213-5B在性状池间呈现多态性,表明这2个SSR标记可能与耐盐性连锁。利用中国春第2和第5同源群的缺体-四体材料进行检验,证实Xwmc175和Xgwm213分别位于2B和5B染色体上(图1)。
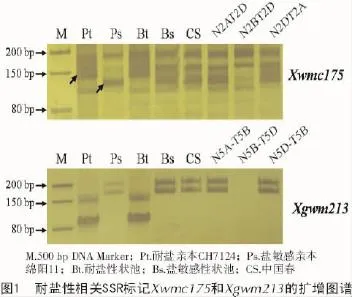
3 讨论与结论
3.1 CH7124的利用价值
广泛种植耐盐小麦品种是有效改良和利用盐碱地、增加粮食产量的最佳途径,而发掘小麦近缘物种的耐盐基因/QTL,对培育耐盐新品种具有重要意义。CH7124是以八倍体小偃麦TAI8335与小麦品种杂交、回交选育的品系,通过耐盐鉴定和群体遗传分析得出,CH7124具有与其外源亲本中间偃麦草相似的优异耐盐性,可能由2个以上QTL控制。在CH7124中利用基因组原位杂交技术已经检测不到任何外源片段[15],细胞学稳定性强,其所含的耐盐性可以稳定遗传给后代。此外,该材料还携带有一个抗白粉病基因[15],因此,CH7124可作为一个兼抗白粉病的耐盐新种质,用于小麦品种改良或种质创新。
3.2 CH7124的耐盐性QTL
通过SSR标记筛选初步确定,CH7124中所含的2个耐盐相关QTL分别位于2B和5B染色体上,而其2BL染色体上还携带有抗白粉病基因Pm-CH7124,由于CH7124的抗病性和耐盐性均来源于中间偃麦草,因此,2B染色体上的耐盐相关QTL很可能与PmCH7124位于同一位点,接下来将用Pm-CH7124的连锁标记对耐盐群体进行检测;另一个耐盐QTL位于5B染色体上,而已有研究表明,小麦材料98-160(延小赖TM413)[19]和SQ1[20]的5B染色体上各存在1个耐盐基因,由于前者为小麦和延安赖草的杂交后代,后者为春小麦组合Highbury× TW269/9/3/4[21]的高代自交品系,因此,CH7124中5B染色体上耐盐QTL的来源与上述2个耐盐基因均不相同,可能是一个新的位点,下一步将在2B和5B染色体上开发更多的标记,对CH7124所含的耐盐QTL进行定位。
[1]Bot A J,Nachtergaele F O,Young A.World soil resources reports: land resource potential and constraints at regional and county levels [R].Italy:Food and Agriculture Organization of the United Nations,2000:17-18.
[2]Hajkowicz S,Young M D.An economic analysis of revegetation for dry land salinity control on the lower Eyre Peninsula in South Australia[J].Land Degradation and Development,2002,13:417-428.
[3]胡云霖,张湘泉,杨庆铭.冬小麦新品种TBT6号的选育[J].天津农业科学,1995,1(3):15-16.
[4]裴自友,温辉芹,任永康,等.小麦的耐盐性及其改良研究进展[J].作物研究,2012,26(1):93-98.
[5]赵松山,王奉芝,陆丽,等.抗旱耐盐型小麦品种沧6001的选育[J].华北农学报,2000,15(增刊):113-117.
[6]魏景芳,秦君,王淳,等.小麦与多枝赖草耐盐纯合易位系的培育及GISH鉴定[J].华北农学报,2004,19(1):40-43.
[7]Richard J.Australian researchers develop highest-yielding salt-tolerant wheat[EB/OL].[2010-04-26].http://www.sciencedaily.com/rel eases/2010/04/100423094622.htm.
[8]王洪刚,刘树兵,亓增军,等.中间偃麦草在小麦遗传改良中的应用研究[J].山东农业大学学报:自然科学版,2000,31(3):333-336.
[9]Li H,Wang X.Thinopyrum ponticum and Th.intermedium:the promising source of resistance to fungal and viral diseases of wheat [J].J Genet Genomics,2009,36:557-565.
[10]亓晓蕾.八倍体小偃麦混合基因组形成的遗传基础研究和小偃麦种质系的鉴定[D].泰安:山东农业大学,2014.
[11]徐林涛,马莹雪,张超.抗白粉病耐盐小麦-中间偃麦草附加系山农120211的鉴定[J].西北植物学报,2014,34(9):1757-1763.
[12]Chang Z,Zhang X,Yang Z,et al.Characterization of a partial wheat-Thinopyrum intermedium amphiploid and its reaction to fungal diseases ofwheat[J].Hereditas,2010,147:304-312.
[13]李欣,张晓军,张丛卓,等.兼抗白粉、条锈病小偃麦渗入系CH7124抗性遗传及细胞学鉴定[J].植物遗传资源学报,2012,13(4):577-582.
[14]Zhan H X,ZhangX J,Li G R,et al.Molecular characterization of a newwheat-Thinopyrum intermedium translocation line with resistance topowderymildewand stripe rust[J].Int J Mol Sci,2015,16:2162-2173.
[15]李建波,乔麟轶,李欣,等.小麦-中间偃麦草渗入系抗白粉病基因PmCH7124的分子定位[J].作物学报,2015,41(1):49-56.
[16]Yoshida S,Forno D A,Cock J H,et al.Laboratory manual for physiological studies of rice[M].Philippines:The International Rice Research Institute,1972:62-64.
[17]中华人民共和国农业部.NY/PZT 001—2002小麦耐盐性鉴定评价技术规范[S].北京:中国农业出版社,2000.
[18]Somers DJ,Isaac P,Edwards K.A high densitymicrosatellite consensus map for bread wheat(Triticum aestivum L.)[J].Theor Appl Genet,2004,109:1105-1114.
[19]刘旭,史娟,张学勇,等.小麦耐盐种质的筛选鉴定和耐盐基因的标记[J].植物学报,2001,43(9):945-954.
[20]Quarrie S A,Steed A,Calestani C.A high-density genetic map of hexaploid wheat(Triticum aestivum L.)from the cross Chinese Spring×SQ1 and its use to compare QTLs for grain yield across a range of environments[J].Theor Appl Genet,2005,110(5):865-880.
[21]Quarrie SA.Genetic variabilityand heritabilityofdrought-induced abscisic acid accumulation in springwheat[J].Plant Cell Environ,1981,4:147-151.
Identification and Genetic Analysis for Salt-tolerance of Wheat-Thinopyrum intermediumIntrogression Line and Its F2Population
ZHANGLei,HOUYa-jing,ZHANGXiao-jun,LI Xin,QIAOLin-yi,CHANGZhi-jian
(Shanxi Province KeyLaboratoryofCrop Genetics and Molecular Improvement,Institute ofCrop Sciences,Shanxi AcademyofAgricultural Sciences,Taiyuan 030031,China)
Screeningsalt-tolerant wheat varieties can enhance utilization ofsaline land efficiencyand increase the yield ofcrops for the world.A wheat-Thinopyrum intermedium introgression line CH7124,developed by backcrossing TAI8335 with wheat variety Mianyang 11,was found to be a salt-tolerance material by salt stress response test at the seedling stage.The salt-tolerance phenotype of CH7124 was similar to TAI8335 and Z1141.Then,the salt-tolerance identification results of F1and F2generations from CH7124/MY11 indicated that two or more QTLs related to salt-tolerance were in CH7124.According to bulked segregant analysis,two SSR markers, Xwmc175 and Xgwm213,might be linked to salt-toletance.And based on marker loci,the salt-tolerance-related QTLs were located on chromosome 2Band 5B.
wheat;Th.intermedium;salt-tolerance;genetic analysis
S512.903
A
1002-2481(2016)03-0281-04
10.3969/j.issn.1002-2481.2016.03.01
2016-01-20
山西省科技攻关项目(20150311001-1);山西省青年基金项目(2015021145);山西省农业科学院攻关项目(15YGG01);山西省农业科学院重点科研项目(YZD1501)
张蕾(1988-),女,江苏镇江人,硕士,主要从事种质资源创新与利用研究工作。畅志坚为通信作者。
