多重耐药肺炎克雷伯菌中碳青霉烯酶的检测和分析
2017-01-06王鹏鲲陈定强
王鹏鲲,陈定强,俞 辉
(广州医科大学附属第一医院检验科,广州 510120)
·论 著·
多重耐药肺炎克雷伯菌中碳青霉烯酶的检测和分析
王鹏鲲,陈定强,俞 辉
(广州医科大学附属第一医院检验科,广州 510120)
目的 研究多重耐药肺炎克雷伯菌临床分离株的碳青霉烯酶的流行情况。方法 收集该院从2007年1月至2012年12月临床分离的151株多重耐药肺炎克雷伯菌,并对其药敏结果进行归纳整理,用碳青霉烯酶表型试验进行检测,再用聚合酶链反应(PCR)检测已知的碳青霉烯酶基因,并对扩增产物进行DNA测序,确定其基因型。结果 在151株多重耐药肺炎克雷伯菌中,通过改良Hodge试验筛选出12株可能产碳青霉烯酶的菌株,其中有1株的金属酶试验为阳性,该12株菌经PCR扩增及测序确定产碳青霉烯酶菌株有5株,金属酶阳性株为IMP-4型金属酶,另外4株产碳青霉烯酶菌株为KPC-2型。结论 近年来该院多重耐药肺炎克雷伯菌出现了产碳青霉烯酶菌株,临床应根据药敏结果合理选用碳青霉烯类药物,以减少耐药菌株的产生。
肺炎克雷伯菌; 碳青霉烯酶; 多重耐药; 聚合酶链式反应
肺炎克雷伯菌是最重要的医院感染条件致病菌之一,可引起典型的原发性肺炎,也可引起肺外感染,该菌容易产生超广谱β-内酰胺酶,可携带多重耐药的质粒,在细菌耐药性传播中有重要作用[1]。随着碳青霉烯类抗菌药物在临床的使用增加,近几年世界各地陆续出现耐药株,产碳青霉烯酶是碳青霉烯类药物耐药的重要原因之一,其可随质粒或整合子等移动元件在不同种属菌株间传播的特性引起了高度的关注。在肠杆菌科细菌中,耐碳青霉烯类的肺炎克雷伯菌的检出率也不断增加[2]。为了解本院肺炎克雷伯菌产碳青霉烯酶的流行情况,同时也为医院感染防控和规范碳青霉烯类抗菌药物用药提供实验室依据,本文对本院临床分离的151株多重耐药肺炎克雷伯菌进行碳青霉烯酶基因的分析。
1 材料与方法
1.1 材料来源 实验菌株为本院从2007年1月至2012年12月临床分离的151株多重耐药的肺炎克雷伯菌,细菌耐药性及鉴定均经过VITEK-2全自动细菌鉴定仪(法国生物梅里埃公司)分析鉴定。质控菌株大肠埃希菌ATCC25922,金属酶阳性菌株RP01和Hodge试验阳性菌株KP1为实验室保存的菌株。
1.2 实验试剂 DNA Marker和PCR配套试剂购自Takara公司,琼脂糖和溴化乙锭购自北京鼎国公司,引物由上海英潍捷基公司合成;药敏纸片亚胺培南纸片IPM、厄他培南纸片ETP和空白纸片购自Oxoid公司;M-H琼脂培养基、哥伦比亚血琼脂培养基均购自梅里埃微生物制品有限公司;
1.3 改良Hodge实验 将大肠埃希菌ATCC25922和24 h血平板上的单个菌落分别制备菌悬液,比浊至0.5号麦氏管,再用生理盐水把已配好的大肠埃希菌的菌悬液稀释10倍,用无菌拭子浸入菌悬液中,在管壁上挤干,均匀涂于整个M-H平板表面,中间贴厄他培南ETP纸片,每个M-H平板接种4株菌株,并做好阴性对照(大肠埃希菌ATCC25922)和阳性对照(产KPC的肺炎克雷伯菌KP1),无菌接种环自纸片外缘向平板边缘画线,35 ℃孵育16~18 h后观察结果,结果判断:ETP纸片抑菌圈内出现待检菌矢状生长者为产碳青霉烯酶菌株。
1.4 双纸片协同试验和组合纸片法筛选金属酶 取MHT实验中已比浊好的待测菌的菌悬液,用无菌拭子浸入菌悬液中,在管壁上挤干,分别均匀涂于整个M-H平板表面,在平板的一端贴亚胺培南(IPM,10 μg)药敏纸片,在距纸片2 cm处贴一空白纸片,并在空白纸片上面加入4 μL 0.5 mmol/L乙二胺四乙酸(EDTA)溶液,再在距离IPM纸片4 cm处另贴一IPM纸片,再滴加4 μL 0.5 mmol/L EDTA溶液,35 ℃培养过夜。结果判断:IPM纸片抑菌圈在靠近滴加EDTA空白纸片抑菌圈有明显扩大者或滴加EDTA的IPM纸片的抑菌环直径大于4 mm则为产金属酶株。
1.5 PCR和DNA测序 按照文献[3]报道的序列和方法,针对已知的11种碳青霉烯酶基因合成引物进行PCR检测。产物经纯化回收后送上海英俊生物科技公司进行基因测序,测序结果在NCBI网上进行Blast比对分析。
2 结 果
2.1 菌株药敏试验结果 151株肺炎克雷伯菌的药敏情况见表1。共有超广谱 β-内酰胺酶(ESBL)阳性菌93株,ESBL阴性菌58株,产ESBL的阳性率为62%。药敏分析表明,产ESBL株对青霉素类、第一和第三代头孢菌素类高度耐药,耐药率均高于90%(第三代头孢替坦除外,为19%),但对第四代头孢耐药率为77%;对单环类的氨曲南耐药率高达100%,而对喹诺酮类、磺胺类药物耐药性也较高,为70%左右;对加酶抑制剂复合药氨苄西林/舒巴坦的耐药率也高达94%,而对头孢哌酮/舒巴坦和哌拉西林/他唑巴坦的耐药率分别为37%和30%;产ESBL对亚胺培南高度敏感,敏感度为99%,对厄他培南的敏感率为78%。在2009~2012年收集到的71株菌中,产ESBL株有47株,美洛培南的敏感率为87%,非产ESBL株有24株,美罗培南的敏感率为96%。本研究显示,除厄他培南、亚胺培南、美罗培南和左旋氧氟沙星外,产ESBL株均比非产ESBL株的耐药性高。
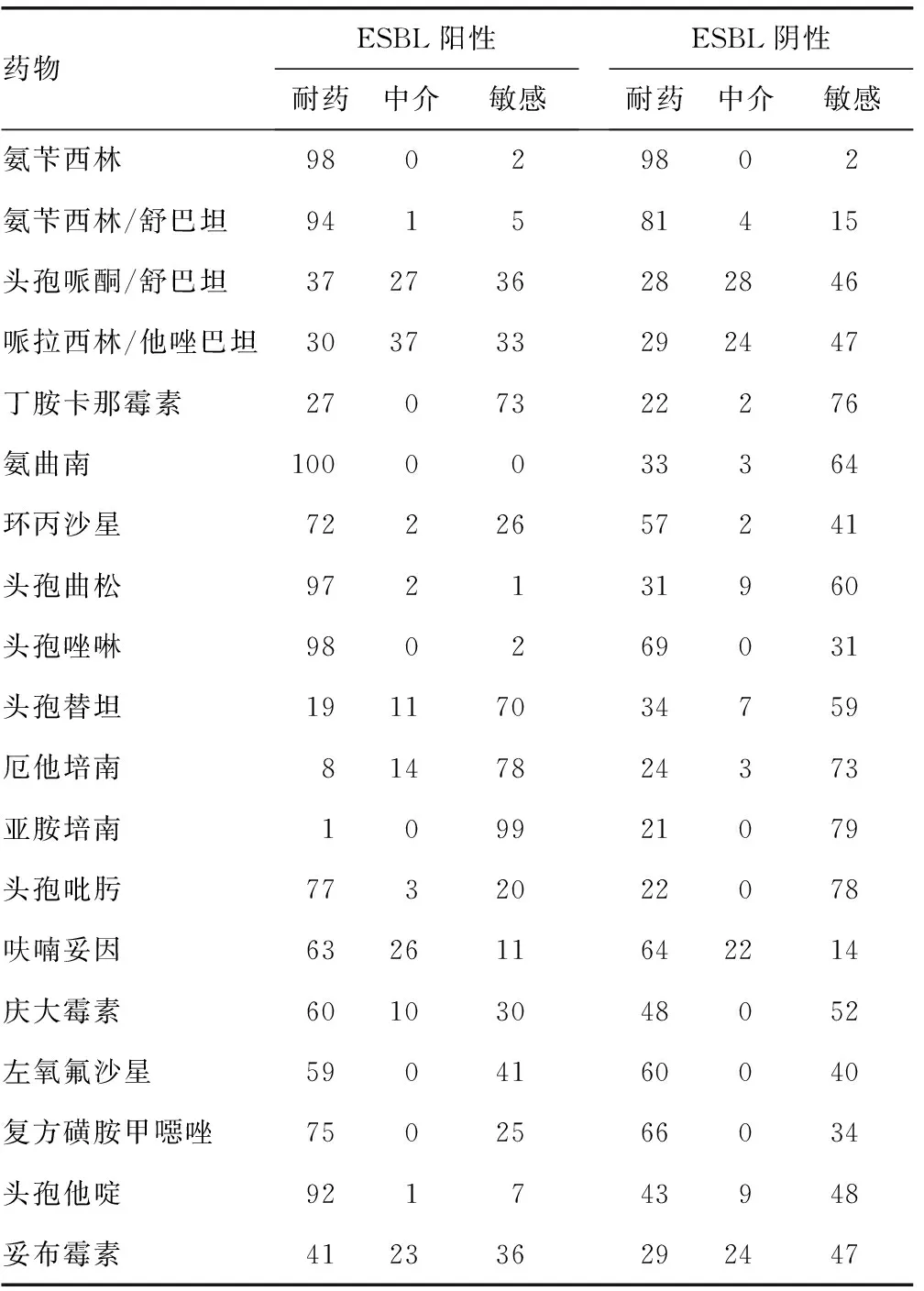
表1 151株肺炎克雷伯菌耐药性分析(%)
2.2 改良Hodge试验和金属酶试验结果 在151株肺炎克雷伯菌中,Hodge试验阳性的有12株,占7.9%,这些菌株可能产碳青霉烯酶;阴性的有139株,占92%,阴阳性对照见图1,且在该12株菌中,双纸片协同试验和组合纸片法同时为阳性的细菌有1株, 说明该菌株可能产金属酶。
2.3 PCR电泳结果及测序 12株Hodge试验阳性结果经PCR扩增后有5株确证为产碳青霉烯酶菌株,其中有4株为KPC型,其阳性率为2.6%,1株为IMP型,阳性率为0.7 %。该5株菌的PCR产物电泳结果见图1和图2。PCR产物测序的结果表明,4株产KPC型菌株均携带KPC-2基因亚型,而1株产IMP型菌株携带IMP-4基因亚型。

注:1~4为含KPC基因的菌株;M为DNA Marker。
图1 KPC基因PCR结果

注:1为含IMP基因的菌株;M为DNA Marker。
图2 IMP基因PCR结果
3 讨 论
近年来由于抗菌药物的滥用,尤其是β-内酰胺类抗菌药物,以致产ESBL的肺炎克雷伯菌对多种抗菌药物的耐药性上升,如碳青霉烯类抗菌药物在临床上使用的增加,对碳青霉烯类抗菌药物耐药的菌株被越来越多的报道。碳青霉烯类药物对质粒介导的ESBL、染色体及质粒介导的头孢菌素酶(AmpC)高度稳定,但其也可被金属β-内酰胺酶水解灭活,造成碳青霉烯类抗菌药物耐药。而本研究的药敏结果显示,经PCR确证试验为产碳青霉烯酶的5株菌中,4株KPC型的厄他培南、亚胺培南和美洛培南的耐药率均为100%,其ESBL也均为阳性,而1株IMP型的厄他培南、亚胺培南和美洛培南的敏感率均为100%,且ESBL为阴性,这5株菌对其他常用抗菌药物均高度耐药,由资料可推测,产KPC酶可能是本院的肺炎克雷伯菌对碳青霉烯类抗菌药物耐药的主要机制,文献报道KPC-2型的肺炎克雷伯菌在我国广泛存在,但产金属酶的报导相对较少[3-4]。而本研究所检测到的5株耐碳青霉烯类的肺炎克雷伯菌中,KPC-2型的有4株,占80%,IMP-4型的有1株,仅占20%,这一结果也与该报导相一致。由于本研究先用改良Hodge试验筛选出产碳青霉烯酶的耐药株,而改良Hodge试验是美国临床实验室标准化委员会(CLSI)推荐的碳青霉烯酶表型检测方法,有研究结果显示,改良Hodge试验检测碳青霉烯酶的敏感度为100%,特异度为79%,阳性预测值为70%,阴性预测值为100%,准确率为86%[5]。另外,也有研究表明,改良Hodge试验常用来证实是否产KPC,其灵敏度和特异度均为100%[6]。对于本研究的151株肺炎克雷伯菌中,改良Hodge试验阳性菌有12株,但最终经PCR确证为产碳青霉烯酶的菌株只有5株,并且其中1株经双纸片协同试验和组合纸片法筛选金属酶时,两个试验同时为阳性且为IMP-4型,其他菌株以上3个试验均为阴性。由以上数据可推测改良Hodge试验筛选产碳青霉烯酶的耐药株存在一定的假阳性,又或者由于碳青霉烯酶种类很多[3],PCR扩增是未能完全涵盖,未能完全排除其他未检测到的碳青霉烯酶引起耐药机制存在。另外,当酶的量极少时也可以造成结果的假阴性,易造成漏检。
对产碳青霉烯酶菌株引起的感染治疗起来比较困难,需要根据药敏结果综合分析选用适合的抗菌药物。部分病例需使用多黏菌素,产酶株体外即使对碳青霉烯类抗菌药物敏感,也不宜应用碳青霉烯类抗菌药物[7]。还要提高耐药株的检出率,加强实验室的管理。另外,还要避免院内感染的暴发流行。在防止细菌流行的同时,还必须高度重视质粒的流行,警惕耐药基因在不同属、种细菌之间或是同一菌种的不同生物型、血清型之间传播。
[1]洪秀华,刘运德.临床微生物学检验[M].2版.北京:中国医药科技出版社,2010:318-320.
[2]苏丹虹,沈苹,杜小幸,等.肺炎克雷伯菌及大肠埃希茵产KPC酶的检测研究[J].中国抗生素杂志,2009,11(34):684-687.
[3]Poirel L,Walsh TR,Cuvillier V,et al.Multiplex PCR for detection of acquired carbapenemase genes[J].Diagn Microbiol Infect Dis,2011,70(1):119-123.
[4]黄支密,糜家睿,盛以泉,等.携带blaKPC2型碳青霉烯酶基因泛耐药肺炎克雷伯菌院内感染暴发的病原学分析[J].中华流行病学杂志,2010,31(5):559-562.
[5]杨启文,郑瑞,王辉,等.改良Hodge试验检测肠杆菌科细菌碳青霉烯酶的性能评估[J].中华检验医学杂志,2010,33(12):1122-1127.
[6]Anderson KF,Lonsway DR,Rasheed JK,et al.Evaluation of methods to identify the Klebsiella pneumoniae carbapenemase in Enterobacteriaceae[J].J Clin Microbiol,2007,45(8):2723-2725.
[7]俞云松.细菌β-内酰胺酶检测的临床意义[J].中华结核和呼吸杂志,2008,31(6):475-477.
Detection and analysis of carbapenemase in multi-drug resistant Klebsiella pneumoniae
WANGPengkun,CHENDingqiang,YUHui
(DepartmentofClinicalLaboratory,FirstAffiliatedHospital,GuangzhouMedicalUniversity,Guangzhou,Guangdong510120,China)
Objective To investigate the prevalence of carbapenemases in Klebsiella pneumoniae clinical isolates.Methods One hundred and fifty-one multi-drug resistant K.pneumoniae strains were collected in our hospital from January 2007 to December 2012 and the drug susceptibility results were analyzed.The carbapenemase phenotype test was used for conducting the detection.The PCR was used to detect the known carbapenemases gene.The amplification products were further sequenced to determine the genotypes.Results Among 151 strains of multi-drug resistant K.pneumoniae,12 strains possibly producing carbapenemase were screened by the modified Hodge test,in which 1 strain was positive in the metalloenzyme test.Among these 12 strains,5 strains producing carbapenemases were confirmed by PCR amplification and sequencing,the metalloenzyme positive strain was the type IMP-4 metalloenzyme and other 4 carbapenemase- producing strains were the type KPC-2.Conclusion Multi-drug resistant K.pneumoniae appears the strain producing carbapenemase in our hospital in recent years.Clinic should rational select carbapenem drugs according to the drug susceptibility test results for preventing the generation of drug-resistant strain.
Klebsiella pneumoniae; carbapenemase; multi-drug resistance; PCR
王鹏鲲,男,主管技师,主要从事临床检验研究。
10.3969/j.issn.1673-4130.2016.24.015
A
1673-4130(2016)24-3423-03
2016-09-11
2016-10-29)
