术前选择性动脉栓塞联合腹腔镜肿瘤剜除术在肾错构瘤中的应用
2017-01-06纪志刚李汉忠
王 栋 纪志刚 李汉忠
(中国医学科学院北京协和医学院 北京协和医院泌尿外科,北京 100730)
·临床论著·
术前选择性动脉栓塞联合腹腔镜肿瘤剜除术在肾错构瘤中的应用
王 栋 纪志刚*李汉忠
(中国医学科学院北京协和医学院 北京协和医院泌尿外科,北京 100730)
目的 探讨术前选择性动脉栓塞联合腹腔镜肿瘤剜除术治疗肾错构瘤的临床价值。 方法 2013年7月~2014年11月我科施行腹腔镜保留肾单位手术治疗肾错构43例,其中术前选择性动脉栓塞19例(栓塞组),未栓塞24例(非栓塞组),比较2组术中出血量、手术时间、热缺血时间、住院时间、并发症发生情况、术后3个月肾功能变化和肿瘤复发情况。结果 栓塞组行肿瘤剜除术比例为100%(19/19),非栓塞组62.5%(15/24),无统计学差异(Fisher检验,P=0.105);栓塞组术中出血量(46.4±20.6)ml,明显少于非栓塞组(89.5±30.4)ml(t=-5.287,P=0.000);栓塞组手术时间(90.3±21.1)min明显短于非栓塞组(131.7±18.6)min(t=-6.831,P=0.000),热缺血时间(9.5±5.7)min明显短于非栓塞组(24.2±4.8)min(t=-9.181,P=0.000);栓塞组住院时间(7.7±1.1)d,明显长于非栓塞组(6.3±1.3)d(t=3.748,P=0.000)。栓塞组无严重并发症发生,非栓塞组中尿漏及术区血肿各1例。术后3个月栓塞组血清肌酐(70.1±13.7)μmol/L,明显低于栓塞组(84.2±9.1)μmol/L(t=-4.045,P=0.000);栓塞组肾小球滤过率(72.6±12.8)ml·min-1·1.73 m-2,非栓塞组(68.0±10.7)ml·min-1·1.73 m-2,无统计学差异(t=1.284,P=0.206)。2组术后平均随访分别8.9月(3~22个月)和7.5月(5~19个月),均无肿瘤复发。 结论 与单纯腹腔镜肾部分切除术相比,联合选择性动脉栓塞的肿瘤剜除术能减少术中出血量并缩短热缺血时间,从而更好地保护患肾功能,治疗体积较小的肾错构瘤是安全可行的。
肾错构瘤; 腹腔镜; 肿瘤剜除术; 选择性动脉栓塞
肾错构瘤,又称肾血管平滑肌脂肪瘤(renal angiomyolipoma,RAML),是一种常见的肾脏良性肿瘤。RAML直径>4 cm存在破裂出血的可能[1],故多需要手术治疗。由于其良性属性,治疗上应尽可能采取创伤小的腹腔镜手术并尽量保护患肾的功能。近年来,随着先进影像学检查技术的普及,越来越多的RAML早期即被发现[2],这些RAML体积通常较小,为实施腹腔镜下保留肾单位手术(nephron-sparing surgery,NSS)提供了条件。但腹腔镜下肾部分切除术具有一定的操作难度,术中热缺血时间(warm ischemia time,WIT)随之延长,从而加重患肾功能的损害[3]。因此,缩短腹腔镜NSS过程中的热缺血时间对于保护患肾的功能尤为重要。2013年7月~2014年11月我科施行腹腔镜下NSS治疗RAML 43例,其中19例术前行选择性动脉栓塞(preoperative selective arterial embolization,PSAE),且通过肿瘤剜除的方式切除肿瘤(栓塞组),24例未行动脉栓塞(非栓塞组)。本文对2组进行比较,旨在探讨联合术前选择性肾动脉栓塞的腹腔镜肾肿瘤剜除术在术中减少肾功能损害中的作用,现报道如下。
1 临床资料与方法
1.1 一般资料
在充分告知的前提下,按照患者的意愿,将43例RAML分为栓塞组和非栓塞组。栓塞组腹膜后血肿和腰腹部疼痛各2例,非栓塞组2例腹膜后血肿和1例腰腹部疼痛,其余患者均无临床症状和体征,体检发现。术前经腹部增强CT明确诊断(图1)。2组一般资料比较无显著性差异(P>0.05),有可比性(表1)。
病例选择标准:①肿瘤直径4~8 cm,存在破裂出血的可能;②肿瘤位于单侧肾脏且为单发;③肿瘤位于肾实质周边;④腹部增强CT肾脏占位可见脂肪成分,临床诊断为肾错构瘤;⑤无严重内外科禁忌证,患者要求手术治疗。

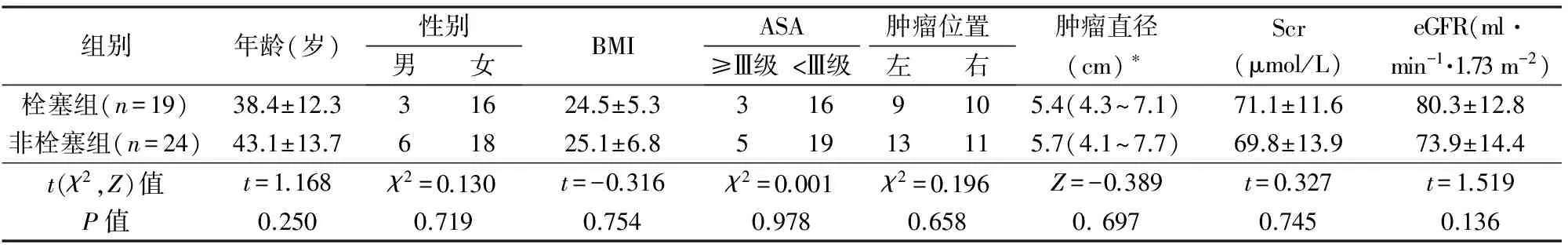
组别年龄(岁)性别男女BMIASA肿瘤位置≥Ⅲ级<Ⅲ级左右肿瘤直径(cm)∗Scr(μmol/L)eGFR(ml·min-1·1.73m-2)栓塞组(n=19)38.4±12.331624.5±5.33169105.4(4.3~7.1)71.1±11.680.3±12.8非栓塞组(n=24)43.1±13.761825.1±6.851913115.7(4.1~7.7)69.8±13.973.9±14.4t(χ2,Z)值t=1.168χ2=0.130t=-0.316χ2=0.001χ2=0.196Z=-0.389t=0.327t=1.519P值0.2500.7190.7540.9780.6580.6970.7450.136
BMI:体重指数;ASA:美国麻醉医师协会分级;Scr:血清肌酐;eGFR:肾小球滤过率估算值;*中位数(最小值~最大值)
1.2 方法
选择性动脉栓塞:仰卧位。于腹股沟股动脉走行处行局部麻醉,经股动脉穿刺置导管,行患侧肾动脉造影,以明确肿瘤血供。然后将导管置入欲栓塞的肿瘤的供血动脉,根据供血动脉的具体情况选用栓塞剂,在尽可能完全栓塞肿瘤血供的同时保留更多的正常肾组织。栓塞后重复肾动脉造影以明确肿瘤血供的栓塞情况。栓塞后常规预防性给予非甾体抗炎药和镇静处理以减轻栓塞后综合征的影响,制动12 h以防止动脉穿刺处出血,手术均于栓塞后24 h内进行。
后腹腔镜下NSS:全麻,健侧卧位。于患侧腋中线髂嵴上2 cm处置入10 mm trocar并置入腹腔镜,于同侧腋后线、第12肋尖下2 cm置入10 mm trocar,同侧腋前线平行于第12肋尖放置5 mm trocar。术中先充分游离患肾及肿瘤,完成游离后,非栓塞组常规阻断肾动脉,栓塞组根据肿瘤血供的阻断情况决定是否阻断肾动脉:对栓塞完全的病例,不进行肾动脉阻断;对栓塞不完全的病例,则常规阻断肾动脉。考虑到肿瘤的良性属性及保留肾实质的需要,术中尽可能以吸引器或抓钳来剜除肿瘤组织,但对于肿瘤与肾实质分界不清的病例,则通过肾部分切除的方式切除肿瘤。在创面的处理上,首先,2-0 Dexon线“8”字缝合肾实质创面,再以带倒刺的Quill可吸收线全层缝合肾脏实质,线尾用Hem-o-lok固定。缝合满意后,移除肾动脉阻断,恢复肾脏血供。检查创面无活动性出血后,由腋中线10 mm trocar置入标本袋并取出标本。均在腋后线10 mm trocar留置肾周引流管1根,移除手术器械,可吸收3-0 Dexon线缝合皮肤切口。
术后2 d患者下地活动,活动后肾周引流量<10 ml/d拔除引流管。
1.3 观察指标
手术时间(从切皮至缝合皮肤伤口的时间)、术中出血量(吸引器瓶中液体减去术中冲洗量)、WIT(肾动脉阻断时间)、住院时间(出院标准:体温正常,切口愈合)、并发症、术后3个月血清肌酐(serum cretine, Scr)和肾小球滤过率估算值(estimated glomerular filtration rate, eGFR)。
1.4 随访
术后3个月进行第1次随访,随访内容包括Scr和eGFR的变化情况,腹部CT检查是否肿瘤复发,此后每半年随访1次。
1.5 统计学处理

2 结果
2.1 栓塞情况
2例因肿瘤破裂出血行急诊栓塞,其余17例均为术前择期栓塞。栓塞前肾动脉造影清晰显示肿瘤的供血情况(图2),其中16例为单支动脉供血,2例为2支动脉供血,1例为3支动脉供血。所用的栓塞材料包括明胶海绵、碘化油或其组合物,栓塞后重复肾动脉造影证实16例肿瘤的供血动脉完全被栓塞(图3),3例血供大部被栓塞。栓塞过程顺利,栓塞后仅2例出现轻度栓塞后综合征,表现为发热和腹痛各1例,经过对症处理均缓解。
2.2 围术期的一般情况和并发症
43例均完成腹腔镜下NSS。非栓塞组术中常规行肾动脉阻断,其中肾部分切除术9例,肿瘤剜除术15例;栓塞组中仅3例行肾动脉阻断,均行肿瘤剜除术。栓塞组手术时间、WIT和术中出血量明显少于非栓塞组(P<0.05),栓塞组住院时间明显长于非栓塞组(表2)。
2.3 围术期并发症的比较
非栓塞组围术期并发症发生率12.5%(3/24),其中术后漏尿、切口感染及术区血肿各1例;栓塞组围术期并发症发生率为5.3%(1/19),此例为术中胸膜损伤、术后气胸。2组围术期并发症发生率无显著性差异,见表2。
2.4 术后肿瘤复发和肾功能变化的情况
2组术后平均随访分别8.9月(3~22个月)和7.5月(5~19个月),均无肿瘤复发(图4)。术后3个月复查,栓塞组血Scr明显低于非栓塞组(P<0.05),但2组eGFR无显著性差异,见表2。

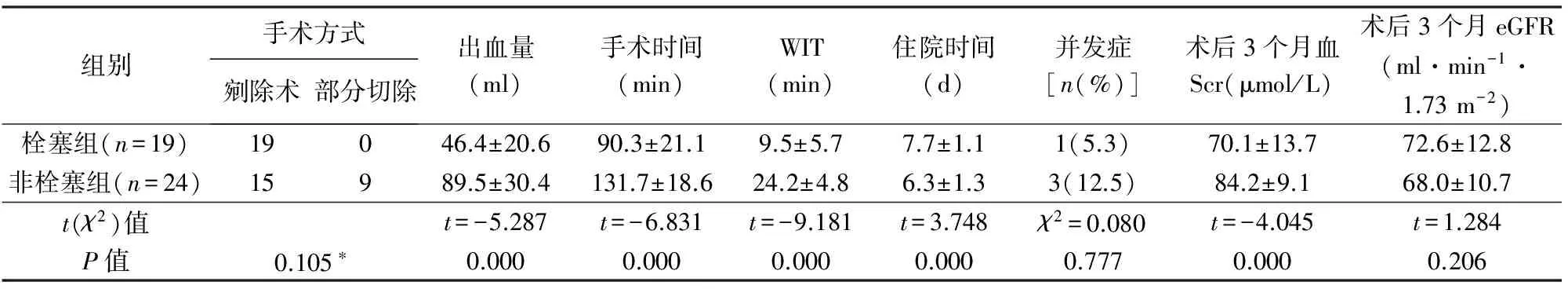
组别手术方式剜除术部分切除出血量(ml)手术时间(min)WIT(min)住院时间(d)并发症[n(%)]术后3个月血Scr(μmol/L)术后3个月eGFR(ml·min-1·1.73m-2)栓塞组(n=19)19046.4±20.690.3±21.19.5±5.77.7±1.11(5.3)70.1±13.772.6±12.8非栓塞组(n=24)15989.5±30.4131.7±18.624.2±4.86.3±1.33(12.5)84.2±9.168.0±10.7t(χ2)值t=-5.287t=-6.831t=-9.181t=3.748χ2=0.080t=-4.045t=1.284P值0.105∗0.0000.0000.0000.0000.7770.0000.206
WIT:热缺血时间;Scr:血清肌酐;eGFR:肾小球滤过滤估算值;*Fisher检验

图1 女,60岁,腹部CT示左肾4.6 cm×6.3 cm错构瘤,内有脂肪成分 图2 选择性动脉造影示此错构瘤为单支动脉供血 图3 栓塞后重复造影示肿瘤的血运完全消失图4 接受栓塞及肿瘤切除,术后3个月复查CT未见肿瘤复发
3 讨论
RAML是一种良性肿瘤,在普通人群中的患病率为0.2%左右[1],由脂肪、血管和平滑肌等成分以不同的比例构成。因其血管中缺乏完整的内膜,故易发生自发性破裂出血,严重时甚至出现出血性休克,从而危及生命[4]。目前认为肿瘤直径>4 cm时破裂出血的风险明显增加,因此,直径>4 cm的错构瘤多需要进行治疗。腹腔镜肾部分切除术能够在减少创伤的同时达到保留患侧肾单位的目的[5],成为治疗RAML一种较理想的方式。
RAML内部的血管非常丰富,在肾脏及肿瘤的手术游离过程中可能出现难以控制的大出血,严重时甚至被迫切除患侧肾脏[6]。另外,相对于传统的开放手术,腹腔镜下进行肿瘤切除及肾实质缝合的难度增大,使围术期并发症发生率相应增加,导致术中WIT明显延长[7]。尤其是WIT,目前认为30 min为其临界值,超过此时限肾脏功能将不可逆的损伤[8],甚至有学者认为只要存在热缺血就会造成肾功能不可逆的损害[9]。控制术中肿瘤的出血并降低腹腔镜下保留肾单位的手术难度才能有效地保护患肾功能。
Singla等[10]和Boorjian等[11]此前已报道在开放性手术切除体积较大的RAML之前,可利用选择性栓塞肿瘤供血动脉的方法来减少术中出血、降低手术难度,并取得较好的效果。Luo等[12]认为部分病例甚至可以在不阻断肾门的情况下完成手术,从而减少或避免肾实质的热缺血。本研究通过PSAE来降低腹腔镜下保留肾单位的手术难度,并尝试在不进行肾动脉阻断的情况下进行手术。栓塞组完全栓塞率84.2%(16/19),其余3例肿瘤供血动脉也大部分阻断,证实选择性动脉栓塞能够有效阻断肿瘤的动脉供血。与文献[4,13]报道相比,本研究栓塞后综合征发生率较低,可能与栓塞后预防性应用非甾体阵痛消炎药有关。
因肾部分切除术会导致肾脏实质损伤,并会造成额外出血。目前,已有文献[14~16]报道可通过肿瘤剜除术的方式切除肾错构瘤,从而保留更多的肾脏实质组织,减少肾实质损伤所导致的并发症及术中出血。本研究中我们尽可能采取肿瘤剜除的手术方式,仅在肿瘤边界不清晰的情况下采用肾部分切除术。由于栓塞后肿瘤与正常肾实质间形成水肿界线,且栓塞消除了创面渗血对手术视野的影响,栓塞组采用肿瘤剜除术的比例高于非栓塞组。栓塞组中84.2%的患者术中未进行肾动脉阻断,这是由于肿瘤的血供被阻断,同时肿瘤剜除术避免肾实质的损伤出血[14~16]。考虑到栓塞后肿瘤周边的炎症随着时间的延长会形成粘连,影响手术操作、增加手术难度[17],所有栓塞的患者均于栓塞后24 h内进行手术。
栓塞组手术时间、术中出血量和WIT均较非栓塞组明显缩短减少(P<0.05)。肿瘤剜除术降低了切除肿瘤的难度,从而直接导致手术时间的缩短;术中出血量的减少主要是由于肿瘤血供的阻断,减少游离过程中肿瘤破裂出血的几率;栓塞组WIT的缩短,主要是由于多数病例可通过非阻断肾动脉的方式来完成手术,同时肿瘤剜除术降低肿瘤切除的难度,也在一定程度上缩短WIT。
2组并发症发生率方面无显著性差异(χ2=0.080,P=0.777),但非栓塞组出现2例严重并发症(尿漏和术区血肿各1例)。尿漏是肾部分切除术中较常见的严重并发症,可因肿瘤切除过程中界限不清、过多切除肾脏实质而导致。栓塞组19例均采用肿瘤剜除术,从而避免正常肾脏实质的损伤。术区血肿是由于术后出血,多为肾脏实质缝合时不能确实地止血,是肾部分切除术后的严重问题[6]。由于栓塞组中多数病例未进行肾门的阻断,术区有限的出血点可以清晰显露,同时由于没有热缺血时间的限制,从而可以对创面的出血点从容地进行缝合止血,最大程度地避免术后出血的发生[9]。另一方面,栓塞组住院时间长于非栓塞组(t=3.748,P=0.000),主要是由于术前的栓塞过程延长了住院日。
术后3个月栓塞组Scr优于未栓塞组(t=-4.045,P=0.000),也支持选择性动脉栓塞在减少WIT、保护肾功能方面的作用,提示腹腔镜下肿瘤剜除术可以在RAML治疗中得到进一步的应用。虽然2组eGFR无显著性差异(t=1.284,P=0.206),但考虑到诸如Scr、体重等因素都可影响eGFR,而术后短期的生活习惯可能变化较大,进而影响eGFR的结果,因而需要对2组的eGFR进行更长时间的观察。
1 Nelson CP, Sanda MG. Contemporary diagnosis and management of renal angiomyolipoma. J Urol,2002,168 (4 Pt 1):1315-1325.
2 Ljungberg B, Cowan NC, Hanbury DC, et al. EAU guidelines on renal cell carcinoma: the 2010 update. Eur Urol,2010,58(3):398-406.
3 Becker F, Van Poppel H, Hakenberg OW, et al. Assessing the impact of ischaemia time during partialnephrectomy. Eur Urol,2009,56(4):625-634.
4 Chick CM, Tan BS, Cheng C, et al. Long-term follow-up of the treatment of renal angiomyolipomas after selective arterial embolization with alcohol. BJU Int,2010,105(3):390-394.
5 Gill IS, Kamoi K, Aron M, et al. 800 Laparoscopic partial nephrectomies: a single surgeon series. J Urol,2010,183(1):34.
6 De Luca S, Terrone C, Rossetti SR. Management of renal angiomyolipoma: a report of 53 cases.BJU Int,1999,83(3):215-218.
7 Gill IS, Matin SF, Desai MM, et al. Comparative analysis of laparoscopic versus open partial nephrectomy for renal tumors in 200 patients. J Urol,2003,170(1):64-68.
8 Choi JD, Park JW, Lee SY, et al. Does prolonged warm ischemia after partial nephrectomy under pneumoperitoneum cause irreversible damage to the affected kidney? J Urol,2012,187(3):802-806.
9 Gill IS, Patil MB, Abreu AL, et al. Zero ischemia anatomical partial nephrectomy: a novel approach. J Urol,2012,187(3):807-814.
10 Singla A, Chaitanya Arudra SK, Bharti N. Giant sporadic renal angiomyolipoma treated with nephron-sparing surgery. Urology,2009,74(2):294-295.
11 Boorjian SA, Frank I, Inman B, et al. The role of partial nephrectomy for the management of sporadic renal angiomyolipoma. Urology,2007,70(6):1064-1068.
12 Luo Y, Hou G, Lu M, et al. Unclamped nephron-sparing surgery with preoperative selective arterial embolization for the management of bilateral giant renal angiomyolipomas. Clin Genitourin Cancer,2014,12(3):111-114.
13 Han YM, Kim JK, Roh BS, et al. Renal angiomyolipoma: selective arterial embolization-effectiveness and changes in angiomyogenic components in long-term follow-up.Radiology,1997,204(1):65-70.
14 Xu B, Zhang Q, Jin J. Laparoscopic aspiration for central renal angiomyolipoma: a novel technique based on single-center initial experience. Urology,2013, 81(2):313-318.
15 Minervini A, Giubilei G, Masieri L, et al. Simple enucleation for the treatment of renal angiomyolipoma. BJU Int,2007,99(4):887-891.
16 Siena G, Minervini A, Tuccio A, et al. Nephron-sparing surgery for giant angiomyolipomas of kidney. Arch Ital Urol Androl,2012,84(3):146-150.
17 Lee SY, Hsu HH, Chen YC, et al. Embolization of renal angiomyolipomas: short-term and long-term outcomes, complications, and tumor shrinkage. Cardiovasc Intervent Radiol,2009,32(6):1171-1178.
17 李 宁,许 为.子宫动脉栓塞术后宫腔粘连2例报告.中国微创外科杂志,2013,13(7): 667-669.
(修回日期:2015-11-18)
(责任编辑:李贺琼)
Laparoscopic Enucleation with Preoperative Selective Arterial Embolization for Renal Angiomyolipomas
WangDong,JiZhigang,LiHanzhong.
DepartmentofUrology,PekingUnionMedicalCollegeHospital,ChineseAcademyofMedicalSciences&PekingUnionMedicalCollege,Beijing100730,China
Correspondingauthor:JiZhigang,E-mail:jellowaaa7@163.com
Objective To study the initial experience and outcomes of laparoscopic enucleation with preoperative selective arterial embolization (PSAE) for the treatment of renal angiomyolipomas. Methods A total of 43 patients with sporadic renal angiomyolipomas from July 2013 to November 2014 underwent laparoscopic nephron-sparing surgery (NSS). The patients were divided into either PSAE group (n=19) or non-PSAE group (n=24). The data of patient demographics, success rate of surgery, perioperative complications rate, operating time (OT), warm ischemia time (WIT), estimated blood loss (EBL), length of hospitalization, kidney estimated glomerular filtration rate (eGFR) and serum creatinine (Scr) level over 3 months, and ipsilateral recurrence were collected and compared between the two groups. Results Enucleation was successful in 100% patients (19/19) of the PSAE group and in 62.5% patients (15/24) of the non-PSAE group,with no significant difference (Fisher’s test,P=0.105) The EBL was (46.4±20.6) ml in the PSAE group, which was significantly less than the non-PSAE group [(89.5±30.4) ml,t=-5.287,P=0.000]. The OT and WIT were significantly shorter in the PSAE group than those in the non-PSAE group [(90.3±21.1) min vs. (131.7±18.6) min,t=-6.831,P=0.000; (9.5±5.7) min vs. (24.2±4.8) min,t=-9.181,P=0.000]. The length of hospitalization was significantly longer in the PSAE group than that in the non-PSAE group [(7.7±1.1) d vs. (6.3±1.3) d,t=3.748,P=0.000]. No severe complications occurred in the PSAE group, whereas the non-PSAE group had 1 case of urinary leakage and 1 case of hematoma. The Scr level over 3 months after surgery was more ideal in the PSAE group [(70.1±13.7) μmol/L vs. (84.2±9.1) μmol/L,t=-4.045,P=0.000]. No statistically significant difference was found in the eGFR between the PSAE group and the non-PSAE group [(72.6±12.8) ml·min-1·1.73 m-2vs. (68.0±10.7) ml·min-1·1.73 m-2,t=1.284,P=0.206]. No evidence of recurrence was found during follow-up period in both groups. Conclusions Laparoscopic enucleation with PSAE is a safe and effective minimally invasive procedure for the treatment of renal angiomyolipomas. As compared to traditional laparoscopic partial nephrectomy, it has advantages of less WIT, less EBL, and better protection of renal functions. It can be recommended in well-selected patients.
Renal angiomyolipomas; Laparascopy; Enucleation; Arterial embolization
A
1009-6604(2016)02-0101-05
10.3969/j.issn.1009-6604.2016.02.002
2015-05-24)
*通讯作者,E-mail:jellowaaa7@163.com
