阿瑞匹坦预防中重度致吐性方案所致化疗相关性呕吐的临床疗效疗效观察①
2017-01-05曲雁红
曲雁红
(辽宁省大连市第三人民医院肿瘤二病房, 辽宁 大连 116033)
阿瑞匹坦预防中重度致吐性方案所致化疗相关性呕吐的临床疗效疗效观察①
曲雁红
(辽宁省大连市第三人民医院肿瘤二病房, 辽宁 大连 116033)
目的:观察阿瑞匹坦预防中重度致吐性方案所致化疗相关性呕吐的临床效果。方法:在我院肿瘤内科接受中重度致吐性方案化疗的肿瘤患者中选择给予托烷司琼联合地塞米松止吐后呕吐依然≥2级、需追加其它止吐药物解救治疗的患者80例作为研究对象,于第二周期同一方案化疗期间给予阿瑞匹坦止吐,应用阿瑞匹坦前的止吐情况视为对照组,应用阿瑞匹坦后的止吐情况视为观察组;比较患者应用阿瑞匹坦前后的止吐效果和耐受情况。结果:对照组和观察组的首次呕吐时间分别为(16.4±2.3)h和(32.4±5.9)h,差异具有统计学意义(P<0.05);观察组的呕吐有效控制率高于对照组,差异具有统计学意义(P<0.05);观察组和对照组的不良反应差异具有统计学意义(P<0.05),但不良反应均为1级。结论:阿瑞匹坦预防中重度致吐性方案所致化疗相关性呕吐的疗效和耐受性均良好,利于提高患者的生活质量和化疗的效果。
阿瑞匹坦; 托烷司琼; 中重度致吐性方案; 化疗相关性呕吐
本研究主要观察了阿瑞匹坦预防中重度致吐性方案所致化疗相关性呕吐的临床效果,现将有关资料整理报告如下:
1 资料与方法
1.1 纳入标准:①经组织学或细胞学确诊为恶性肿瘤患者,均接受第1周期的化疗,化疗方案均为中重度致吐性方案;②ECOG状态评分0~2分;③血常规、肝功能、肾功能等实验室检查及心电图检查正常、无其他化疗禁忌证且未接受过放射治疗者;④预计能完成≥4个化疗周期且生存期≥6个月;⑤纳入研究前前1个月内无明显恶心呕吐症状,且无使用止吐药物治疗史;⑥与患者充分沟通,患者知情同意并签署知情同意书。
1.2 排除标准:①因颅内高压、消化道梗阻以及其他原因导致的顽固性呕吐;②颅内出现未控制转移灶患者;③已行脑、腹腔、盆腔放疗患者;④患有精神系统疾病者;⑤目前正在使用吗丁啉等胃肠动力药物;⑥依从性差,无法配合观察胃肠道不良反应,中途退出试验者。
1.3 一般资料:选择2014年3月至2016年3月于我院住院治疗的80例恶性肿瘤患者作为研究对象。其中,男性48例,女性32例;年龄22~78岁,中位年龄63岁;原发性肿瘤:肺癌31例,胃癌11例,乳腺癌13例,淋巴瘤7例,食管癌7例,肠癌6例,其他肿瘤5例;肿瘤分期Ⅱ期13例,Ⅲ期55例,Ⅳ期12例。
1.4 治疗方案:纳入研究的80例患者均接受了中重度致吐的化疗方案,具体为:铂类药物(顺铂≥70mg/m2,卡铂≥300mg/m2,奥沙利铂130mg/m2),环磷酰胺≥600~1000mg/m2,表阿霉素≥75mg/m2,伊立替康200mg/m2,1个治疗周期为21d。在第1个治疗周期,所有患者给予5-HT3受体拮抗剂(托烷司琼,5.0mg静脉注射,每天1次)联合地塞米松(8.0mg静脉注射,1次/d)抑制化疗相关性恶心和呕吐。从第2个治疗周期开始,在上述止吐方案基础加用阿瑞匹坦,具体为:第1d,化疗前60min给予阿瑞匹坦125mg,口服;第2~3d,化疗前60min给予阿瑞匹坦80mg,口服;托烷司琼和地塞米松的用法用量与第1个治疗周期相同。解救药物由主治医师研究确定,每天记录住院患者的恶心和呕吐情况以及所使用的解救药物。
1.5 观察内容:记录每个化疗周期开始一直到化疗结束后5d内的首次呕吐时间、呕吐控制情况以及不良反应。呕吐控制情况参考国家癌症研究所指定的常见不良事件评价标准(CTCAE)3.0版[1]关于肠胃不良发应的评价标准:①完全缓解(CR):无呕吐,不需要解救药物治疗;②部分缓解(PR):呕吐次数1~2次/d;③轻度缓解(MR):呕吐次数3~5次/d;④无效(F):呕吐次数≥6次。有效控制率=[(CR+PR)÷总例数]×100%。
1.6 统计学处理:本组数据采用SPSS15.0软件包进行统计学处理,计数资料用率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 化疗情况:纳入研究的80例患者均接受了中重度致吐的化疗方案,在第1个治疗周期所有患者给予托烷司琼联合地塞米松抑制呕吐,但依然出现≥2级的呕吐需追加其它止吐药物解救治疗;从第2个治疗周期开始,在上述止吐方案基础加用阿瑞匹坦,80例患者均完成了计划的化疗方案,周期为4~6个化疗周期。
2.2 首次呕吐时间:第1个化疗周期(对照组)和第2个化疗周期(观察组)的首次呕吐时间分别为(16.4±2.3)h和(32.4±5.9)h,差异具有统计学意义(t=7.635,P=0.002)。
2.3 呕吐控制情况:第2个化疗周期(观察组)的呕吐有效控制率高于第1个化疗周期(对照组),差异具有统计学意义(P<0.05),具体见表1。
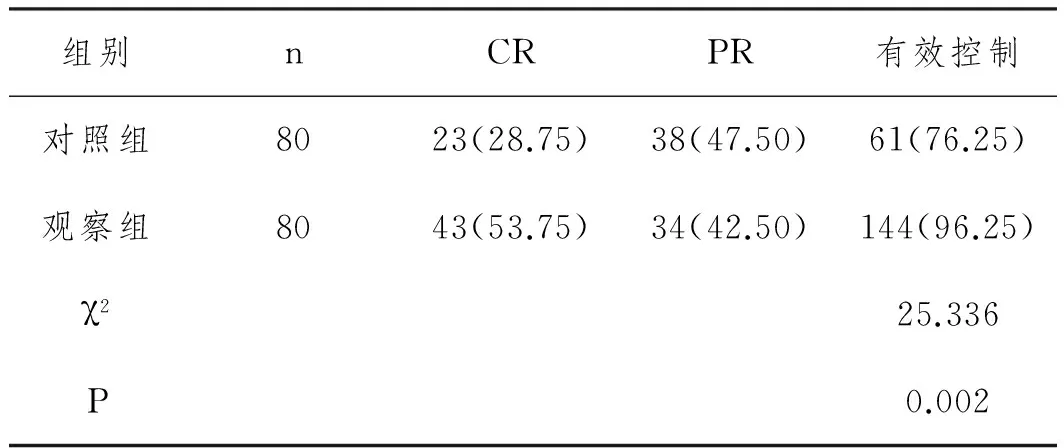
表1 对照组和观察组的呕吐控制情况比较n(%)
2.4 不良反应:第1个化疗周期(对照组)和第2个化疗周期(观察组)的不良反应均为1级,均未出现严重的电解质紊乱、头痛及高血糖等不良反应。但观察组在食欲减退、乏力、便秘三个方面出现不良发应的比例较对照组有提高。见表2。

表2 对照组和观察组的不良反应情况比较n(%)
3 讨 论
本研究所纳入的80例恶性肿瘤患者均接受的是中重度致吐性化疗方案,即便是在化疗结束后,仍然会在化疗结束后的3~5d乃至更长时间内存在恶心、呕吐的症状,这必然会降低患者对化疗的治疗依从性,影响治疗效果。想要确保癌症患者顺利完成化疗方案,尽可能地预防、减轻因此导致的恶心、呕吐是非常关键而且重要的环节之一[2]。
一般认为,造成化疗相关性恶心呕吐的机制主要表现在下述几方面:①化疗药物会对患者的肠胃产生强烈刺激,而肠胃系统在刺激下释放的神经递质(多巴胺、组胺、5-HT、P物质等)在和相应受体结合之后会产生神经冲动,经由交感神经、迷走神经传递至中枢神经系统之后便会表现为恶心、呕吐症状[3];②化疗药物以及药物产生的代谢物均会对化学受体激发区产生直接刺激,该刺激传递至中枢神经系统之后便会表现为恶心、呕吐症状。 呕吐机制的复杂性和难抑制性使得多程化疗的止吐治疗非常困难,在多程化疗过程中,患者会出现急性呕吐、延迟性呕吐、预期性呕吐等。5-HT3受体拮抗剂联合地塞米松依然是目前临床上常用的用于抑制化疗相关性恶心和呕吐的治疗方案,但多程化疗的应用效果不甚理想。阿瑞匹坦是针对人类P物质/NK-1受体的一种高选择性、高亲和力阻断剂,其中对于NK-1受体的选择性是其他受体(如5-HT、多巴胺等受体)的3000倍,而且药物能够经过血脑屏障,进而通过对中枢神经系统的抑制而抑制化疗过程中的恶心和呕吐。
本研究结果显示,在第2个治疗周期加用阿瑞匹坦之后,首次呕吐时间较第1个治疗周期出现了延迟[(32.4±5.9)hVS(16.4±2.3)h],同时,对于呕吐的有效控制率有了提升;第2个化疗周期(观察组)在在食欲减退、乏力、便秘三个方面出现不良发应的比例较对照组有了提高,但两组的不良反应均为1级,均未出现严重的电解质紊乱、头痛及高血糖等不良反应,而且80例患者均完成了4~6周期的计划化疗方案,提高了治疗依从性。
[1] 周际昌.实用肿瘤内科学[M].第2版.北京:人民卫生出版社,2011.386~388.
[2] 胡夕春.肿瘤内科方案的药物不良反应及对策[M].北京:人民卫生出版社,2009.50~55.
[3] 孟文静,汪旭,贾勇圣,等.阿瑞匹坦预防高致吐性化疗所致恶心呕吐的效果和安全性评价[J].吉林大学学报(医学版),2016,42(2):331~335.
① 【基金项目】中国高校医学期刊临床专项资金项目,(编号:112210454)
1006-6233(2016)12-2016-03
A 【doi】10.3969/j.issn.1006-6233.2016.12.032