精脒对SW620细胞增殖及糖酵解的影响
2017-01-05张芬吴燕燕臧林泉潘雪刁王桂香
张芬,吴燕燕,臧林泉,潘雪刁,王桂香
(广东药科大学 药科学院,广东 广州 510006)
精脒对SW620细胞增殖及糖酵解的影响
张芬,吴燕燕,臧林泉,潘雪刁,王桂香
(广东药科大学 药科学院,广东 广州 510006)
目的 探讨精脒对人结肠癌SW620细胞增殖及糖酵解的影响。方法 以SW620细胞为研究对象,用0.625~2.5 μmoL/L精脒(SPD)作用于细胞,细胞密度以104个/mL接种于96孔培养板,分别培养24 h后,MTT法检测细胞增殖情况;同时,取6孔板培养24 h的细胞上清液,用试剂盒检测SW620细胞葡萄糖消耗及乳酸水平;细胞密度以1.2×105个/mL接种于6孔培养板中,培养24 h后加入不同浓度SPD,继续培养24 h后,Western blot检测缺氧诱导因子(HIF-1)、乳酸脱氢酶(LDHA)及葡萄糖转运蛋白1(GLUT1)表达的变化。结果 与对照组比较,精脒各浓度组均能促进SW620细胞的增殖(P<0.01),且促进作用呈剂量依赖性;精脒各浓度组作用后SW620细胞内葡萄糖的消耗及乳酸含量明显增多(P<0.01),呈剂量依赖性;与对照组比较,LDHA、HIF-1及GLUT1蛋白表达水平随着精脒浓度的升高而增加(P<0.01),且呈剂量依赖性。结论 精脒具有促进人结肠癌SW620细胞增殖及糖酵解的作用。
精脒; SW620细胞; 细胞增殖; 糖酵解
结肠癌是最常见的消化道恶性肿瘤之一,在全球恶性肿瘤的发生率和死亡率中,已跻身前3位,严重威胁到人类的健康[1]。对于细胞来说,能量主要来源于糖代谢。正常组织中大约有90%的ATP来源于线粒体的氧化磷酸化途径,只有10%的ATP来源于糖酵解途径。与之相反的是,肿瘤细胞中大约有50%的ATP是通过糖酵解途径合成的,而且即便是在有氧环境中,肿瘤细胞仍然偏好通过糖酵解途径提供能量并生成乳酸,这被称为瓦伯格效应(Warburg effect)[2]。
肿瘤组织细胞通过缺氧诱导因子1(hypoxia inducible factor 1,HIF-1)表达和转录活性的增强对其下游基因进行调控,改变肿瘤细胞内葡萄糖转换、新陈代谢、血管生成和细胞寿命[3],受HIF-1调控的糖酵解相关基因包括葡萄糖转运蛋白1(GLUT1)、乳酸脱氢酶A(LDHA)[4]等。肿瘤细胞内HIF-1α蛋白水平的调控除了受到环境氧浓度影响外还存在其他调控机制,如c-myc能够促进HIF-1α蛋白表达、减少降解或激活其转录活性而影响糖酵解。
多胺是哺乳动物细胞中的一类带正电的烷基胺类小分子,包括腐胺(Putrescine,Pu)、精脒(Spermidine,SPD)和精胺(Spermine,Sm)。鸟氨酸脱羧酶(ODC)是多胺合成限速酶,同时ODC是致癌基因c-myc的靶基因,研究表明c-myc能够通过促进ODC的表达促进细胞的增殖[5]。由于多胺促进肿瘤细胞快速增殖的过程中势必会造成肿瘤细胞内部缺氧,而多胺同样受c-myc的调节,多胺是否参与肿瘤细胞的糖酵解值得探讨。本实验以人结肠癌细胞SW620为模型,探讨精脒对SW620细胞增殖及糖酵解的影响,为初步阐述多胺影响SW620结肠癌细胞糖酵解的机制提供依据。
1 材料
1.1 细胞、药物与试剂
SW620人结肠癌细胞(美国ATCC公司);SPD(美国Sigma,Lot:BCBK3554V);Anti-GLUT1、Anti-LDHA、Anti-HIF、ACTIN(Abcam公司);乳酸检测试剂盒(南京建成生物工程公司);MTT(GENVIEW,Lot:3911020250);H-DMEM高糖培养基、胎牛血清(美国Gibco公司);葡萄糖检测试剂盒(上海荣盛生物药业有限公司);羊抗兔二抗、羊抗小鼠二抗(杭州华安生物技术有限公司);PVDF膜(美国Millipore公司);其余试剂均为国产分析纯。
1.2 仪器
3111型恒温CO2细胞培养箱(美国Thermo公司);680型酶标仪(美国BIO-RAD公司); TD5K-Ⅱ型台式低速离心机(长沙东旺实验仪器有限公司);Multiskan FC型酶标仪、冷冻型多功能离心机(美国Thermo公司);SW-CJ-1FD型洁净工作台(苏州安泰空气技术有限公司)。
2 方法
2.1 细胞株及细胞培养
SW620人结肠癌细胞培养于含10%(φ)FBS的H-DMEM高糖培养基中,于37 ℃ 、5%CO2(φ)细胞培养箱内传代培养,细胞培养至12代时用于实验。
2.2 细胞增殖率检测
取对数生长期SW620细胞以104个/mL的密度接种于96孔培养板中,分为空白组(不含细胞)、对照组(Control)、SPD(0.625、1.25、2.5 μmoL/L)组,共5组,每组设5个平行孔。24 h后,弃去培养液,给药组加入含不同浓度的药物(空白组和Control加入无血清培养基),继续培养24 h后,每孔加入20 μL MTT溶液,避光,继续放入37 ℃、5%CO2恒温培养箱继续孵育4 h;终止培养,小心吸弃孔内的培养液,加入150 μL DMSO溶液,摇床上振荡10 min,使结晶充分溶解;酶标仪490 nm处测各孔吸光度A值。
细胞增殖率=(对照组A-给药组A)/(对照组A-空白组A)×100%
2.3 SPD对细胞摄取葡萄糖的影响
取对数生长期SW620细胞铺于6孔板中,分组同“2.2”,培养24 h后取上清液,加入各浓度SPD,继续培养24 h,用葡萄糖检测试剂盒检测,计算各组细胞的葡萄糖消耗量。按说明书要求,将工作液混合均匀,置于37 ℃温浴15 min,在波长505 nm 处,以空白调零,读取标准管和样品管的吸光值:标准品浓度为5.55 mmol/L,计算各组细胞的葡萄糖消耗量。
葡萄糖(mmol/L)=样品管吸光值(A)×标准液浓度/标准管吸光值(A)
2.4 细胞乳酸含量的检测
取对数生长期SW620细胞铺至6孔板中,分组同“2.2”,培养24 h后,加入各浓度SPD,继续培养24 h,用PBS清洗2次后,将培养板置于冰上,裂解液裂解,12 000 r/min离心10 min,取上清,用试剂盒检测乳酸含量,以空白组调零,在530 nm处检测吸光值(A)。
乳酸含量(mmol/L)=(样品A值/标准品A值)×标准品浓度(3 mmol/L)
2.5 HIF-1、LDHA、GLUT1蛋白表达的检测
取对数生长期SW620细胞以1.2×105个/mL密度接种于6孔培养板中,分为对照组、SPD(0.625、1.25、2.5 μmol/L)组,24 h后,弃去培养液,给药组加入含不同浓度的药物,对照组加入等量无血清培养基,继续培养24 h后,收集细胞,提取细胞总蛋白,BCA法进行总蛋白定量,电泳,转膜,封闭,显影及定影。用WO-9413B 型凝胶成像系统自带软件Gelpro 32分析胶片中的蛋白条带,以各组灰度面积的乘积/内参(β-actin)灰度面积的乘积反映相对蛋白表达丰度。
2.6 统计学处理
3 结果
3.1 SPD对SW620细胞增殖的影响
细胞培养24 h,与对照组比较,不同浓度的SPD作用于SW620细胞后,能明显促进细胞的增殖,且随着SPD浓度增大,其促进作用越明显(P<0.01),呈剂量依赖性,见表1。
表1 不同浓度SPD对SW620细胞增殖的影响

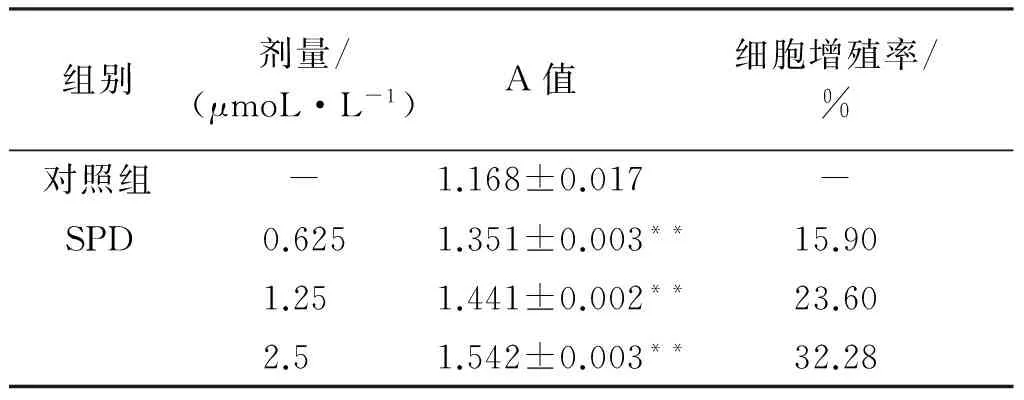
组别剂量/(μmoL·L-1)A值细胞增殖率/%对照组-1.168±0.017-SPD0.6251.351±0.003**15.901.251.441±0.002**23.602.51.542±0.003**32.28
与对照组比较:**P<0.01。
3.2 SPD对SW620细胞葡萄糖消耗和乳酸含量的影响
不同浓度SPD作用于SW620细胞24 h后,SW620细胞的葡萄糖消耗量和乳酸含量明显增加,与对照组比较,P<0.01,且随着SPD浓度增加,细胞产生的乳酸含量也越高,其促进葡萄糖消耗的作用也增强,呈剂量依赖性,见表2。
3.3 SPD对SW620细胞糖酵解相关蛋白表达的影响
结果见图1,不同药物处理24 h后,对照组HIF-1、LDHA 和GLUT1蛋白表达量明显低于SPD各浓度组,加入不同浓度SPD后,SW620细胞中HIF-1、LDHA和GLUT1各组的条带颜色均比对照组深(见图1A)。对条带的灰度值进行统计学分析,随着SPD浓度增加,3种蛋白表达水平也逐渐升高,且呈剂量依赖性,其中2.5 μmoL/L的SPD作用效果最明显,与对照组比较差异有统计学意义(P<0.01),见图1B~D。提示SPD可通过促进糖酵解相关基因HIF-1、LDHA 和GLUT1的蛋白表达从而促进SW620 细胞糖酵解。
表2 不同浓度SPD对SW620细胞葡萄糖消耗及乳酸含量的影响


组别剂量/(μmoL·L-1)葡萄糖消耗量/(mmol·L-1)乳酸含量/(mmol·L-1)对照组-5.428±0.0055.331±0.007SPD0.6255.731±0.007**6.176±0.009**1.256.915±0.007**7.215±0.012**2.57.503±0.003**7.665±0.012**
与对照组比较:**P<0.01。
4 讨论
多胺是调节细胞生长、发育和促进组织创伤愈合的细胞信号分子,是细胞生长和分化过程中不可缺少的物质,在快速增殖的组织细胞内多伴有多胺含量的增加,其在肿瘤患者的体液及尿液中的含量明显升高,已成为肿瘤的标志物[6]。ODC为多胺合成的限速酶,在许多上皮组织相关癌症如结肠癌和皮肤癌等的发生过程中,多胺浓度和多胺合成限速酶ODC表达显著增加[7-8]。同时ODC是致癌基因c-myc的靶基因,c-myc水平增加时,ODC基因启动子可与Myc/Max转录复合物结合,从而使ODC水平的增加,促进肿瘤细胞的增殖[9-10]。
研究发现,病理条件下如肿瘤环境中,缺氧诱导因子(HIF-1)和c-myc有协同作用,c-myc在常氧和乏氧条件下都可以促进HIF-1α的蛋白表达[11]。HIF-1是缺氧条件下广泛存在于哺乳动物和人体内的一种转录因子,在大多数肿瘤组织及其转移灶中高表达,且在缺氧诱导的基因表达调节中起着核心作用[12]。恶性肿瘤的最主要特征是肿瘤细胞难以控制的生长,肿瘤细胞数不断增加导致细胞内供氧不定,造成癌组织内乏氧微环境的形成,进而导致HIF表达的增多。同时研究发现HIF-1可激活或诱导其下游靶基因如GLUT-1、LDHA、血管内皮生长因子等的表达[13],以提高葡萄糖转运、糖酵解及血管生成,使肿瘤适应缺氧环境而继续增殖、浸润和转移。一方面GLUT-1是目前已知体内分布最为广泛的葡萄糖转运体,是调节葡萄糖转运的主要因子[14],HIF-1表达增加,激活葡萄糖转运蛋白基因如GLUT1表达,促进糖代谢,从而满足肿瘤生长的能量需求。另一方面,糖代谢途径表明,一旦机体处于低氧代谢状态,其无氧酵解就相对活跃,LDHA是无氧酵解中
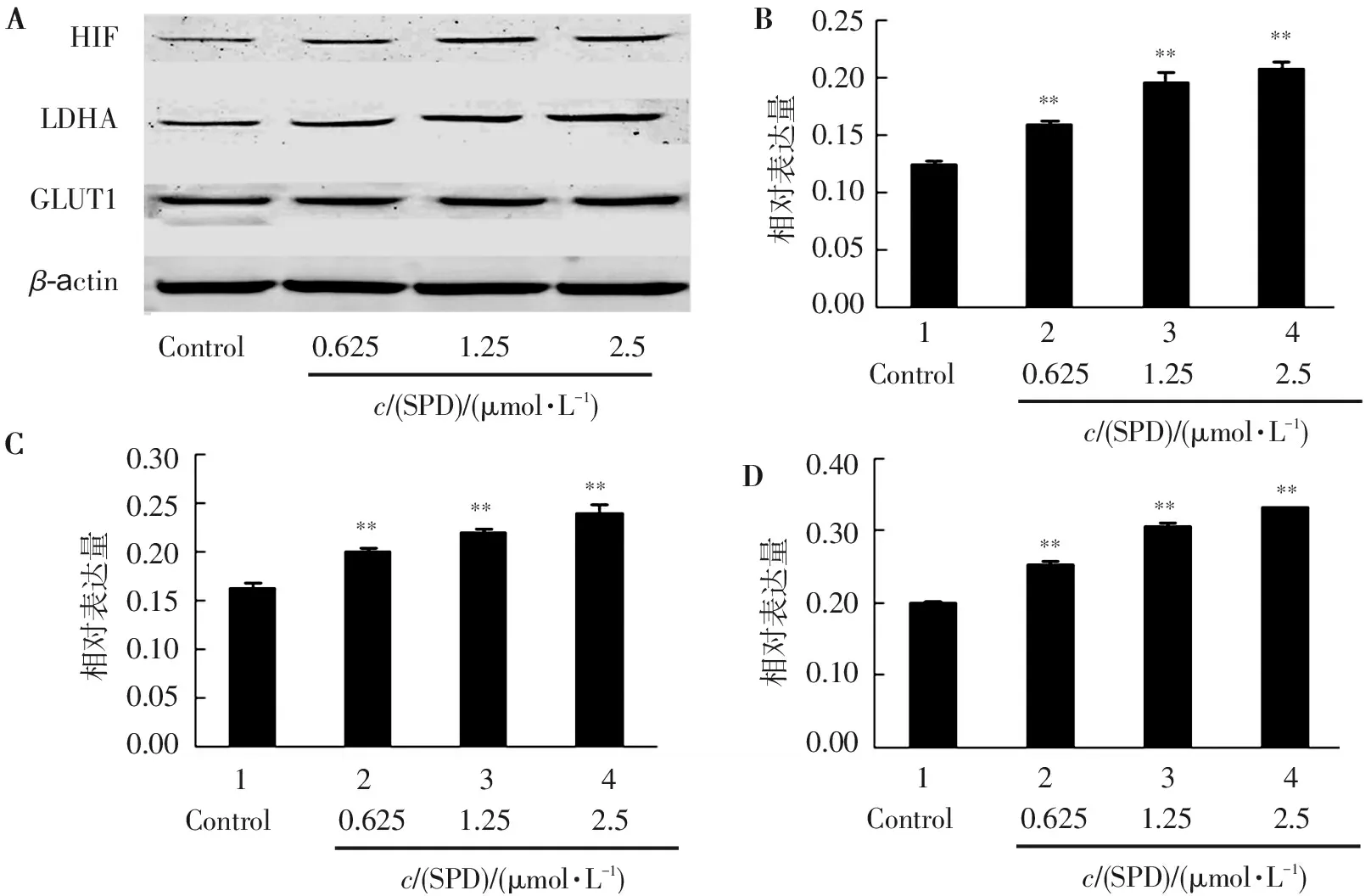
A.各组条带; B. HIF-1和β-actin 蛋白表达比值; C. LDHA和β-actin 蛋白表达比值; D. GLUT1和β-actin 蛋白表达比值。
与对照组比较:**P<0.01。
图1 不同浓度SPD对SW620细胞HIF-1、LDHA和GLUT1蛋白表达的影响
Figure 1 Effect of different concentrations of SPD on the expression of HIF-1,LDHA and GLUT1 in SW620 cells
一个重要酶系,据报道,胃癌患者组织中的的LDHA明显高于普通人[15],同时HIF-1能够调控LDHA基因的表达,且致癌基因c-myc能结合并激活LDHA启动子,导致其转录水平的增高和促进乳酸的形成[16-17]。
本实验结果表明,SPD能够明显促进SW620细胞的增殖及葡萄糖的消耗,随着SPD的浓度升高,其促进作用越明显,且呈剂量依赖性。同时,各浓度的SPD均能够明显增加细胞中乳酸含量,促进HIF-1、GLUT1及LDHA蛋白水平的表达,且随着精脒浓度越高,其促进作用越明显,呈剂量依赖性。结合c-myc可激活ODC的表达从而促进多胺的生成,而c-myc同样可以促进HIF-1α蛋白表达的理论依据,笔者认为多胺能够通过促进HIF-1基因的表达,从而促进糖酵解过程,加快肿瘤细胞的增殖。
结肠癌是我国常见的消化道恶性肿瘤,其发病率呈逐年上升趋势,本实验通过多胺对HIF-1等糖酵解相关基因的影响的初步探讨,能够为从体外控制多胺的摄入从而控制肿瘤的发展提供了一个方向,也为结肠癌的预防及治疗提供新的思路。但多胺对在c-myc水平增加诱导HIF-1α蛋白上调、促进糖酵解的作用机理还有待于进一步研究。
[1] PARKIN D M,BRAY F,FERLAY J,et al. Global ancer tatistics,2002[J]. CA Cancer J Clin,2005,55(2):74-108.
[2] WARBURG O.On the origin of cancer cells[J]. Science,1956,123(3191):309-314 .
[3] PIETRAS A,JOHNSSON A S,PAHLMAN S,et al. The HIF-2α-driven pseudo-hypoxic phenotype in tumor aggressiveness,differentiation,and vascularization[J]. Curr Top Microbiol Immunol,2010,7(7):1-20.
[4]MARIA L,ROGERS S,JAMES D,et al. Molecular and cellular regulation of glucose transporter(GLUT) proteins in cancer[J]. J Cell Physiol,2005,202(2):654-662.
[5] PARK J K,CH UNG Y M,KANG S,et al.c-Mycexerts a protective function through ornithine decarboxy lase against cellular insults[ J] . Mol Pharmacol,2002,62(6):1400-1 408.
[6] 赵家伟.多胺在肿瘤研究中的意义[J].氨基酸和生物资源,1995,17(1):46-50.
[7] CASERO R A,MARTON L J. Targeting polyamine meta-bolism and function in cancer and other proliferative diseases[J]. Nature Rev Drug Dis,2007,77(6):373-390.
[8] WALLACE H M,CASLAKE R.Polyamines and colon cancer[J].Eur J Gastroenterol Hepatol,2001,13(9):1033-1039.[9] BERCHTOLD C M,TAMEZ P,KENSLER T W,et al. Inhibition of cell growth in CaCO2cells by the polyamine analogue N1,N12-bis(ethyl)spermine is preceded by a reduction in MYC oncoproteinlevels[J].J Cell Physiol,1998,174(3):380-386.
[10] NILSSON J A,MACLEAN K H,KELLER U B,et al. Mntoss triggers myc transcription targets,proliferation,apoptosis and trans-formation[J].Mol Cell Biol,2004,24(4):1560-1569.
[11] 陈成,王桂华,杨熹,等.c-myc通过缺氧诱导因子-1α调控结肠癌细胞 HT-29的增殖[J].医药导报,2013,32(4):438-442.
[12] SEMENZA G L.HIF-1:upstream and downstream of cancer metabolism[J]. Curr Opin Genet Dev,2010,20(1):51-56.
[13] 龚龙,李先明,李子煌,等.HIF-1α和GLUT-1在鼻咽癌中的表达及其临床意义[J].中国癌症杂志,2012,22(4):269-275.
[14] 俞晓燕,孙子林.GLUT1的研究进展[J].现代中西医结合杂志,2012,21(30):3411-3414.
[15] 唐涌进,陈洪.缺氧诱导因子-1α在酒精性急性胃粘膜损伤中的作用[J].中国临床研究,2011,8(24):674-676.
[16] SHIM H,DOLDE C,LEWIS B C,et al.c-myctransacti-vation of LDH-A:implications for tumor metabolism and growth[J]. Proc Natl Acad Sci USA,1997,94(13):6658-6663.
[17] SEMENZA G L,JIANG B H,LEUNG S W,et al. Hypoxia response elements in the aldolase A,enolase 1,and lactate dehydrogenase A gene promoters contain essential binding sites for hypoxia-inducible factor1[J]. J Biol Chem,1996,271(51):32529-32537.
(责任编辑:幸建华)
Effect of spermidine on the growth and glycolysis of SW620 cells
ZHANG Fen,WU Yanyan,ZANG Linquan,PAN Xuediao,WANG Guixiang
(CollegeofPharmacy,GuangdongPharmaceuticalUniversity,Guangzhou510006,China)
Objective To investigate the effect of spermidine (SPD) on the growth and glycolysis of SW620 cells. Methods SW620 cells were culturedinvitroroutinely with different concentrations (0.625-2.5 μmol/L). Cell proliferation was detected by MTT. Glucose consumption and lactate concentrations were detected by test kit. The expression of HIF-1,LDHA and GLUT1 was detected by western blot. Results Compared with the control group,SPD promoted the proliferation of SW620 cells (P<0.01). SPD with different concentrations increased the glucose consumption and lactate concentrations in SW620 cells (P<0.01). Meantime,the expression of HIF-1,LDHA and GLUT1 was increased with the increased concentrations of SPD (P<0.01). Conclusion SPD could promote the proliferation and glycolysis of SW620 cells.
SPD; SW620cell; cell proliferation; glycolysis
2016-09-13
国家自然科学基金项目(81302895;81102465)
张芬(1990—),女,2014级硕士研究生,Email:1083920874@qq.com;通信作者:王桂香(1975—),女,副教授,主要从事药理学研究,Email:wgx306 @qq.com。
时间:2016-12-12 11:28
http://www.cnki.net/kcms/detail/44.1413.R.20161212.1128.001.html
R965
A
1006-8783(2016)06-0767-04
10.16809/j.cnki.1006-8783.2016091307
