猴头菌丝固体培养物质量标准研究
2017-01-05毕春洋李国源陈婷芮天奇杨军辉李俊松
毕春洋,李国源,陈婷,芮天奇,杨军辉,李俊松,2
(1.南京中医药大学 药学院,江苏 南京 210023; 2.江苏省中药高效给药系统工程技术研究中心,江苏 南京 210023)
药物分析
猴头菌丝固体培养物质量标准研究
毕春洋1,李国源1,陈婷1,芮天奇1,杨军辉1,李俊松1,2
(1.南京中医药大学 药学院,江苏 南京 210023; 2.江苏省中药高效给药系统工程技术研究中心,江苏 南京 210023)
目的 建立猴头菌丝固体培养物的质量控制方法和标准,为有效控制该药材的质量提供参考。方法 采用薄层色谱法对猴头菌丝固体培养物中的甘氨酸、苏氨酸、亮氨酸、缬氨酸、组氨酸进行定性鉴别;参照2015年版《中国药典》中相关方法,分别对猴头菌丝固体培养物中的水分、水溶性浸出物、醇溶性浸出物、总灰分、酸不溶性灰分进行测定;分别采用紫外-可见分光光度法和高效液相色谱法测定猴头菌丝固体培养物中多糖和腺苷的质量分数。结果 薄层色谱定性鉴别斑点清晰,特征明显;猴头菌丝固体培养物中水分不得超过11.0%、水溶性浸出率不得低于12.3%、醇溶性浸出率不得低于4.5%、总灰分不得超过6.5%、酸不溶性灰分不得超过1.5%,多糖质量分数不得低于2.23%,腺苷质量分数不得低于0.012 3%。结论 所建立的方法操作简便、准确度高、重复性好,能全面、有效地控制该猴头菌丝固体培养物的质量。
猴头菌丝; 固体培养物; 质量标准; 腺苷; 多糖; 氨基酸
猴头菌隶属于担子菌门、猴头菌科,因其子实体形如猴头、色如猴毛,故取名“猴头”。猴头菌是著名的药食兼用菌,性平味甘,具有助消化、利五脏的功能,营养丰富,素有“山珍猴头,海味燕窝”之说[1]。目前,我国已有100多个以猴头菌为主要原料的用于胃肠道疾病治疗的准字号药[2]。猴头菌含有多糖、寡糖、蛋白质、核苷、甾醇、吡喃酮等多种活性成分。现代药理研究表明,猴头菌具有提高免疫力[3]、抗感染[4]、抗肿瘤[5]、抗氧化[6]、降血糖[7]等多种生理功能,长期服用安全有效,极少发现不良反应和毒副作用。本文所用的猴头菌丝固体培养物为菌丝发酵后培养基与菌丝的复合体,呈棕色或棕黄色的条状、块状、纤维状。
近年来,有关猴头菌化学成分、药理作用的研究报道很多[8-9],但关于其质量标准的研究却很少,现行部版标准(WS3—B—3457—98)项下仅有鉴别、检查与多糖含量测定项。为进一步提高猴头菌丝固体培养物质量控制水平,规范其质量,本文在现行标准的基础上,对10批猴头菌丝固体培养物中的甘氨酸、苏氨酸、亮氨酸、缬氨酸、组氨酸进行定性鉴别,对水分、水溶性浸出物、醇溶性浸出物、总灰分、酸不溶性灰分、多糖、腺苷含量进行定量测定,为建立猴头菌丝固体培养物更完善的质控标准提供依据。
1 仪器与试药
1.1 仪器
Waters Alliance 2695高效液相色谱仪(美国Waters公司),配Waters 2996 PDA检测器,Empower色谱工作站;TU-1810紫外可见分光光度计(北京普析通用仪器有限责任公司);CPA225D电子天平(德国Sartorius公司);Corning LES离心机(美国康宁公司);TGL-18C-C高速台式离心机(上海安亭科学仪器厂);HH-2K2二孔智能水浴锅(巩义市予华仪器有限责任公司);KQ-500DE超声机(昆山市超声仪器有限公司);Synergy UV超纯水器(上海默克密理博公司)。
1.2 试药
硅胶G型薄层板(青岛海洋化工厂分厂,批号:20150120);对照品:腺苷(批号:110879-200202)、亮氨酸(批号:110876-200204)、甘氨酸(批号:110735-200102)、组氨酸(批号:890-200001)、苏氨酸(批号:889-200102)、缬氨酸(批号:140681-201202)、无水葡萄糖(批号:110833-201205),均由中国食品药品检定研究院提供;猴头菌丝固体培养物对照药材(自制,批号:20151108,腺苷质量分数:0.182 mg/g);乙腈为色谱纯,其他试剂均为分析纯;10批猴头菌丝固体培养物样品均由南京老山药业股份有限公司提供,经江苏省食品药品监督检验研究院郭青教授鉴定为猴头菌丝发酵后培养基与菌丝的复合体,批号如下:1(140113),2(140316),3(141026-1),4(141104-2),5(20141108),6(141122-1),7(141122-2),8(141210-2),9(150603),10(150703)。
2 方法与结果
2.1 猴头菌丝固体培养物TLC鉴别[10]
取本品1 g,加70%(体积分数,下同)乙醇30 mL,加热回流30 min,滤过,滤液浓缩至约5 mL作为供试品溶液。另取猴头菌丝固体培养物对照药材1 g,同法制成对照药材溶液。再取甘氨酸、苏氨酸、亮氨酸、缬氨酸、组氨酸对照品适量,分别加70%乙醇制成每1 mL各含0.5 mg的溶液,作为对照品溶液。参照2015年版《中国药典》四部“通则0502 薄层色谱法”试验,吸取供试品溶液与对照药材溶液各3 μL、对照品溶液各1 μL分别点于同一硅胶G薄层板上,以正丁醇-冰醋酸-水(体积比8∶3∶1)为展开剂,展开,取出,晾干,喷以质量分数0.2%茚三酮乙醇溶液,在105 ℃加热至斑点显色清晰,在日光下检视。供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,分别显相同颜色的斑点,结果见图1。
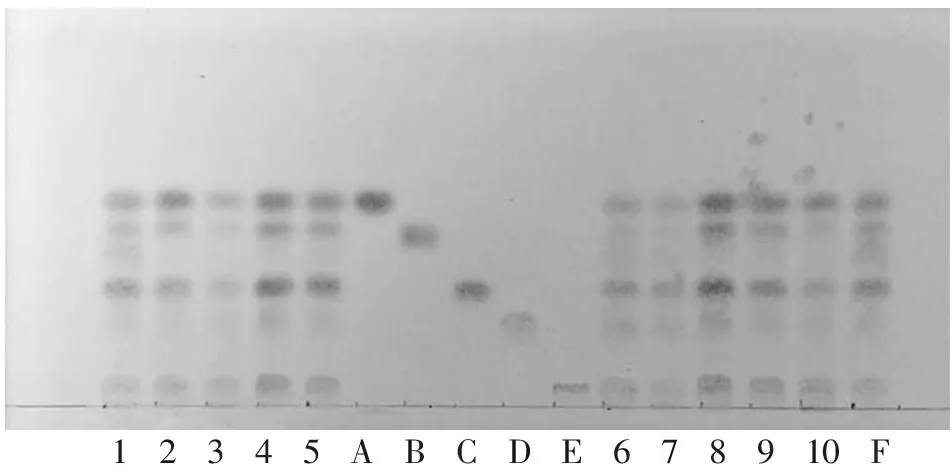
12345ABCDE678910F
A.亮氨酸; B.缬氨酸; C.苏氨酸; D.甘氨酸; E.组氨酸; F.对照药材; 1~10. 10批猴头菌丝固体培养物样品。
图1 猴头菌丝固体培养物TLC图
Figure 1 TLC chromatogram ofH.erinaceuswith solid cultures
2.2 检查
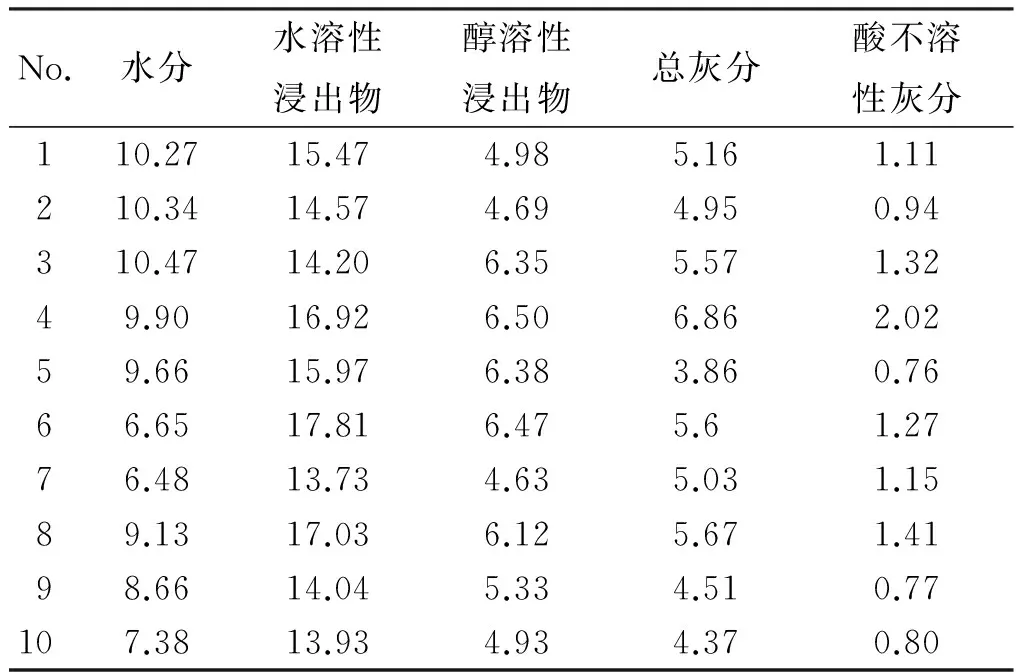
2.2.1 水分 取各批样品粉末(过2号筛)约2 g,精密称定,参照2015年版《中国药典》四部“通则0832 水分测定法第二法”进行测定。结果测得10批样品的水分质量分数在6.48%~10.47%之间,平均为8.89%。根据测定结果,暂定水分不得过11.0%,结果见表1。
2.2.2 水溶性浸出物、醇溶性浸出物 取各批样品粉末(过4号筛)约2 g,精密称定,参照2015年版《中国药典》四部“通则 2201浸出物测定法”进行测定。结果测得10批样品的水溶性浸出率在13.73%~17.81%之间,平均为15.37%;醇溶性浸出率在4.63%~6.50%之间,平均为5.64%,见表1。根据以上结果,暂定水溶性浸出率不得低于12.3%,醇溶性浸出率不得低于4.5%。
2.2.3 总灰分、酸不溶性灰分 取各批样品粉末(过4号筛)约3 g,精密称定,参照2015年版《中国药典》四部“通则2302 总灰分测定法、酸不溶性灰分测定法”进行测定。结果测得10批样品的总灰分质量分数在3.86%~6.86%之间,平均为5.16%;样品酸不溶性灰分质量分数在0.76%~2.02%之间,平均为1.16%,见表1。根据以上结果,暂定总灰分不得超过6.5%,酸不溶性灰分不得超过1.5%。
表1 猴头菌丝固体培养物水分、水溶性浸出物、醇溶性浸出物、总灰分、酸不溶性灰分的测定结果
Table 1 The contents of the water,water soluble extract,ethanol soluble extract,total ash,acid insoluble substance inH.erinaceuswith solid cultures(n=2)
w/%
2.3 UV-VIS测定猴头菌丝固体培养物中多糖的质量分数
2.3.1 对照品溶液的制备 取无水葡萄糖对照品适量,精密称定,加水制成每1 mL含0.200 5 mg的溶液,即得。
2.3.2 供试品溶液的制备 取本品粉末(过4号筛)约0.2 g,精密称定,置50 mL离心管中,加80%(体积分数,下同)乙醇30 mL,超声30 min(工作频率40 kHz,功率250 W),离心15 min(转速6 000 r/min)后弃去上清液,再加80%乙醇30 mL重复1次。用50 mL水将滤渣移至圆底烧瓶中,加热回流1 h,趁热滤过,用30 mL热水分3次洗涤滤渣及滤纸,滤液收集至100 mL量瓶中,冷却后加水定容至刻度,摇匀,即得。
2.3.3 线性关系考察 精密量取对照品溶液0.2、0.3、0.4、0.5、0.6、0.7 mL,分别置10 mL具塞试管中,各加水至2.0 mL,迅速精密加入硫酸蒽酮溶液5 mL,立即摇匀,水浴中放置10 min后,立即置冰浴中冷却10 min,取出,以相应的试剂为空白,参照2015年版《中国药典》“通则0401 紫外-可见分光光度法”在626 nm波长处测定吸光度,以吸光度为纵坐标,质量浓度为横坐标,绘制标准曲线,得多糖回归方程Y=11.232X+0.018 8(r2=0.999 2),线性范围为20.1~70.2 μg/mL。
2.3.4 精密度试验 取葡萄糖对照品溶液稀释5倍,精密吸取6份,按“2.3.3”项下测定方法分别测定吸光度,结果得RSD值为0.70%,表明仪器精密度良好。
2.3.5 重复性试验 取同一批供试品粉末(样品5)6份,按“2.3.2”项下方法制备供试品溶液,按“2.3.3”项下测定方法分别测定吸光度,结果得RSD值为0.95%,表明方法重复性良好。
2.3.6 稳定性试验 取本品供试品溶液(样品5),分别于0、10、20、40、60、90、120 min测定吸光度,结果得RSD为0.60%,表明样品在2 h内稳定。2.3.7 加样回收率试验 分别精密量取9份本品供试品溶液(样品5),每份1 000 μL,分别精密添加葡萄糖对照品溶液160、200、240 μL各3份,加水补至2 mL,混匀,按“2.3.3”项下测定方法分别测定吸光度,计算得平均加样回收率为100.65%,RSD为1.44%。
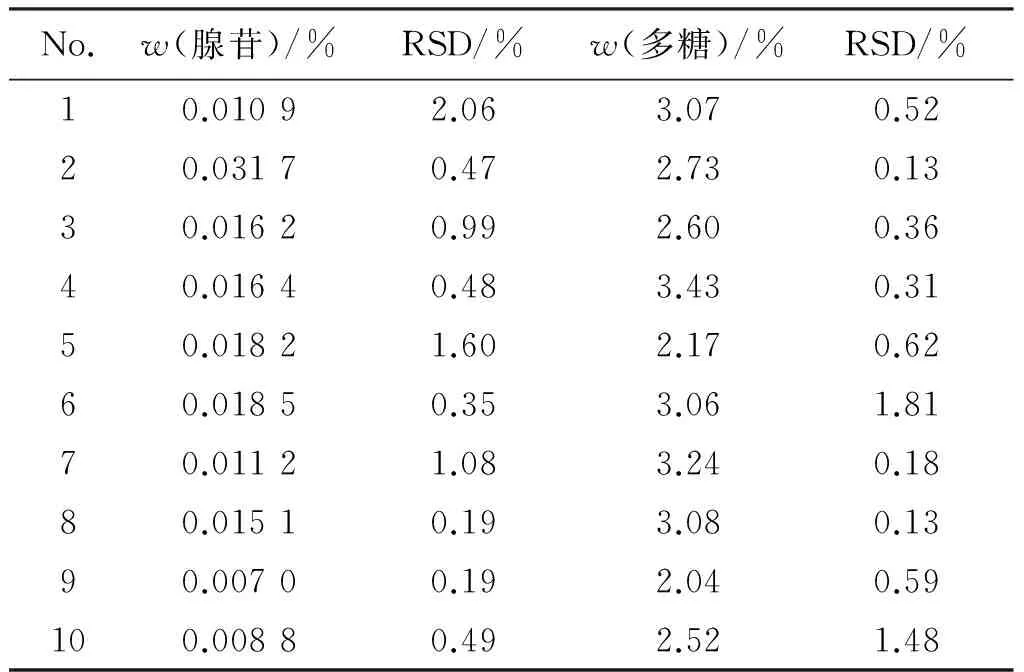
2.3.8 样品中多糖的质量分数的测定 分别测定了10个批次猴头菌丝固体培养物中多糖的质量分数,每批平行3份。结果测得10批样品的多糖质量分数在2.05%~3.43%之间,平均为2.79%,结果见表2。根据10批样品的测定结果,暂定本品含多糖不得低于2.23%。
2.4 HPLC法测定猴头菌丝固体培养物中腺苷的质量分数
2.4.1 色谱条件 色谱柱:Kromasil100-5 C18柱(4.6 mm×250 mm,5 μm);流动相:乙腈-水(体积比5∶95);流速:1.0 mL/min;检测波长:260 nm;进样量:20 μL;柱温:30 ℃。色谱图见图3。
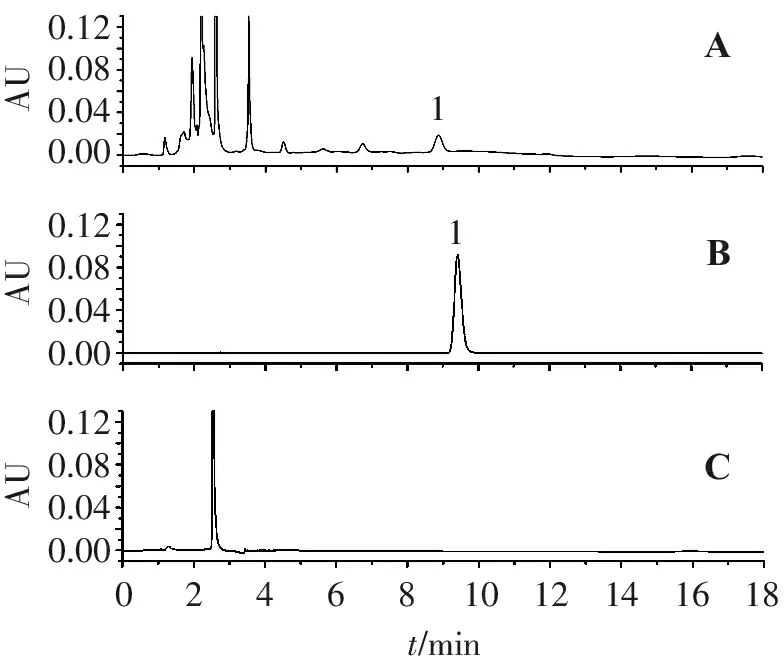
0.120.080.040.000.120.080.040.000.120.080.040.00AUAUAU11024681012141618t/minABC
A.对照品; B.供试品; C.阴性对照品; 1.腺苷。
图2 猴头菌丝固体培养物HPLC图
Figure 2 HPLC chromatograms ofH.erinaceuswith solid cultures
2.4.2 对照品溶液的制备 取腺苷对照品适量,精密称定,加甲醇制成每1 mL含20.32 μg的溶液,即得。
2.4.3 供试品溶液的制备 取本品粉末(过4号筛)约0.5 g,研细,精密称定,置具塞锥形瓶中,精密加入45%(体积分数,下同)甲醇25 mL,密塞,称定质量,超声40 min(频率40 kHz,功率250 W),放冷,再称定质量,用45%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.4.4 线性关系考察 精密量取腺苷对照品溶液,以2倍法稀释后续对照品溶液,得质量溶度为20.32、10.16、5.08、2.54、1.27 μg/mL系列溶液,分别吸取上述溶液20 μL注入液相色谱仪,测定峰面积。以对照品的浓度为横坐标,以峰面积值为纵坐标,绘制标准曲线,得腺苷回归方程为Y=64 281X-941.45(r2=1.000 0),线性范围为1.27~20.32 μg/mL。
2.4.5 精密度试验 取对照品溶液,按“2.4.1”项下色谱条件测定,重复进样6次,记录每次所测峰面积。结果得峰面积的RSD值为0.07%,表明仪器精密度良好。
2.4.6 重复性试验 取同一批供试品粉末6份(样品6),按“2.4.3”项下方法制备供试品溶液,按“2.4.1”项下色谱条件测定。结果样品中腺苷平均质量分数的RSD值为0.95%,表明方法重复性良好。
2.4.7 稳定性试验 取本品粉末(样品6),按“2.4.3”项下方法制备供试品溶液,分别在0、2、4、8、12、18、24 h进样,按“2.4.1”项下色谱条件测定记录峰面积。结果得峰面积的RSD为2.59%,表明样品在24 h内稳定。
2.4.8 加样回收率试验 取已知含量的同一批本品粉末(样品6)6份,每份约0.25 g,精密称定,精密加入质量浓度为20.32 μg/mL的对照品溶液2.650 mL,按“2.4.3”项下方法制备供试品溶液,按“2.4.1”项下色谱条件测定记录峰面积。结果计算得平均回收率为100.8%,RSD为1.27%。
2.4.9 耐用性试验 比较了3根不同品牌的高纯度硅胶键合C18柱:① Kromasil 100-5 C18柱(4.6 mm×250 mm,5 μm);② Hedera ODS-2柱(4.6 mm×250 mm,5 μm);③ Welchrom C18柱(4.6 mm×250 mm,5 μm)。取同一份供试品溶液(样品6),分别于上述3根色谱柱上进样,3种不同品牌色谱柱测得的猴头菌丝固体培养物中腺苷质量分数的RSD值为1.41%(n=3)。
2.4.10 样品中腺苷质量分数的测定 分别测定了10个批次猴头菌丝固体培养物中腺苷的质量分数,每批平行3份,结果测得10批样品的腺苷质量分数在0.007 0%~0.031 7%之间,平均为0.015 4%,结果见表2。根据10批样品的测定结果,暂定本品含腺苷不得低于0.012 3%。
表2 猴头菌丝固体培养物中腺苷、多糖质量分数的测定结果
Table 2 The contents of adenosine and polysaccharide inH.erinaceuswith solid cultures (n=3)
No.w(腺苷)/%RSD/%w(多糖)/%RSD/%10.01092.063.070.5220.03170.472.730.1330.01620.992.600.3640.01640.483.430.3150.01821.602.170.6260.01850.353.061.8170.01121.083.240.1880.01510.193.080.1390.00700.192.040.59100.00880.492.521.48
3 讨论
本试验在TLC鉴别中对样品的提取方法、点样量、展开剂种类、溶剂比例等条件进行了筛选,最终确定了鉴别方法。从本文结果可见,10批猴头菌丝固体培养物的TLC图在与对照品、对照药材相应的位置上,均出现相同颜色的斑点。多糖是猴头菌丝固体培养物的主要成分之一,本文对样品的提取方法、提取时间、料液比、显色方法、硫酸蒽酮浓度及其加入量和显色时间等条件进行了考察,最终确定了多糖质量分数的测定方法。
核苷类成分为猴头菌的主要成分之一,具有镇静、扩血管、抗缺氧及较弱的抗感染、降胆固醇等生理活性,且质量分数相对较高[11],因此选择腺苷作为指标性成分。10批样品的测定结果表明,腺苷质量分数相对较稳定,这表明腺苷可以作为一个稳定的控制因子,与多糖一起成为复合式的分析指标。
猴头菌丝固体培养物已在广泛使用,但其当前的生产标准还不是很完善,因此建立简单快速考察猴头菌丝固体培养物的质量方法具有重要意义。根据生产实际,参照“《中国药典》中药质量标准研究制定技术要求”有关规定,结合原料药与猴头菌丝固体培养物成药胃乐宁片的实际情况,本次质量标准的上限标准按平均量上浮20%制订,下限标准按平均量下浮20%制订。本研究建立的质量标准,方法简便、准确,重复性好,为全面控制猴头菌丝固体培养物的质量提供了可靠的方法。
[1] 王晓玉,蒋秋燕,凌沛学,等. 猴头菌活性成分及药理作用研究进展[J].中国生化药物杂志,2010,31(1):70-72.
[2] 尚晓冬,王国艳,潘伟,等. 猴头菌小分子活性成分研究进展[J].食用菌学报,2012,19(1):79-91.
[3] YIM M J,SHIN J W,SON J Y,et al. Soluble components ofHericiumerinaceuminduce NK cell activation via production of interleukin-12 in mice splenocytes[J]. Acta Pharmacol Sin,2007,28(6):901-907.
[4] WONG Jingyang,ABDULLA M A,RAMAN J,et al. Gastroprotective effects of Lion′s Mane MushroomHericiumerinaceus(Bull.:Fr.)Pers. (Aphyllophoromycetideae)extract against ethanol-induced ulcer in rats[J]. Evid Based Complement Alternat Med,2013,2013:492976.
[5] LI Guang,YU Kai,LI Fushuang,et al. Anticancer potential ofHericiumerinaceusextracts against human gastroin-testinal cancers[J]. J Ethnopharmacol,2014,153(2):521-530.
[6] HAN Zihua,YE Jianmin,WANG Guanfu. Evaluation ofinvivoantioxidant activity ofHericiumerinaceuspolysaccharides[J]. Int J Biol Macromol,2013,52:66-71.
[7] LIANG Bin,GUO Zhengdong,XIE Fang,et al. Antihyper-glycemic and antihyperlipidemic activities of aqueous extract ofHericiumerinaceusin experimental diabetic rats[J]. BMC Complement Altern Med,2013,13:253.
[8] 张鹏,图力古尔,包海鹰. 猴头菌属真菌化学成分及药理活性研究概述[J].菌物研究,2011,9(1):54-62.
[9] JIANG Shengjuan,WANG Songhua,SUN Yujun,et al. Medicinal properties ofHericiumerinaceusand its potential to formulate novel mushroom-based pharmaceuticals[J]. Appl Microbiol Biotechnol,2014,98(18):7661-7670.
[10] 国家药典委员会. 中华人民共和国药典:2015年版一部[M].北京:中国医药科技出版社,2015:1614.
[11] 中国医学科学院药物研究所. 中草药现代研究:第一卷[M].北京:北京医科大学、中国协和医科大学联合出版社,1995:91-103.
(责任编辑:陈翔)
Study on quality standard for Hericium erinaceus with solid cultures
BI Chunyang1,LI Guoyuan1,CHEN Ting1,RUI Tianqi1,YANG Junhui1,LI Junsong1,2
(1.CollegeofPharmacy,NanjingUniversityofChineseMedicine,Nanjing210023,China; 2.JiangsuEngineeringResearchCenterforEfficientDeliverySystemofTCM,Nanjing210023,China)
Objective To establish the quality standard forHericiumerinaceuswith solid cultures in order to control the quality ofH.erinaceusefficiently. Methods Thin-layer chromatography(TLC) was used to identify amino acids(including leucine,valine,threonine,glycine,histidine). According to the methods recorded in the Chinese Pharmacopoeia(2015 Edition),the water,water soluble extract,ethanol soluble extract,total ash,acid insoluble substance inH.erinaceuswith solid cultures were determined. The content of polysaccharide was determined by ultraviolet-visible spectrophotometry(UV-VIS),and the content of adenosine was determined by high performance liquid chromatography(HPLC). Results The TLC identification was highly specific and the spots were clear. The contents of the water,total ash and acid insoluble substance should not exceed 11.0%,6.5% and 1.5%. The water soluble extractive,ethanol soluble extraction,polysaccharide and adenosine should be no less than 12.3%,4.5%,2.23% and 0.012 3%. Conclusion The quality standard established,which can be used for the quality standard ofH.erinaceuswith solid cultures,is simple,accurate,reproducible,and specific.
Hericiumerinaceus; solid cultures; quality standard; adenosine; polysaccharide; amino acids
2016-08-12
毕春洋(1991—),男,2014级硕士研究生,Email:bcy08032328@163.com;通信作者:李俊松(1964—),男,教授,硕士研究生导师,从事中药炮制与制剂研究,Email:lijunsong1964@163.com
时间:2016-11-25 9:01
http://www.cnki.net/kcms/detail/44.1413.R.20161125.0901.001.html
R284.1
A
1006-8783(2016)06-0724-05
10.16809/j.cnki.1006-8783.2016081203
