氮杂环卡宾钯配合物催化合成含联苯类及异黄酮类化合物中药活性成分的研究
2017-01-05兰小兵麦继忠刘丰收欧阳嘉盛李艳芳申东升
兰小兵,麦继忠,刘丰收,欧阳嘉盛,李艳芳,申东升,2
(1.广东药科大学 医药化工学院,广东 中山 528458; 2.广东省化妆品工程技术研究中心,广东 中山 528458)
氮杂环卡宾钯配合物催化合成含联苯类及异黄酮类化合物中药活性成分的研究
兰小兵1,麦继忠1,刘丰收1,欧阳嘉盛1,李艳芳1,申东升1,2
(1.广东药科大学 医药化工学院,广东 中山 528458; 2.广东省化妆品工程技术研究中心,广东 中山 528458)
目的 通过氮杂环卡宾钯催化的Suzuki-Miyaura偶联反应,合成一系列联苯类化合物及异黄酮类化合物。方法 将设计合成的氮杂环卡宾钯配合物作为催化剂,以芳基硼酸、卤代芳烃为底物,分别考察催化剂用量、反应溶剂和碱等影响因素,确定最优反应条件,在最优条件下催化合成含联苯类及异黄酮类化合物中药活性成分,分离纯化得到目标产物。结果 设计合成了1个氮杂环卡宾钯配合物,将它作为催化剂,筛选出了催化Suzuki-Miyaura偶联反应的最优条件:以氮杂环卡宾钯配合物(0.001 mmoL)作催化剂,无水乙醇为溶剂,K3PO4(1.5 mmoL)为碱,反应温度为80 ℃,反应时间为4 h,在空气中直接反应。在最优条件下,催化合成了7个联苯类化合物及7个异黄酮类化合物,结构均通过MS、1H NMR和13C NMR进行了表征。 结论 本文设计合成的氮杂环卡宾钯配合物催化活性高,合成条件温和,后处理操作简单。本研究对含联苯类和异黄酮类化合物中药活性成分的全合成、半合成或者结构修饰具有一定的参考价值。
氮杂环卡宾; Suzuki-Miyaura; 联苯类化合物; 异黄酮类化合物
目前,中药活性成分类化合物大多数来自于天然植物的提取[1-3]。但是,仅仅依靠从天然植物中提取分离中药活性类化合物根本无法满足市场的需求[4]。并且,中药原料来自自然,又多为人工分散采收、加工,受天气、地域差别及人为影响因素很大,使得绝大部分中药活性成分类化合物在研究和应用上存在成分变化大和药性不稳定等局限性,而可开发作为药用的化合物就更少[5]。黄酮类化合物是一类重要的中药有效成分,具有多种多样的生物活性,如具有扩张动脉血管、抗肝损伤、解痉、止咳祛痰、抗菌、抗病毒、抗肿瘤等作用[6]。联芳结构是这些具有药理活性天然产物中最重要的特征结构[7]。因此,研究合成联苯类化合物及异黄酮类化合物对于中药活性成分的全合成、半合成及结构修饰等研究具有重要的意义。
氮杂环卡宾作为一种新型配体,具有与传统磷配体类似的电子性质,并且制备简单,可调控性好[8]。自1991年,Arduengo等[9]首次成功分离出游离的氮杂环卡宾以来,它在催化方面的应用取得了令人瞩目的成就。最典型的就是氮杂环卡宾钯配合物催化的Suzuki-Miyaura偶联反应[10]。目前,绝大部分已有文献报道的氮杂环卡宾钯配合物催化的Suzuki-Miyaura偶联反应都是在氩气下进行的,而在空气下直接反应的文献很少[11-12]。据此,本课题组在前期研究基础上,设计合成了一种高效的氮杂环卡宾钯催化剂,在空气下,直接应用于Suzuki-Miyaura偶联反应,合成得到了7个联苯类化合物及7个异黄酮类化合物,并对产物结构进行了表征。
1 实验部分
1.1 试剂与仪器
无水乙醇、二氯甲烷、正己烷、无水乙醚、冰乙酸(分析纯,广州化学试剂厂);无水ZnCl2(分析纯,天津百世公司);二苯甲醇、三氯吡啶(分析纯,上海达瑞精细化学品公司);乙二醛(质量分数40%水溶液,天津百世公司);4-甲基苯胺(质量分数98%,Aldrich公司);氯甲基乙醚、PdCl2(分析纯,上海达瑞精细化学品公司)。
GC-2010 Plus气相色谱仪(岛津公司);X-4数字显示微熔点测量仪(巩义予华仪器有限责任公司);Mercury-Plus 400型核磁共振波谱仪(VARIAN公司);RCT基本型恒温磁力搅拌器(IKA公司);WP-RH-1020平行反应仪(Wattecs公司)。
1.2 催化剂氮杂环卡宾钯配合物的合成与表征
催化剂氮杂环卡宾钯配合物的合成路线见图1。

图1 催化剂氮杂环卡宾钯配合物的合成路线
Figure 1 The synthetic route ofN-heterocyclic carbene
1.2.1 化合物1的合成 将二苯甲醇(3.68 g,20 mmoL)、4-甲基苯胺(1.07 g、10 mmoL)分别加至100 mL支口瓶中,搅拌,N2保护下升温到80 ℃,待固体全部溶解后,用注射器将ZnCl2(1.33 g)/HCl(1.67 mL)溶液注射到支口瓶中,升温至160 ℃,80 min后停止反应并冷却至室温。用100 mL的二氯甲烷溶解固体,再用NH4Cl的水溶液及饱和食盐水洗涤。合并有机相,无水Na2SO4干燥,滤过,旋干,得白色固体3.99 g,产率91%,mp 186.8~187.6,MS(ESI)m/z:441[M]+,167[CHPh2]+。1H NMR(400 MHz,CDCl3)δ: 7.28(m,Ar-H,8H),7.25-7.19(m,Ar-H,4H),7.08(d,J=7.5 Hz,Ar-H,8H),6.32(s,NH2,2H),5.43[s,CH(Ph)2,1H],2.04(s,CH3,3H)。13C NMR(101 MHz,CDCl3)δ:142.9,139.8,129.7,129.4,129.2,128.6,115.3,115.0 52.5,21.3。
1.2.2 化合物2的合成 向反应瓶中加入化合物1(4.39 g、10 mmoL)、无水乙醇20 mL、乙二醛(0.55 mL、5 mmoL)、冰乙酸2 mL,80 ℃搅拌回流8 h。反应停止后冷却至室温,抽滤,干燥。得亮黄色固体4.01 g,产率89%,mp 243.3~244.1 ℃,MS(ESI)m/z: 902[M]+,167[CHPh2]+。1H NMR(400 MHz,CDCl3)δ:7.22(m,Ar-H,16H),7.09(s,N=CH,2H),7.07(d,J=3.0 Hz,Ar-H,4H),6.99(d,J=7.5 Hz,Ar-H,5H),6.95(d,J=7.0 Hz,Ar-H,15H),6.83(s,Ar-H,4H),5.16[s,CH(Ph)2,4H],2.18(s,CH3,6H)。13C NMR(101 MHz,CDCl3)δ:142.8,134.0,129.4,128.7,128.6,128.5,126.9,126.7,51.0,21.8。
1.2.3 化合物3的合成 向反应瓶中加入化合物2(1.86 g、2 mmoL)、氯甲基乙醚8 mL,N2保护下于100 ℃反应24 h。反应结束后冷却至室温,向瓶中加入大量无水乙醚搅拌,10 min后出现大量固体。过滤,少量无水乙醚淋洗,干燥,得灰白色固体1.44 g,产率76%,MS(ESI)m/z: 914[M]+,167[CHPh2]+。1H NMR(400 MHz,CDCl3)δ:12.78(s,NCHN,1H),7.28(m,Ar-H,10H),7.20(m,Ar-H,16H),7.14(m,Ar-H,8H),6.98(s,Ar-H,4H),6.76(d,J=7.3 Hz,Ar-H,8H),5.50(s,C=CH,2H),5.26[s,CH(Ph)2,4H],2.17(s,CH3,6H)。13C NMR(101 MHz,CDCl3)δ:143.0,141.6,140.8,130.5,129.9,129.0,128.9,128.8,127.3,123.3,51.4,21.8。
1.2.4 氮杂环卡宾钯配合物(Cat4)的合成 向反应瓶中依次加入化合物3(0.98 g,1 mmoL)、PdCl2(0.18 g,1 mmoL)、K2CO3(1.38 g,10 mmoL)、3-氯吡啶6 mL,80 ℃下反应16 h,反应结束后静置冷却至室温,以二氯甲烷为展开剂过柱子。旋干,正己烷重结晶,抽滤,干燥,得到黄色结晶产物0.92 g,产率79%,MS(ESI)m/z:1 168[M-Cl]+,914[3]+,167[CHPh2]+。1H NMR(400 MHz,CDCl3)δ:9.08-9.00(m,Ar-H,2H),7.80(d,J=8.2 Hz,Ar-H,2H),7.43(d,J=7.3 Hz,Ar-H,8H),7.33(m,Ar-H,1H),7.21(m,Ar-H,12H),7.09-6.91(m,Ar-H,12H),6.77(d,J=7.1 Hz,Ar-H,8H),6.49(s,Ar-H,4H),6.33[s,CH(Ph)2,4H],4.83(s,C=CH,2H),2.18(s,CH3,6H)。13C NMR(101 MHz,CDCl3)δ:158.8,150.8,149.7,144.2,143.7,137.9,132.5,130.4,129.3,128.1,127.9,126.1,124.3,54.8,21.8。
1.3 Suzuki-Miyaura偶联反应及其产物表征
平行反应仪的反应管中,加入卤代芳烃(1 mmoL)、芳硼酸(1.2 mmoL)、K3PO4(1.5 mmoL)、Cat4(0.001 mmoL)、无水乙醇3 mL及搅拌磁子,于80 ℃下反应4 h。反应结束后,冷却至室温,用3×10 mL乙酸乙酯萃取,合并有机相,无水Na2SO4干燥,滤过,取少量于GC仪器检测。其余有机相减压蒸馏除去溶剂,经硅胶柱层析分离纯化得到对应目标产物,经MS、1H NMR和13C NMR表征。
1.3.1 1,1′-biphenyl mp 68.3~69.7 ℃;MS(ESI)m/z:154[M]+。1H NMR(400 MHz,CDCl3)δ:7.65(d,J=7.5 Hz,Ar-H,4H),7.50(m,Ar-H,4H),7.40(t,J=7.3 Hz,Ar-H,2H)。13C NMR(101 MHz,CDCl3)δ:141.2,128.7,127.2,127.1。
1.3.2 4-methyl-1,1′-biphenyl mp 47.2~48.6 ℃;MS(ESI)m/z:168[M]+。1H NMR(400 MHz,CDCl3)δ:7.76-7.41(m,Ar-H,9H),2.36(s,CH3,3H)。13C NMR(101 MHz,CDCl3)δ141.2,138.4,137.2,131.0,129.5,128.1,127.1,127.0,21.0。
1.3.3 1-phenylnaphthalene MS(ESI)m/z: 204 [M]+。1H NMR(400 MHz,CDCl3)δ:7.97-7.83(m,Ar-H,3H),7.60-7.48(m,Ar-H,6H),7.47-7.40(m,Ar-H,3H)。13C NMR(101 MHz,CDCl3)δ:140.7,140.2,133.7,131.6,130.0,128.2,127.6,127.2,126.9,126.0,125.7,125.4。
1.3.4 2-methoxy-4′-methyl-1,1′-biphenyl mp 81.2~82.4 ℃;MS(ESI)m/z: 198[M]+。1H NMR(400 MHz,CDCl3)δ:7.42(d,J=8.4 Hz,Ar-H,2H),7.30(d,J=7.6 Hz,Ar-H,2H),7.21(d,J=8.0 Hz,Ar-H,2H),7.00(m,Ar-H,1H),6.96(d,J=8.0 Hz,Ar-H,1H),3.79(s,OCH3,3H),2.38(s,CH3,3H)。13C NMR(100 MHz,CDCl3)δ:156.5,136.6,135.6,130.8,130.7,129.5,128.8,128.4,120.8,111.2,55.6,21.3。
1.3.5 1-(4-methoxyphenyl)naphthalene mp 115.3~116.7 ℃;MS(ESI)m/z:234[M]+。1H NMR(400 MHz,CDCl3)δ:7.95(m,Ar-H,2H),7.87(d,J=7.9 Hz,Ar-H,1H),7.61-7.40(m,Ar-H,6H),7.12-7.03(m,Ar-H,2H),3.92(s,Ar-OCH3,3H)。13C NMR(101 MHz,CDCl3)δ:158.9,139.9,133.8,133.1,131.8,131.1,128.2,127.3,126.9,126.0,125.9,125.7,125.4,113.7,55.3。
1.3.6 2,2′-dimethoxy-1,1′-biphenyl mp 153.9~154.6 ℃;MS(ESI)m/z: 214[M]+。1H NMR(400 MHz,CDCl3)δ: 7.32(m,Ar-H,2H),7.23(m,Ar-H,2H),7.07-6.89(m,Ar-H,4H),3.76(s,Ar-OCH3,6H)。13C NMR(101 MHz,CDCl3)δ:157.1,131.4,128.6,127.9,120.3,111.1,55.7。
1.3.7 2-methoxy-4′-nitro-1,1′-biphenyl mp 62.1~63.3 ℃;MS(ESI)m/z: 229 [M]+。1H NMR(400 MHz,CDCl3)δ: 8.23(d,J=11.4 Hz,Ar-H,2H),7.69(d,J=11.4 Hz,Ar-H,2H),7.43-7.37(m,Ar-H,1H),7.33-7.31(m,Ar-H,1H),7.09-7.01(m,Ar-H,2H),3.83(s,OCH3,3H)。13C NMR(100 MHz,CDCl3)δ: 156.3,146.5,145.4,130.7,130.4,130.1,128.8,128.1,123.1,121.0,111.3,55.6。
1.3.8 3-phenyl-4H-chromen-4-one mp 127.2~127.8 ℃;MS(ESI)m/z: 222 [M]+。1H NMR(400 MHz,CDCl3)δ: 8.33(d,J=8.0 Hz,Ar-H,1H),8.03(s,Ar-H,1H),7.69(m,Ar-H,1H),7.58(d,J=7.6 Hz,Ar-H,2H),7.45(m,Ar-H,5H)。13C NMR(100 MHz,CDCl3)δ:176.2,156.2,153.1,133.6,131.8,129.0,128.5,128.2,126.5,125.4,125.3,124.6,118.0。
1.3.9 3-(p-tolyl)-4H-chromen-4-one mp 130.8~132.1 ℃;MS(ESI)m/z: 236 [M]+。1H NMR(400 MHz,CDCl3)δ: 8.31(d,J=8.0 Hz,Ar-H,1H),8.00(s,Ar-H,1H),7.67(m,Ar-H,1H),7.59-7.38(m,Ar-H,4H),7.25(d,J=7.7 Hz,Ar-H,2H),2.39(s,CH3,3H)。13C NMR(100 MHz,CDCl3)δ: 176.3,156.1,152.7,138.0,133.5,129.6,129.2,128.7,127.0,126.4,125.1,124.5,118.0,21.2。
1.3.10 3-(m-tolyl)-4H-chromen-4-one mp 70.2~71.8 ℃;MS(ESI)m/z: 236 [M]+。1H NMR(400 MHz,CDCl3)δ: 8.33(d,J=8.0 Hz,Ar-H,1H),8.01(s,Ar-H,1H),7.68(m,Ar-H,1H),7.52-7.29(m,Ar-H,5H),7.21(d,J=6.1 Hz,Ar-H,1H),2.41(s,CH3,3H)。13C NMR(100 MHz,CDCl3)δ: 176.3,156.1,153.0,138.0,133.5,131.6,129.6,128.9,128.4,126.3,125.9,125.4,125.2,124.5,118.0,21.4。
1.3.11 3-(o-tolyl)-4H-chromen-4-one MS(ESI)m/z: 236 [M]+。1H NMR(400 MHz,CDCl3)δ: 8.31(d,J=8.0 Hz,Ar-H,1H),7.89(s,Ar-H,1H),7.70(m,Ar-H,1H),7.51(d,J=8.4 Hz,Ar-H,1H),7.44(m,Ar-H,1H),7.36-7.16(m,Ar-H,4H),2.26(s,CH3,3H)。13C NMR(100 MHz,CDCl3)δ:176.0,156.4,153. 6,138.1,133.6,131.5,130.5,130.2,128.6,126.4,125.8,125.2,118.1,20.0。
1.3.12 3-(3,5-dimethylphenyl)-4H-chromen-4-one mp 69.1~70.5 ℃;MS(ESI)m/z: 250 [M]+。1H NMR(400 MHz,CDCl3)δ: 8.32(d,J=8.0 Hz,Ar-H,1H),8.01(s,Ar-H,1H),7.68(m,Ar-H,1H),7.51-7.40(m,Ar-H,2H),7.18(s,Ar-H,2H),7.03(s,Ar-H,1H),2.37(s,CH3,6H)。13C NMR(100 MHz,CDCl3)δ: 176.4,156.1,153.0,139.3,138.0,133.5,131.6,129.9,126.7,126.4,125.1,122.0,118.0,21.3。
1.3.13 3-(2,4-dimethylphenyl)-4H-chromen-4-one mp 144.0~145.2 ℃;MS(ESI)m/z: 250 [M]+。1H NMR(400 MHz,CDCl3)δ: 8.31(d,J=8.0 Hz,Ar-H,1H),7.87(s,Ar-H,1H),7.70(m,Ar-H,1H),7.50(d,J=8.4 Hz,Ar-H,1H),7.43(m,Ar-H,1H),7.12(s,Ar-H,1H),7.07(m,Ar-H,2H),2.37(s,CH3,3H),2.23(s,CH3,3H)。13C NMR(100 MHz,CDCl3)δ:176.1,156.4,153.4,138.4,137.8,133.5,131.0,130.4,128.6,126.5,126.4,125.1,124.8,124.4,118.0,21.1,20.0。
1.3.14 3-(4-methoxyphenyl)-4H-chromen-4-one mp 134.5~135.8 ℃;MS(ESI)m/z: 252 [M]+。1H NMR(400 MHz,CDCl3)δ: 8.32(d,J=8.0 Hz,Ar-H,1H),8.00(s,Ar-H,1H),7.68(m,Ar-H,1H),7.56-7.37(m,Ar-H,4H),6.98(d,J=8.2 Hz,Ar-H,2H),3.84(s,OCH3,3H)。13C NMR(100 MHz,CDCl3)δ:176.4 159.6,156.2,152.5,133.5,130.1,126.4,125.1,125,124.5,124.1,118.0,114.0,55.3。
2 结果与讨论
2.1 氮杂环卡宾钯配合物(Cat4)催化Suzuki-Miyaura偶联反应的条件筛选
首先,以氯苯与对甲基苯硼酸的反应为模型反应,对溶剂、碱、催化剂用量等进行筛选。由表1可知,以无水乙醇为溶剂,当碱使用K3PO4或KOH时,可以得到很好的收率。考虑到KOH的强碱性,容易对带有功能基团的底物造成破坏,最终选用K3PO4作为反应体系的碱,进一步对溶剂进行筛选,发现以无水乙醇效果最好。在对催化剂用量进行优化时发现,随着催化剂用量的降低,产率显著减低。因此,确定最佳条件为:1 mmoL卤代芳烃,1.2 mmoL芳硼酸,1.5 mmoL K3PO4,3 mL乙醇,反应温度80 ℃,反应时间4 h,催化剂用量0.1%,空气下直接反应。
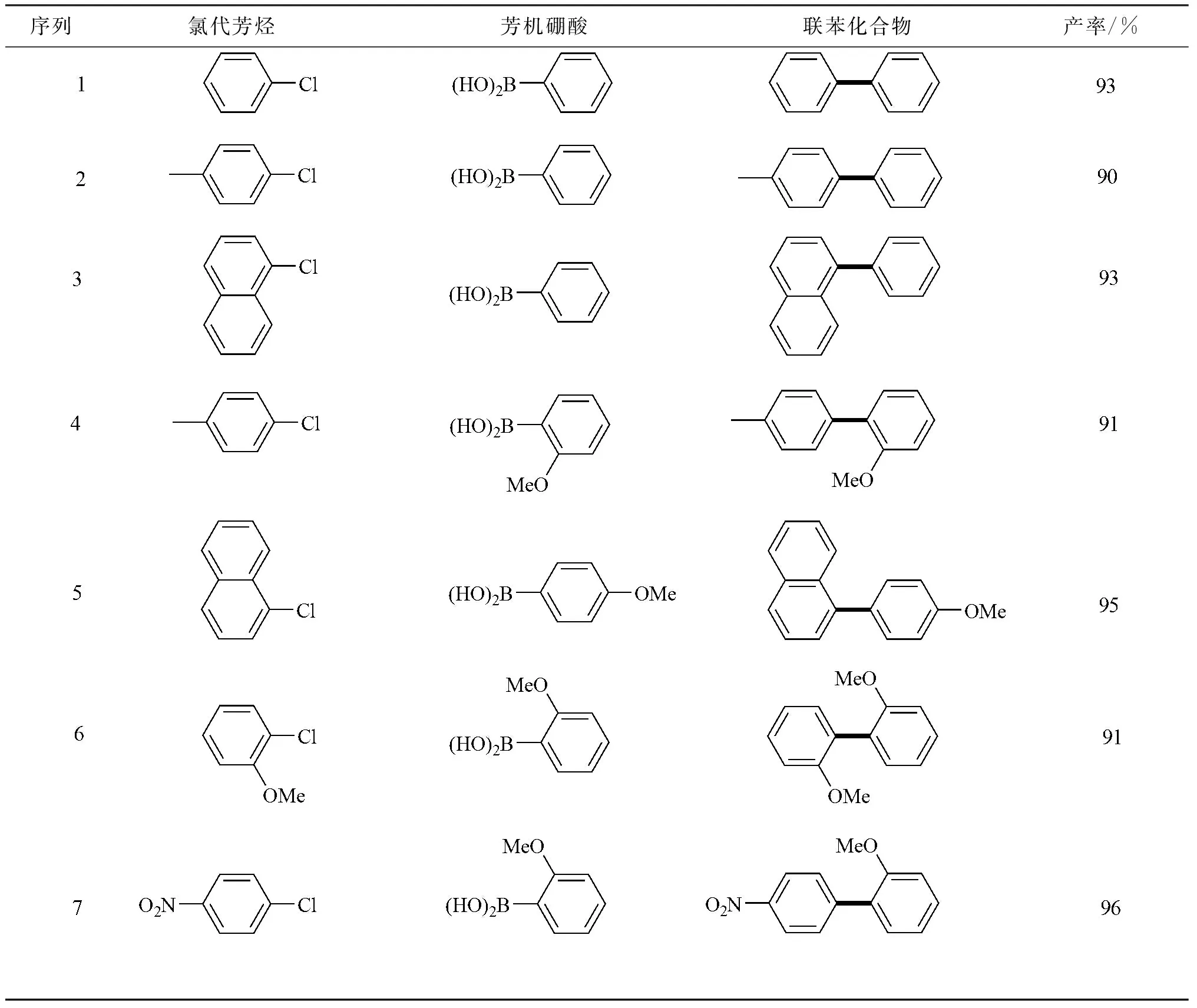
2.2 卤代芳烃与芳基硼酸的Suzuki-Miyaura偶联反应
根据以上确定的最佳反应条件,扩大氯代芳烃与芳机硼酸的范围,合成了一系列联苯类化合物。从表2可见,采用该体系合成各类联苯类化合物均有较高的收率。
表1 氮杂环卡宾钯配合物催化Suzuki-Miyaura偶联反应的条件筛选
Table 1 Screening of the Suzuki-Miyaura coupling reaction catalyzed by theN-heterocyclic carbene palladium complexes

序列 Cat4用量/mmol碱溶剂产率/%序列 Cat4用量/mmol碱溶剂产率/%10.001K3PO4EtOH94100.001K3PO4MeOH7320.001K2CO3EtOH74110.001K3PO4iPrOH8030.001KOHEtOH95120.001K3PO41,4-dioxane040.001NaOHEtOH88130.001K3PO4Toluene050.001Cs2CO3EtOH8140.001K3PO4THF3460.001KOtBuEtOH89150.001K3PO4H2O070.001NaHCO3EtOH7160.0005K3PO4EtOH6380.001Na2CO3EtOH14170.0001K3PO4EtOH2190.001KOAcEtOH0
注:反应条件为氯苯(1 mmoL),对甲基芳硼酸(1.2 mmoL),K3PO4(1.5 mmoL),Cat 4(0.001 mmoL),溶剂(3 mL),反应温度80 ℃,反应时间为4 h,空气中直接反应,气相色谱法测定产率。
表2 最佳条件下氮杂环卡宾钯配合物催化氯代芳烃与芳硼酸的Suzuki-Miyaura偶联反应
Table 2N-heterocyclic carbene palladium complexes catalyzed Suzuki-Miyaura cross-coupling reactions under the optimal conditions
序列氯代芳烃芳机硼酸联苯化合物产率/%
注:反应条件为氯代芳烃(1 mmoL),芳硼酸(1.2 mmoL),K3PO4(1.5 mmoL),Cat4(0.001 mmoL),乙醇(3 mL),反应温度80 ℃,反应时间为4 h,空气中直接反应,气相色谱法测定产率。
2.3 3-溴色酮与芳硼酸的Suzuki-Miyaura偶联反应
为了进一步证明该研究在中药活性成分合成中的应用,在该反应体系下,以3-溴色酮为原料,催化合成了7个异黄酮类化合物。表3所合成的7个异黄酮类化合物产率都在85%之上,可见该催化剂催化活性较高。
表3 最佳条件下氮杂环卡宾钯配合物催化3-溴色酮与芳硼酸的Suzuki-Miyaura偶联反应
Table 3N-heterocyclic carbene palladium complexes catalyzed cross-coupling reactions of 3-bromine chromone with arylboronic acids under the optimal conditions

序列3-溴色酮芳硼酸异黄酮类化合物产率/%
注:反应条件为3-溴色酮(1 mmoL),芳硼酸(1.2 mmoL),K3PO4(1.5 mmoL),Cat4(0.001 mmoL),乙醇(3 mL),反应温度80 ℃,反应时间为4 h,空气中直接反应,气相色谱测得产率。
3 结论
本文所报道的氮杂环卡宾钯配合物,合成条件温和,催化效率高。通过催化Suzuki-Miyaura偶联反应,合成了7个联苯类化合物及7个异黄酮类化合物。所有化合物均经过1H NMR和13C NMR表征,以及元素分析确定结构。该反应体系具有催化剂容易制备,目标产物收率高,操作简单,后处理方便等优点。本研究对含联苯类及异黄酮类化合物中药活性成分的全合成、半合成或者结构修饰具有一定的参考价值。
[1] 高学敏. 中药学[M]. 北京:中国中医药出版社,2011:1-15.
[2] 姚云,兰小兵,何小溪,等.羧基亚胺配体促进钯催化中药活性成分噻吩类化合物的C-H活化研究[J].广东药学院学报,2015,31(6):720-726.
[3] 胡秀丽.中药活性成分提取和分离的研究[D].长春:吉林大学,2008.
[4] 马爱英,李云政.异黄酮类化合物的合成研究进展[J].山东化工,2003,32(6):10-12.
[5] 刘洋.异黄酮类化合物及其衍生物的设计与合成[D].沈阳:沈阳药科大学,2009.
[6] 匡海学.中药化学[M].北京:中国中医药出版社,2011:127-170.
[7] 李秋莲.黄酮及异黄酮类化合物的合成研究[D].苏州:苏州大学,2011.
[8] 胡宇才,黄志成,丁波,等.氮杂环卡宾催化剂在催化多种偶联反应中的应用[J].化学世界,2016(3):187-191.
[9] ARDUENGO A J,HARLOW R L,KLINE M A. Stable crystalline carbine[J]. J Am Chem Soc,1991,113:361-363.
[10] VALENT C,CALIMSIZ S,HOI K H,et al. The development of bulk palladium NHC complexes for the most-challenging cross-coupling reactions[J]. Angew Chem Ed,2012,51: 3314-3332.
[11] 张新生,姚云,刘睿智,等.ɑ-二亚胺钯配合物的合成及催化Suzuki偶联反应[J].化学研究与应用,2015,27(5):600-607.
[12] VALENTE C,POMPEO M,SAYAH M,et al. Carbon-Heteroatom coupling using Pd-PEPPSI complexes[J]. Org Process Res Dev,2014,18:180-190.
[13] 刘睿智,张新生,杨海清,等. 羧基亚胺配体的合成及其促进Suzuki偶联反应的研究[J].化学通报,2015,78(7):627-632.
(责任编辑:陈翔)
N-heterocyclic carbene palladium complexes: applications for the synthesis of active ingredients of traditional chinese medicine including biphenyl derivatives and isoflavones
LAN Xiaobing1,MAI Jizhong1,LIU Fengshou1,OUYANG Jiasheng1,LI Yanfang1,SHEN Dongsheng1,2
(1.SchoolofChemistryandChemicalEngineering,GuangdongPharmaceuticalUniversity,Zhongshan528458,China; 2.GuangdongCosmeticsEngineering&TechnologyResearchCenter,Zhongshan528458,China)
Objective To synthesize biphenyl derivatives and isoflavones by Suzuki-Miyaura cross-coupling reactions catalyzed byN-heterocyclic carbene palladium complexes. Methods AN-heterocyclic carbene palladium complexes was synthesized and developed as an efficient catalyst for the coupling reaction of aryl boronic acids and aryl halides. The optimal reaction conditions were determined via the change of catalyst loading,solvent and alkali. Under the optimal conditions,biphenyl derivatives and isoflavones were obtained. Results AN-heterocyclic carbene palladium complexes was synthesized. The optimal conditions were as follows: 0.001 molN-heterocyclic carbene palladium complexes as catalyst,EtOH as solvent,1.5 mmoL K3PO4as alkali,reaction for 4 h in the air at 80 ℃. Seven biphenyl derivatives and seven isoflavones were obtained and characterized by MS,1H NMR and13C NMR. Conclusion AN-heterocyclic carbene palladium complexes has been synthesized and successfully developed as an efficient catalyst for the Suzuki-Miyaura cross-coupling reactions. The research could provide reference for synthetic,semi-synthetic or structure modification of active ingredients traditional Chinese medicine.
N-heterocyclic carbene; Suzuki-Miyaura; active ingredients; biphenyl derivatives; isoflavones
2016-09-02
国家自然科学基金项目(21004014)
兰小兵(1990—),男,2014级中药学专业硕士,Email:619843282@qq.com;通信作者:申东升(1961—),男,教授, 主要从事药物有机合成研究,Email:sds8@163.com。
时间:2016-11-24 16:16
http://www.cnki.net/kcms/detail/44.1413.R.20161124.1616.005.html
R913
A
1006-8783(2016)06-0705-07
10.16809/j.cnki.1006-8783.2016090202
