用双萤光素酶报告基因技术验证小鼠lncRNA-H19与miR-199a-5p的靶向关系*
2017-01-04侯婧瑛周长青郑韶欣郭天柱龙会宝伍权华钟婷婷
侯婧瑛, 周长青, 郑韶欣, 郭天柱, 龙会宝, 伍权华, 钟婷婷, 吴 浩, 汪 蕾, 王 彤△
(中山大学孙逸仙纪念医院 1急诊科, 2心内科, 广东 广州 510120)
用双萤光素酶报告基因技术验证小鼠lncRNA-H19与miR-199a-5p的靶向关系*
侯婧瑛1, 周长青1, 郑韶欣2, 郭天柱1, 龙会宝1, 伍权华1, 钟婷婷1, 吴 浩1, 汪 蕾1, 王 彤1△
(中山大学孙逸仙纪念医院1急诊科,2心内科, 广东 广州 510120)
目的: 构建长链非编码RNA-H19(lncRNA-H19)萤光素酶报告质粒,利用双萤光素酶报告基因技术验证小鼠lncRNA-H19与微小RNA-199a-5p(miR-199a-5p)的靶向关系。方法:通过生物信息学网站RegRNA 2.0预测获取小鼠lncRNA-H19 与miR-199a-5p潜在的互补结合位点。将H19及其突变体克隆到萤光素酶载体psiCHECK-2中,构建H19 野生型和突变型质粒,并采用酶切和测序方法鉴定psiCHECK-2-H19 载体是否构建成功。将H19 野生型和突变型质粒分别与miR-199a-5p模拟物、miR-199a-5p抑制剂、miR-199a-5p模拟物阴性对照或miR-199a-5p 抑制剂阴性对照在293T 细胞中共转染。收集细胞后通过双萤光素酶报告系统检测不同组别的萤光素酶活性,从而对lncRNA-H19 与miR-199a-5p的靶向调节关系进行验证。结果:构建的重组萤光素酶报告质粒经酶切及测序鉴定正确,双萤光素酶报告基因检测显示,与miR-199a-5p模拟物阴性对照组相比,miR-199a-5p模拟物组H19野生型报告基因的萤光素酶活性显著降低,下降约49%左右(P<0.01),而miR-199a-5p 抑制剂组H19 野生型报告基因的萤光素酶活性较miR-199a-5p模拟物组明显增高(P<0.01)。miR-199a-5p模拟物、miR-199a-5p抑制剂、miR-199a-5p模拟物阴性对照以及miR-199a-5p 抑制剂阴性对照对H19突变型的萤光素酶活性均无明显影响。结论:lncRNA-H19能够靶向结合miR-199a-5p,并在转录后水平对其有直接抑制作用。
长链非编码RNA-H19; 微小RNA-199a-5p; 双萤光素酶报告基因
非编码RNA在蛋白表达中具有重要调控作用。长链非编码RNA (long noncoding RNA, lncRNA)是一类转录本长度超过200个核苷酸的功能性RNA分子,其能够从不同层面实现对基因表达的调控作用[1]。微小RNA (microRNA, miRNA)是一类长约22个核苷酸分子的内源性非编码RNA,通过与靶基因3’端非翻译区(untranslated region, UTR)的不完全结合而发挥对基因表达的负向调节[2]。现有的证据表明lncRNA可通过碱基互补配对原则竞争性结合miRNA从而抑制miRNA对靶基因表达的调控[3-4]。在本研究中,我们通过生物信息学网站RegRNA 2.0数据库进行预测获取小鼠lncRNA-H19 与miR-199a-5p潜在的互补结合位点,在此基础上,进一步构建含小鼠lncRNA-H19序列的野生型和突变型质粒的双萤光素酶报告基因载体,并采用双萤光素酶报告基因检测验证小鼠lncRNA-H19与miR-199a-5p之间的靶向关系。
材 料 和 方 法
1 细胞系和试剂
DMEM 高糖培养液、胎牛血清(fetal bovine se-rum,FBS)和胰蛋白酶均购自HyClone;miR-199a-5p模拟物、抑制剂及相应对照序列(广州锐博生物科技有限公司);psiCHECK-2 双萤光素酶报告基因载体、萤光素酶检测试剂盒和双萤光素酶基因报告分析系统(Promega);转染试剂Lipofectamine 2000 (Invitrogen);293T 细胞(中国科学院细胞库)。
2 细胞培养
293T细胞使用含10% FBS 的DMEM (含4.0 mmol/L 谷氨酰胺、1×105U/L青霉素和100 mg/L链霉素),37 ℃、5% CO2饱和湿度培养箱中培养。待细胞生长成均匀单层细胞并达90%以上聚集度时传代,将培养基吸出加入500μL 0.25%胰蛋白酶室温下短暂消化,于显微镜下观察当细胞皱缩变圆时立即加入DMEM培养基,反复吹打成细胞悬液,血球计数板计数,以含10% FBS的DMEM调整细胞密度后重新接种于10 cm 细胞培养皿,每皿5×106细胞,置于37 ℃ 、5% CO2培养箱内培养。24 h待细胞密度达70%~80%时即可用于转染。
3 方法
3.1 实验分组和相关序列信息 本实验设立小鼠lncRNA-H19野生型和突变型(H19-Mut),其中各型又分为5组:空白组(blank组,为单纯的293T细胞)、miR-199a-5p模拟物组(miR-199a-5p组)、miR-199a-5p模拟物阴性对照(negative control, NC)组、miR-199a-5p抑制剂组(miR-199a-5p inhibitor组)和miR-199a-5p抑制剂阴性对照组(NC inhibitor组)。NC组采用通用的miRNA mimic N control #24,成熟miRNA名称为cel-miR-67-3p,编号为MIMAT0000039。以上所涉及引物序列信息详见表1。

表1 引物序列
F: forward; R: reverse.
3.2 小鼠lncRNA-H19表达载体及其突变载体构建 分析lncRNA-H19基因序列,确定与miR-199a-5p潜在结合位点,H19扩增引物序列由苏州金唯智公司合成,PCR扩增后进行产物回收,再进行载体双酶切,XhoI酶切位点和NotI酶切位点见图1和表1下划线所示,扩增片段为2 288 bp。将酶切回收的PCR产物与psiCHECK-2载体进行连接。连接产物转化后质粒提取并酶切鉴定阳性克隆,送阳性质粒测序。H19突变采用overlap PCR法。测序结果进行BLAST比对确认H19以及H19-Mut已成功克隆至psiCHECK-2载体中。H19突变位点如图2所示。

Figure 1.Vector structure map of psiCHECK.
图1 psiCHECK-2载体结构图谱

Figure 2.Combination site of miR-199a-5p and lncRNA-H19, and mutation site of H19.
图2 miR-199a-5p与lncRNA-H19结合位点及H19突变位点
3.3 阳离子脂质体法进行细胞转染 转染前1 d,细胞按2×104cells/well接种于含10% FBS的DMEM 高糖培养基测定24孔板上。转染当天,细胞汇合度约为70%~80%,吸去旧的培养基,用PBS洗涤2次,然后每孔加入300 μL OPTI-MEM培养基,置于5% CO2、37 ℃培养箱中;每个孔用OPTI-MEM培养基稀释1 μL Lipofectamine 2000,终体积为50 μL,室温下静置5 min;每个孔加入20 μmol/L浓度的microRNA 1 μL或microRNA抑制剂和0.5 μg质粒,再加入OPTI-MEM至总体积50 μL(最终孵育液中为50 nmol/L microRNA或100 nmol/L microRNA抑制剂),室温下静置5 min;复合上述2个步骤中的稀释液,室温下静置20 min;每孔加入100 μL转染复合液,晃动24孔板稍加混匀;在5% CO2、37 ℃培养箱中孵育5 h,用新鲜的完全培养基(含FBS)替换含有转染复合物的培养基。
3.4 萤光素酶活性检测 用Promega的双萤光素酶基因报告分析系统进行样品萤光素酶活性检测。 转染48 h后,吸去旧的培养基,用PBS清洗2次,每孔细胞加入100 μL的PLB 缓冲液,室温轻微振摇15 min,收集细胞裂解液。将20 μL细胞裂解液加入发光板后,用GloMax生物发光检测仪读取背景值2 s,每样品加入100 μL LAR II工作液,快速混匀,读值2 s。读值完毕后,每样品再加入100 μL Stop & Glo®Reagent,快速混匀后,放入发光检测仪中,读值2 s。记录结果和保存数据。
4 统计学处理
统计学方法采用SPSS 17.0 统计软件分析,计量资料以均数±标准差(mean±SD)表示,报告基因分析中多组之间的差异比较采用单因素方差分析,组间两两比较采用Bonferroni法,以P<0.05 为差异有统计学意义。
结 果
1 psiCHECK-2-H19双萤光素酶报告基因载体的酶切鉴定和测序
psiCHECK-2-H19野生型和psiCHECK-2-H19 突变型酶切鉴定及测序结果均显示,目的基因H19和其突变型均已成功转入psiCHECK-2 载体中(图3)。酶切结果分析可见H19(2 288 bp)在相应的位置切出一条目的条带(图3红色箭头所指为目的片段),psiCHECK-2-H19双萤光素酶报告基因载体构建成功。

Figure 3.Endonuclease digestion and sequence analysis of the constructed recombinant plasmid.
图3 重组质粒酶切鉴定和测序
2 Promega 双萤光素酶报告基因检测
双萤光素酶报告基因检测显示,miR-199a-5p模拟物与小鼠H19野生型和突变型报告基因共转染293T 细胞后,H19野生型miR-199a-5p模拟物组的双萤光素酶活性相对值与空白组和NC组相比明显降低,下调约49%(P<0.01),而H19野生型miR-199a-5p抑制剂组双萤光素酶活性相对值与H19野生型miR-199a-5p模拟物组相比明显增加,上调48%(P<0.01)。miR-199a-5p模拟物、miR-199a-5p抑制剂、miR-199a-5p模拟物阴性对照和miR-199a-5p 抑制剂阴性对照对H19突变型萤光素酶活性无明显影响,见图4。
讨 论
lncRNA 作为一类新型的非编码RNA分子,在表观遗传调控、转录调控及转录后调控中均发挥重要作用[5-7],并且参与了细胞凋亡、增殖、分化等多种生物学过程[8]。lncRNA 已被证实与多种疾病的病理生理进程密切相关。miRNA是一类对基因表达进行负调控的分子,它能够阻遏靶标基因的翻译,也可以导致mRNA降解,在转录和翻译水平调节内源基因的表达[9]。现已证实 lncRNA与miRNA存在紧密联系,它可作为miRNA的前体,经过序列剪切产生 miRNA[10]。由lncRNA单一链加工形成的miRNA可分布于多种不同的亚细胞结构并执行相应的生物学功能。不仅如此,lncRNA还能够与具有相同miRNA应答元件的miRNA相结合,通过内源性竞争抑制效应调节相应miRNA的表达水平,从而影响相关靶基因的表达[11]。
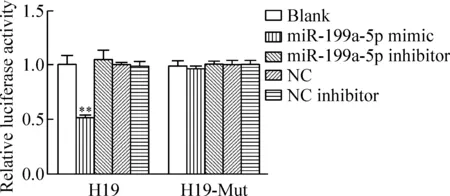
Figure 4.The results of Promega dual-luciferase reporter gene assay. Mean±SD.n=3.**P<0.05vsblank.
图4 Promega 双萤光素酶报告基因检测结果
lncRNA-H19是最先被报道的lncRNA之一,也是最早发现的印记基因之一,进化上高度保守,胚胎发育期呈高表达,出生后在大多数组织中表达下调[12],在调控细胞生长、凋亡、扩增及分化中具有重要作用,它能够促进细胞生长和对抗凋亡[13-14],而miR-199a-5p则被证实能够抑制细胞生存和产生促凋亡效应[15],小鼠的基因组在DNA和转录水平上与人类高度相似,目前小鼠模型已经用于研究多种人类疾病,其在功能基因组学和临床前药物研发等领域是一个十分重要的模型系统。本研究首先采用生物信息学网站RegRNA 2.0数据库预测获得小鼠lncRNA-H19和miR-199a-5p的可能结合位点,在此基础上构建含有小鼠H19野生型和突变型质粒的双萤光素酶报告载体,经双萤光素酶报告基因检测分析H19与miR-199a-5p之间的靶向作用关系。我们发现,miR-199a-5p转染组含H19野生型报告基因的萤光素酶活性显著降低,miR-199a-5p 抑制剂组H19 野生型报告基因的萤光素酶活性则较miR-199a-5p组明显增加,而miR-199a-5p模拟物、miR-199a-5p抑制剂以及阴性对照对H19突变型的表达均无明显影响。以上结果说明了lncRNA-H19与miR-199a-5p存在靶向结合作用,其在转录后水平对miR-199a-5p 有直接的抑制作用。而lncRNA-H19对miR-199a-5p的这种抑制作用对细胞生物学行为方面的具体影响如何将有待于我们在今后的研究中做进一步的深入探索。
[1] Hou J, Zhou C, Long H, et al. Long noncoding RNAs: novel molecules in cardiovascular biology, disease and regeneration [J]. Exp Mol Pathol, 2016, 100(3):493-501.
[2] Eguchi T, Kuboki T. Cellular reprogramming using defined factors and microRNAs [J]. Stem Cells Int, 2016, 2016:7530942.
[3] Liu L, Yang J, Zhu X, et al. Long noncoding RNA H19 competitively binds miR-17-5p to regulate YES1 expression in thyroid cancer [J]. FEBS J, 2016, 283(12):2326-2339.
[4] Su Z, Zhi X, Zhang Q, et al. LncRNA H19 functions as a competing endogenous RNA to regulate AQP3 expression by sponging miR-874 in the intestinal barrier [J]. FEBS Lett, 2016, 590(9):1354-1364.
[5] 覃伟峰, 仉红刚. lncRNA在心血管疾病中作用的研究进展 [J].中国病理生理杂志,2016,32(8):1471-1477.
[6] Schmitz SU, Grote P, Herrmann BG. Mechanisms of long noncoding RNA function in development and disease [J]. Cell Mol Life Sci, 2016, 73(13):2491-2509.
[7] Boon RA, Jaé N, Holdt L, et al. Long noncoding RNAs: from clinical genetics to therapeutic targets? [J]. J Am Coll Cardiol, 2016, 67(10):1214-1226.
[8] Piccoli MT, Gupta SK, Thum T. Noncoding RNAs as regulators of cardiomyocyte proliferation and death [J]. J Mol Cell Cardiol, 2015, 89(Pt A):59-67.
[9] Brümmer A, Hausser J. MicroRNA binding sites in the coding region of mRNAs: extending the repertoire of post-transcriptional gene regulation [J]. Bioessays, 2014, 36(6):617-626.
[10]Zhuang M, Gao W, Xu J, et al. The long non-coding RNA H19-derived miR-675 modulates human gastric can-cer cell proliferation by targeting tumor suppressor RUNX1 [J]. Biochem Biophys Res Commun, 2014, 448(3):315-322.
[11]Ergun S, Oztuzcu S. Oncocers: ceRNA-mediated cross-talk by sponging miRNAs in oncogenic pathways [J]. Tumour Biol, 2015, 36(5):3129-3136.
[12]Ratajczak MZ. Igf2-H19, an imprinted tandem gene, is an important regulator of embryonic development, a guardian of proliferation of adult pluripotent stem cells, a regulator of longevity, and a ‘passkey’ to cancerogenesis[J]. Folia Histochem Cytobiol, 2012, 50(2):171-179.
[13]Kawahara M, Wu Q, Kono T. Involvement of insulin-like growth factor 2 in angiogenic factor transcription in bi-maternal mouse conceptuses [J]. J Reprod Dev, 2010, 56(1):79-85.
[14]He P, Zhang Z, Huang G, et al. miR-141 modulates osteoblastic cell proliferation by regulating the target gene of lncRNA H19 and lncRNA H19-derived miR-675[J]. Am J Transl Res, 2016, 8(4):1780-1788.
[15]Song J, Gao L, Yang G, et al. MiR-199a regulates cell proliferation and survival by targeting FZD7 [J]. PLoS One, 2014, 9(10):e110074.
(责任编辑: 林白霜, 罗 森)
Identification of targeting relationship between mouse lncRNA-H19 and miR-199a-5p by dual-luciferase reporter assay
HOU Jing-ying1, ZHOU Chang-qing1, ZHENG Shao-xin2, GUO Tian-zhu1, LONG Hui-bao1, WU Quan-hua1, ZHONG Ting-ting1, WU Hao1, WANG Lei1, WANG Tong1
(1DepartmentofEmergency,2DepartmentofCardiology,SunYat-senMemorialHospitalofSunYat-senUniversity,Guangzhou510120,China.E-mail:tongwang316@163.com)
AIM: To validate the association between long noncoding (lncRNA)-H19 and microRNA-199a-5p (miR-199a-5p) through the dual-luciferase reporter gene system by construction of a luciferase reporter vector containing the gene of lncRNA-H19. METHODS: The potential complementary binding sites of lncRNA-H19 and miR-199a-5p were predicted by RegRNA 2.0. The H19 gene or its mutant (Mut) fragment was cloned into luciferase reporter vector psiCHECK-2. Restriction enzyme analysis and sequence analysis were used to identify whether the recombinant plasmids of the H19 and H19-Mut were successfully constructed. miR-199a-5p mimics, miR-199a-5p inhibitor, miR-199a-5p mimics negative control or miR-199a-5p inhibitor negative control was co-transfected into the 293T cells with the luciferase reporters containing H19 or H19-Mut. Dual-luciferase reporter assay was performed to detect the luciferase activity in different groups in order to verify the relationship between lncRNA-H19 and miR-199a-5p.RESULTS: The results of double enzyme digestion and DNA sequencing showed that the sequence of luciferase reporter vector was correct. The results of dual-luciferase reporter assay indicated that the H19 reporter gene luciferase activity significantly decreased in miR-199a-5p mimics group by 49% (P<0.01), and the H19 reporter gene luciferase activity was obviously upregulated in miR-199a-5p inhibitor group compared with miR-199a-5p mimics group (P<0.01). However, miR-199a-5p mimics, miR-199a-5p inhibitor, miR-199a-5p mimics negative control and miR-199a-5p inhibitor negative control showed no effect at H19-Mut reporter gene.CONCLUSION: lncRNA-H19 binds to miR-199a-5p to exert an inhibitory effect at transcriptional level.
Long noncoding RNA-H19; MicroRNA-199a-5p; Dual-luciferase reporter gene
1000- 4718(2016)12- 2256- 05
2016- 08- 23
2016- 10- 27
国家自然科学基金资助项目(No. 81270213; No. 81070125; No. 81670306);广东省科技计划(No. 2010B031600032; No. 2014A020211002);高校基本科研业务费中山大学青年教师重点培育项目(No.13ykzd16);广东省医学科研基金资助项目(No. A2016264)
R363
A
10.3969/j.issn.1000- 4718.2016.12.022
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 020-34071012; E-mail: tongwang316@163.com
