缺氧缺糖/复氧复糖PC12细胞自噬的形态学变化与细胞凋亡的关系*
2017-01-03靳晓飞李爱英武密山周晓红赵艳萌高维娟
靳晓飞, 张 颖, 李爱英, 武密山, 周晓红, 赵艳萌, 高维娟△
(1承德医学院病理生理学教研室,河北 承德 067000; 2河北中医学院,河北省心脑血管病中医药防治重点实验室,河北 石家庄 050200)
缺氧缺糖/复氧复糖PC12细胞自噬的形态学变化与细胞凋亡的关系*
靳晓飞1, 张 颖2, 李爱英2, 武密山2, 周晓红2, 赵艳萌2, 高维娟2△
(1承德医学院病理生理学教研室,河北 承德 067000;2河北中医学院,河北省心脑血管病中医药防治重点实验室,河北 石家庄 050200)
目的: 观察缺氧缺糖/复氧复糖PC12细胞自噬的形态学变化及其与细胞凋亡的关系,探讨自噬对PC12细胞的保护作用。方法:取对数生长期的PC12细胞,随机分为正常对照组、缺氧缺糖/复氧复糖组、自噬抑制剂组和自噬激活剂组。其中缺氧缺糖/复氧复糖组、自噬抑制剂组和自噬激活剂组进行缺氧缺糖3 h后再复氧复糖12 h,自噬抑制剂组和自噬激活剂组于复氧复糖的同时分别给予自噬抑制剂3-甲基腺嘌呤和自噬激活剂雷帕霉素。用透射电子显微镜和单丹磺酰尸胺荧光染色检测自噬小体的变化,Annexin V-FITC/PI流式细胞术和TUNEL染色检测细胞凋亡的情况。结果:与正常对照组相比,缺氧缺糖/复氧复糖组的自噬小体增多(P<0.05),细胞凋亡率和凋亡指数升高(P<0.05)。与缺氧缺糖/复氧复糖组相比,自噬抑制剂组的自噬小体明显减少(P<0.05),细胞凋亡率和凋亡指数显著升高(P<0.05),而自噬激活剂组自噬小体变大,数量明显增多(P<0.05),并偶见自噬溶酶体,细胞凋亡率和凋亡指数显著下降(P<0.05)。结论:缺氧缺糖/复氧复糖可以诱导PC12细胞发生自噬,且细胞自噬可以抑制细胞凋亡,发挥神经保护作用。
缺氧缺糖/复氧复糖; 自噬; 细胞凋亡; PC12细胞
自噬(autophagy)是细胞的一种自我吞噬现象,具有高度保守和精确调节的特点,广泛存在于真核生物细胞内。当机体遇到饥饿、感染、药物等因素刺激时,自噬可被大量激活,形成具有双层膜结构的自噬小体,并通过自噬溶酶体途径降解胞内的长寿命蛋白或老化损伤的细胞器,以实现细胞本身代谢的需要和细胞器的更新[1-2]。大量研究证实,自噬和凋亡在脑缺血再灌注损伤中发挥着非常关键的作用[3-4],且贯穿于整个病变过程。研究发现,在脑缺血再灌注损伤的发生发展过程中,轻度缺氧缺血情况下,细胞自噬可发挥一定保护作用,而抑制自噬可加重损伤[5-7]。利用透射电子显微镜观察自噬小体的变化被认为是检测自噬的金标准,并且在某种程度上自噬小体的多少代表了自噬活动的强弱[8],而在脑缺血再灌注损伤过程中,自噬小体的变化与细胞凋亡的关系如何?相关报道尚不详细。因此,本实验以常用于神经系统疾病体外研究的PC12细胞为实验对象,建立缺氧缺糖/复氧复糖细胞模型,模拟神经元缺血再灌注损伤,观察缺氧缺糖/复氧复糖PC12细胞自噬小体的变化,探讨细胞自噬对抑制细胞凋亡和发挥神经保护的重要作用。
材 料 和 方 法
1 主要材料和仪器
神经生长因子诱导后的高分化PC12细胞由河北医科大学第一医院许顺江教授惠赠;自噬检测试剂盒[单丹酰尸胺(monodansylcadaverine, MDC)法]购于凯基生物公司;TUNEL检测凋亡试剂盒购于Roche;Annexin V-FITC/PI双染色试剂盒购于BD;自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)和自噬激活剂雷帕霉素(rapamycin,RAPA)购于Sigma;马血清购于BI;胎牛血清购于PAR;RPMI-1640培养基由Gibco生产;Earle’s平衡盐溶液由LEAGENE生产;Triton X-100购于北京索莱宝科技有限公司;DAB试剂盒购于北京中山金桥生物技术公司;其它试剂为国产分析纯。二氧化碳培养箱3111型和三气培养箱3131型购于Thermo;荧光显微镜DM5000B型购于Leica;透射电子显微镜H-7650型购于HITACHI;流式细胞仪FACSAriaII型购于BD。
2 实验方法
2.1 细胞培养 PC12细胞接种在含10%胎牛血清、5%马血清和1%青、链霉素混合液的RPMI-1640培养液中,置于二氧化碳培养箱(37 ℃、5% CO2、饱和湿度)进行培养,每2~3 d换液1次,当细胞融合度达70%~80%时进行传代。
2.2 缺氧缺糖/复氧复糖细胞模型的建立与实验分组 取对数生长期的PC12细胞,随机分为4组:正常对照(control)组、模型(model)组(即缺氧缺糖/复氧复糖组)、自噬抑制剂3-MA组和自噬激活剂RAPA组。除正常对照组外,其余各组建立缺氧缺糖/复氧复糖细胞模型:弃去正常细胞培养液(RPMI-1640培养液,含10%胎牛血清、5%马血清和1%青、链霉素混合液),用预热的PBS清洗细胞2次,更换培养液为无糖Earle’s培养液模拟细胞缺血状态,然后放入含94% N2、5% CO2、1% O2的37 ℃三气培养箱内培养,氧糖剥夺3 h后,更换无糖Earle’s培养液为正常细胞培养液,放入37 ℃、5% CO2培养箱中继续培养12 h[9-10]。正常对照组正常培养,不进行任何处理;自噬抑制剂组和自噬激活剂组氧糖剥夺3 h后复氧复糖的同时分别加入3-MA(终浓度为5 mmol/L)和RAPA(终浓度为250 nmol/L),直到培养结束。
2.3 透射电子显微镜检测自噬小体 0.25%胰蛋白酶(不含EDTA)对细胞进行消化;PBS清洗细胞2次;1 000 r/min离心5 min;2.5%戊二醛固定细胞4 h;PBS浸洗3次;1%锇酸固定细胞2 h;PBS浸洗2次;丙酮逐级脱水(50%、70%、80%、90%、100%)2遍;包埋剂∶纯丙酮1∶1配制, 37 ℃浸透1 h,包埋剂∶纯丙酮3∶1配制,37 ℃浸透3 h,纯包埋剂37 ℃浸透5 h;37 ℃恒温箱12 h和60 ℃恒温箱36 h聚合;超薄切片机切片(厚度约50 nm);醋酸双氧铀和酸铅双重染色;HITACHI H-7650型透射电子显微镜观察单位面积内自噬小体的形态变化和数目。
2.4 MDC荧光染色检测自噬小体 参考凯基生物公司自噬检测试剂盒(MDC法)说明书进行操作,将细胞接种到24孔板中做细胞爬片,初始浓度为2×108/L,置于CO2培养箱培养24 h,细胞贴壁后,进行造模及给药处理。4%多聚甲醛室温固定细胞25 min;PBS浸洗2次;300 μL 1× wash buffer 清洗细胞2次;每孔加入100 μL MDC工作液(1× wash buffer与MDC染色液按9∶1混合),室温避光反应45 min;弃去MDC工作液,300 μL 1× wash buffer 清洗细胞3次;每孔加入100 μL collection buffer覆盖细胞爬片;荧光显微镜观察并计算单位面积内荧光斑点的数目,激发滤光片波长为355 nm,阻断滤光片波长为512 nm。
2.5 Annexin V-FITC/PI流式细胞术检测细胞凋亡百分率 参考BD凋亡试剂盒说明书进行操作,0.25%胰蛋白酶(不含EDT A)消化细胞,1 500 r/min将细胞离心5 min,4 ℃ PBS清洗细胞2次,100 μL 1× binding buffer重悬细胞(约含1×105个细胞),同时加入5 μL FITC和5 μL PI,避光室温反应15 min,最后加入400 μL 1× binding buffer,1 h内上机检测各组细胞凋亡百分率。
2.6 TUNEL染色检测细胞凋亡 参考Roche的TUNEL凋亡试剂盒说明书进行操作,细胞接种于6孔板做爬片,初始细胞浓度为2×108/L,置于二氧化碳培养箱培养24 h,待细胞贴壁后进行造模及给药处理。细胞在4%多聚甲醛中室温固定25 min,0.2%的Triton X-100透化细胞5 min,新鲜配制的3% H2O2室温处理细胞5 min,待玻片干后,加50 μL TUNEL反应混合液(TdT与dUTP按1∶9混合)于细胞上,阴性对照组仅加50 μL dUTP液,37 ℃避光湿盒反应60 min,待玻片干后,加50 μL converter-POD于细胞上,37 ℃避光湿盒反应30 min,加100 μL DAB显色剂,室温反应10 min,苏木素复染,几秒后用自来水冲洗,脱水,透明,封片。细胞核被染成棕黄色者为凋亡细胞(即阳性细胞),每张切片在高倍镜下(×400)随机选取5 个不同的视野,计算每个视野中阳性细胞所占比例(即细胞凋亡指数),取其平均值。
3 统计学处理
用SPSS 19.0统计软件进行分析,数据用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,各组均数间两两比较使用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 透射电子显微镜观察缺氧缺糖/复氧复糖PC12细胞自噬小体的变化
正常对照组无典型自噬小体的形成;模型组可见包裹着细胞内容物的空泡状双层膜结构,即自噬小体;与模型组相比,自噬抑制剂组自噬小体减少(P<0.05),而自噬激活剂组自噬小体变大,数量显著增多(P<0.05),并偶见单层膜囊泡样结构,即自噬溶酶体,见图1。
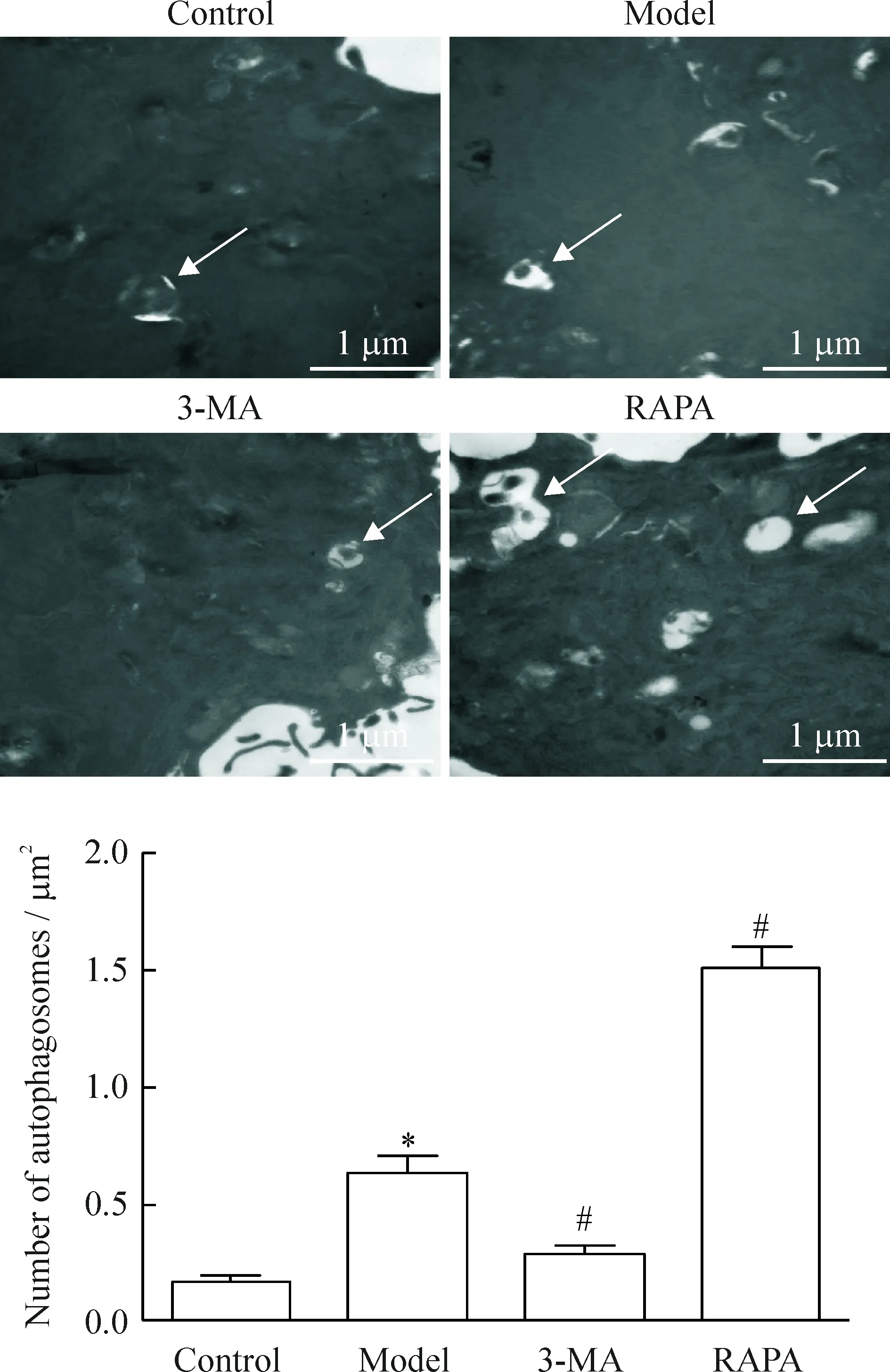
Figure 1.The morphological observations of autophagosomes under transmission electron microscope. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsmo-del group.
图1 透射电子显微镜检测各组细胞自噬小体的结果
2 MDC荧光染色观察缺氧缺糖/复氧复糖PC12细胞自噬小体的变化
正常对照组偶见少量荧光斑点,荧光强度微弱;与正常对照组相比,模型组荧光斑点增多(P<0.05),且荧光强度增强;与模型组相比,自噬抑制剂组荧光斑点显著减少(P<0.05),荧光强度减弱,而自噬激活剂组荧光斑点显著增多(P<0.05),差异有统计学意义。该实验结果与透射电子显微镜所得结果趋势相一致,见图2。
3 流式细胞术检测缺氧缺糖/复氧复糖PC12细胞凋亡率
与正常对照组相比,模型组细胞凋亡率显著升高(P<0.05);与模型组相比,自噬抑制剂组细胞凋亡率升高(P<0.05),而自噬激活剂组细胞凋亡率下降(P<0.05),差异有统计学意义,见图3。
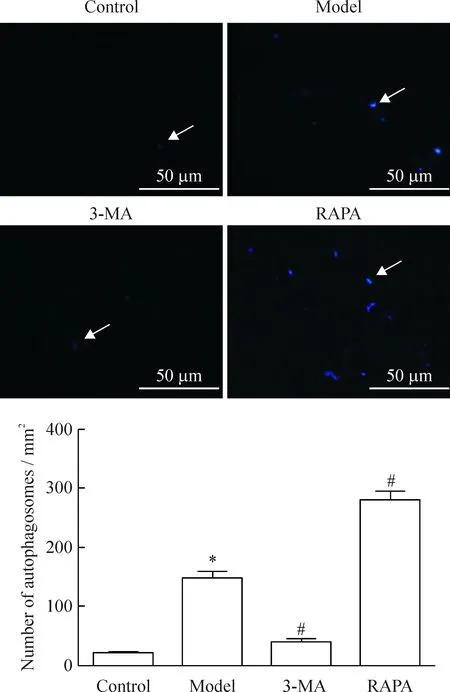
Figure 2.The observation of autophagosomes with MDC fluorescent staining. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsmodel group.
图2 MDC荧光染色检测各组细胞自噬小体的结果
4 TUNEL染色检测缺氧缺糖/复氧复糖PC12细胞凋亡
正常对照组偶见凋亡细胞;与正常对照组相比,模型组细胞凋亡指数升高(P<0.05);与模型组相比,自噬抑制剂组细胞凋亡指数显著升高(P<0.05),而自噬激活剂组细胞凋亡指数显著下降(P<0.05),差异有统计学意义。该实验结果与流式细胞术所得结果趋势相一致,见图4。
讨 论
自噬是指从内质网膜、高尔基体膜或线粒体外膜脱落形成的双层膜与需要降解的长寿命蛋白或老化损伤的细胞器集结在一起,形成自噬小体,并与溶酶体逐渐融合形成自噬溶酶体,通过自噬溶酶体途径降解其所包裹的大分子物质,提供急需的营养物质,以维持细胞内环境的稳定。自噬分为3种类型:巨自噬、微自噬和分子伴侣介导的自噬,我们通常所说的细胞自噬为巨自噬,也是目前研究最多和最深入的。自噬的检测方法主要包括透射电子显微镜下形态学观察、MDC荧光染色、自噬相关蛋白的直接或间接检测等,应用透射电子显微镜观察自噬小体的变化是检测自噬最经典、最直接的方法,被认为是检测自噬的金标准。
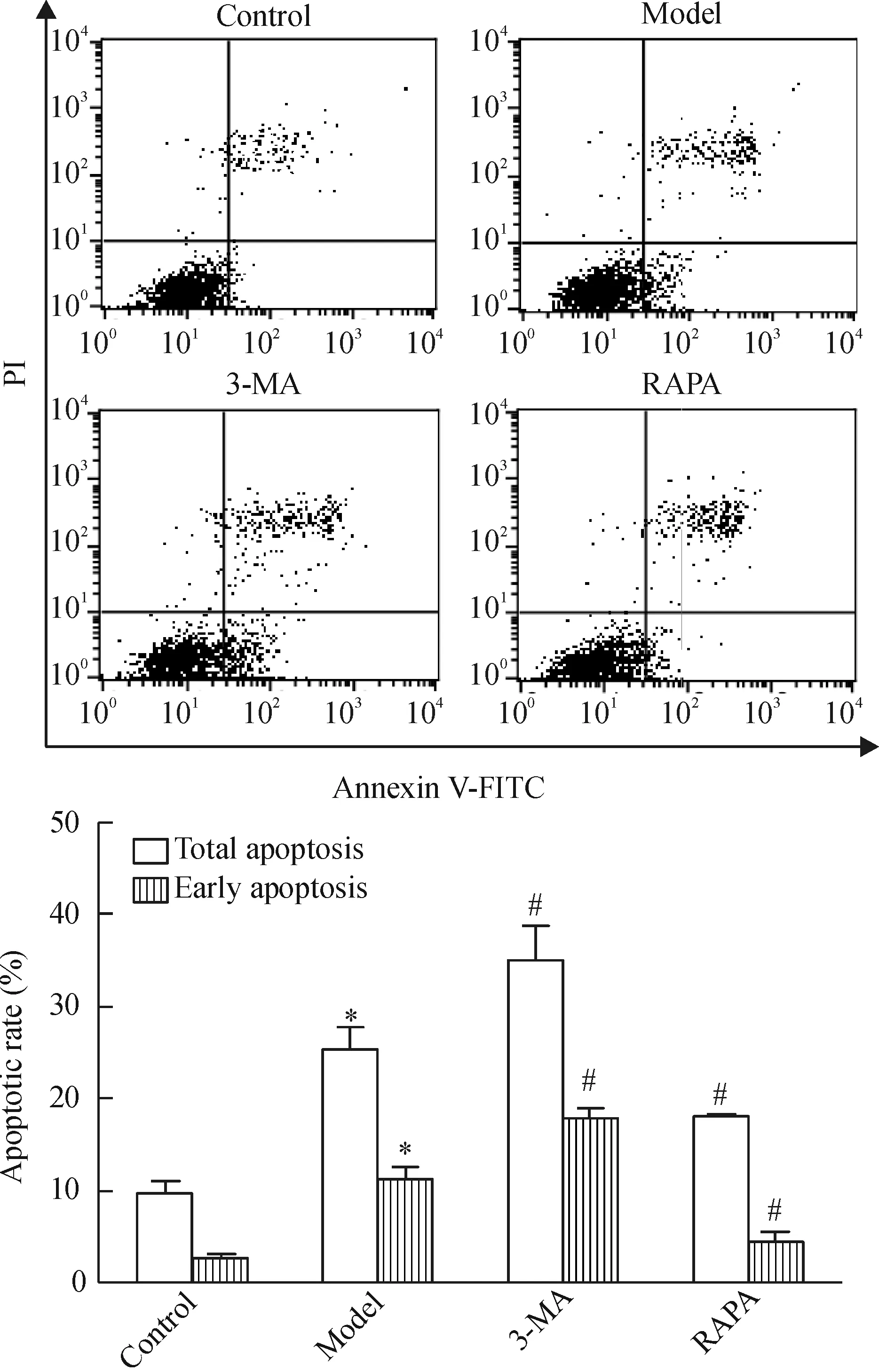
Figure 3.The changes of the apoptotic rates in the PC12 cells with different treatments examined by flow cytometry with Annexin V-FITC/PI staining. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsmodel group.
图3 Annexin V-FITC/PI双染流式细胞术检测各组细胞凋亡率的比较
自噬功能的异常可导致多种脑血管疾病的发生或发展[6]。Puyal 等[11]研究发现,于脑缺血再灌注损伤前给予自噬激活剂可明显减轻脑缺血再灌注损伤,缩小脑梗死容积,减轻神经功能障碍。Carloni 等[12]研究发现,大鼠脑缺血缺氧4 h后海马和皮质神经元中的自噬相关基因beclin-1表达上调,在缺血缺氧24 h达到高峰,应用自噬激活剂雷帕霉素后beclin-1表达显著上调,同时死亡的海马和皮质神经元数量明显减少,而给予自噬抑制剂3-MA后,beclin-1表达下降,死亡的海马和皮质神经元数量增多。Sheng 等[13]研究发现,在离体培养的氧糖剥夺细胞模型中,缺氧缺糖可以诱导PC12细胞发生自噬,LC3-Ⅱ水平和自噬小体数量明显升高,而应用自噬抑制剂3-MA后细胞活性降低,损伤明显加重。
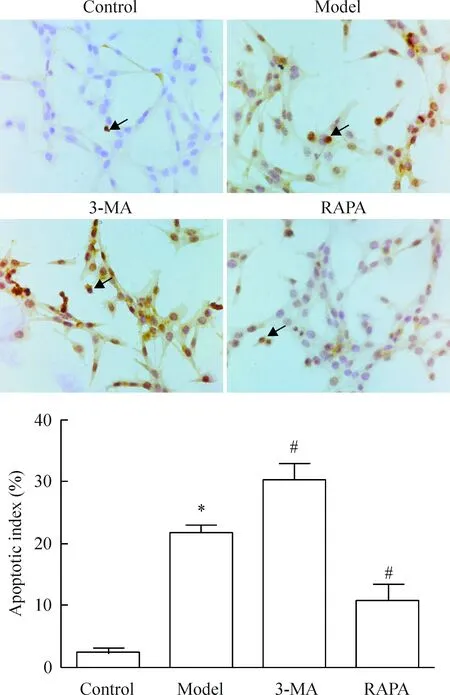
Figure 4.The changes of the apoptosis in the PC12 cells with different treatments examined by TUNEL(×400). Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsmodel group.
图4 TUNEL染色检测各组细胞凋亡的结果
细胞凋亡是指由体内体外多种因素触发细胞内存的死亡程序而导致的细胞死亡过程,被称为I型程序性细胞死亡[14],而由于过度自噬导致的细胞死亡被称为II型程序性细胞死亡[15]。自噬和凋亡既有明显的区别,又存在着复杂的联系。Ryter 等[16]报道,在心肌缺血损伤中,细胞自噬可抑制心肌细胞的凋亡,减轻缺血导致的继发性损伤,但过度自噬会促进细胞凋亡。眭怡群等[17]报道,自噬相关基因 beclin-1、LC3与凋亡相关基因BCL-2、p53在大肠癌的发生、发展中起协调作用。Bauvy 等[18]研究发现,在 HT-29结肠癌细胞中应用自噬抑制剂3-MA后,细胞凋亡活性明显增强,提示细胞的自噬作用可抑制细胞凋亡。
本实验结果显示,缺氧缺糖/复氧复糖后PC12细胞内的自噬小体明显增多,应用自噬抑制剂后,自噬小体减少,细胞凋亡程度上升,而给予自噬激活剂后,自噬小体变大且数量明显增多,细胞凋亡程度显著下降。这表明缺氧缺糖/复氧复糖可以诱导PC12细胞发生自噬,形成具有典型双层膜结构的自噬小体,并且细胞自噬可以抑制细胞凋亡,发挥神经保护作用。
本实验初步研究了自噬的形态学变化与细胞凋亡的关系,但自噬是一把双刃剑,自噬过强会导致细胞死亡,并且自噬的发生是一个动态过程,如何更加精确地检测自噬、调控自噬、甚至应用药物干预自噬从而抑制细胞凋亡发挥神经保护作用将是我们下一步重点研究的方向。
[1] Ding WX, Ni HM, Gao W, et al. Linking of autophagy to ubiquitin-proteasome system is important for the regulation of endoplasmic reticulum stress and cell viability[J]. Am J Pathol, 2007, 171(2):513-524.
[2] Liu XQ, Sheng R, Qin ZH. The neuroprotective mechanism of brain ischemic preconditioning[J]. Acta Pharmacol Sin, 2009, 30(8):1071-1080.
[3] Alirezaei M, Kemball CC, Whitton JL. Auto-phagy, inflammation and neurodegenerative disease[J]. Eur J Neurosci, 2011, 33(2):197-204.
[4] 卢 娜, 魏林郁,王宝英,等. 自噬参与低氧预处理抗PC12细胞糖氧剥夺损伤过程[J]. 中国病理生理杂志, 2015, 31(9):1627-1632.
[5] Puyal J, Ginet V, Grishchuk Y, et al. Neuronal autophagy as a mediator of life and death: contrasting roles in chronic neurodegenerative and acute neural disorders[J]. Neuroscientist, 2012, 18(3):224-236.
[6] Komatsu M, Waguri S, Chiba T, et al. Loss of autophagy in the central nervous system causes neurodegeneration in mice[J]. Nature, 2006, 441(7095):880-884.
[7] Hara T, Nakamura K, Matsui M, et al. Suppression of basal autophagy in neural cells causes neurodegenerative disease in mice[J]. Nature, 2006, 441(7095):885-889.
[8] Swanlund JM, Kregel KC, Oberley TD. Investigating autophagy: quantitative morphometric analysis using electron microscopy[J]. Autophagy, 2010, 6(2):270-277.
[9] Cui D, Wang L, Qi A, et al. Propofol prevents autophagic cell death following oxygen and glucose deprivation in PC12 cells and cerebral ischemia-reperfusion injury in rats[J]. PLoS One, 2012, 7(4):e35324.
[10]董 琳, 童 煜, 毛 萌. PC12细胞氧糖剥夺/再灌注损伤中自噬与凋亡现象[J]. 中华实用儿科临床杂志, 2012, 27(18):1397-1401.
[11]Puyal J, Clarke PGH. Targeting autophagy to prevent neonatal stroke damage[J]. Autophagy, 2009, 5(7):1060-1061.
[12]Carloni S, Buonocore G, Balduini W. Protective role of autophagy in neonatal hypoxia-ischemia induced brain injury[J]. Neurobiol Dis, 2008, 32(3):329-339.
[13]Sheng R, Zhang LS, Han R, et al. Autophagy activation is associated with neuroprotection in a rat model of focal cerebral ischemic preconditioning[J]. Autophagy, 2010, 6(4):482-494.
[14]王建枝, 殷莲华. 病理生理学[M].第8版.北京:人民卫生出版社, 2013:146-151.
[15]Wei K, Wang P, Miao CY. A double-edged sword with therapeutic potential: an updated role of autophagy in ischemic cerebral injury[J]. CNS Neurosci Ther, 2012, 18(11):879-886.
[16]Ryter SW, Lee SJ, Smith A, et al. Autophagy in vascular disease[J]. Proc Am Thorac Soc, 2011, 7(1):40-47.
[17]眭怡群, 冯一中. 自噬相关基因LC3、Beclin-1与凋亡相关基因p53、BCL-2在大肠癌中的表达及意义[J]. 临床与实验病理学杂志, 2012, 28(3):282-286.
[18]Bauvy C, Gane P, Arico S, et al. Autophagy delays sulindac sulfide-induced apoptosis in the human intestinal colon cancer cell line HT-29[J]. Exp Cell Res, 2001, 268(2):139-149.
(责任编辑: 陈妙玲, 罗 森)
Relationship between morphological changes of autophagy and apoptosis in PC12 cells induced by oxygen-glucose deprivation and reoxygenation
JIN Xiao-fei1, ZHANG Ying2, LI Ai-ying2, WU Mi-shan2, ZHOU Xiao-hong2, ZHAO Yan-meng2, GAO Wei-juan2
(1DepartmentofPathophysiology,ChengdeMedicalCollege,Chengde067000,China;2HebeiUniversityofChineseMedicine,HebeiKeyLaboratoryofChineseMedicineResearchonCardiocerebrovascularDisease,Shijiazhuang050200,China.E-mail:gwj6088@163.com)
AIM: To investigate the relationship between morphological changes of autophagy and apoptosis in the PC12 cells induced by oxygen-glucose deprivation and reoxygenation. METHODS: The PC12 cells were randomly divided into normal control group, oxygen-glucose deprivation and reoxygenation group, autophagy inhibitor group and autophagy activator group. The cells in oxygen-glucose deprivation and reoxygenation group, autophagy inhibitor group and autophagy activator group were exposed to reoxygenation (12 h) after 3 h of oxygen-glucose deprivation, and autophagy inhibitor 3-methyladenine and autophagy activator rapamycin were added into the cells at the same time. Using transmission electron microscope and monodansylcadaverine fluorescence staining, the morphological changes of autophagosome were observed. The apoptosis of the PC12 cells were analyzed by flow cytometry with Annexin V-FITC/PI staining and TUNEL method. RESULTS: Compared with normal control group, the numbers of autophagosomes and the apoptotic rates increased in oxygen-glucose deprivation and reoxygenation group (P<0.05). Compared with oxygen-glucose deprivation and reoxygenation group, the numbers of autophagosomes decreased obviously (P<0.05) and the apoptotic rates increased markedly in autophagy inhibitor group (P<0.05). The numbers of autophagosomes increased obviously (P<0.05), the apoptotic rates decreased markedly (P<0.05), the autophagosomes became bigger in size, and autolysosomes was also found in autophagy activator group. CONCLUSION: Oxygen-glucose deprivation and reoxygenation induce autophagy in PC12 cells, and autophagy inhibits cell apoptosis to play a protective role.
Oxygen-glucose deprivation and reoxygenation; Autophagy; Cell apoptosis; PC12 cells
1000- 4718(2016)12- 2157- 06
2016- 08- 15
2016- 10- 08
河北省应用基础研究计划重点项目(No. 16967756D); 河北省普通高校高层次人才科学研究计划项目(No. GCC2014031); 河北省2016年博士学位点科研能力建设项目(No. 169677128D); 河北省重点学科建设项目; 河北省研究生创新资助项目
R363.2
A
10.3969/j.issn.1000- 4718.2016.12.006
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0311-89926007; E-mail: gwj6088@163.com
