斑点叉尾鮰冬季大规模死亡病原分离与鉴定
2017-01-03杨移斌刘天强阳涛胥宁董靖杨秋红刘永涛艾晓辉
杨移斌,刘天强,阳涛,胥宁,董靖,杨秋红,刘永涛,艾晓辉*
(1.中国水产科学研究院长江水产研究所,湖北 武汉 430223;2. 淡水水产健康养殖湖北省协同创新中心,湖北 武汉 430223;3. 通威股份有限公司动物保健研究所,四川成都 610041)
斑点叉尾鮰冬季大规模死亡病原分离与鉴定
杨移斌1,2,刘天强3,阳涛3,胥宁1,2,董靖1,2,杨秋红1,2,刘永涛1,2,艾晓辉1,2*
(1.中国水产科学研究院长江水产研究所,湖北 武汉 430223;2. 淡水水产健康养殖湖北省协同创新中心,湖北 武汉 430223;3. 通威股份有限公司动物保健研究所,四川成都 610041)
2016 年1—2月湖南安化地区网箱养殖的斑点叉尾鮰暴发大规模死亡,死亡率接近80%,发病鱼体重为1.5~2.0 kg。本研究从患病濒死鱼肝、脾、肾分离到1 株致病菌,对其进行常规理化特性、分子生物学、人工感染实验以及药敏性检测。结果显示,分离菌株理化特性与鲁氏耶尔森氏菌(Yersiniaruckeri)特征相符,与NCBI中登录的鲁氏耶尔森氏菌的16S rDNA基因同源性达99%以上,在系统发育树上与鲁氏耶尔森氏菌聚为一族。人工感染鱼出现与自然发病相似症状,并能够从发病鱼组织中再次分离到相同病原菌,表明鲁氏耶尔森氏菌为斑点叉尾鮰该病病原菌。该分离菌株对氟苯尼考、多西环素及新霉素等药物高度敏感,本研究为斑点叉尾鮰暴发性出血病防控提供了理论依据。[中国渔业质量与标准,2016,6(6):53-58]
斑点叉尾鮰;鲁氏耶尔森氏菌;16S rDNA;病害防控;鉴定
斑点叉尾鮰(Ictaluruspunctatus),又称沟鲶,属鲶形目(Siluriformes)、鮰科(Ictaluridae),于1984 年由湖北水产研究机构引进中国养殖。斑点叉尾鮰具有肉质鲜嫩、营养丰富、无肌间刺等优点,深受广大消费者的喜爱。其对中国养殖环境适应性较强,因此受到国内养殖者推崇,养殖范围及规模不断扩大,产量不断提高,目前斑点叉尾鮰养殖已在湖南、湖北、安徽和广东等全国30 多个省(市)有分布。但近年来由于养殖品种的种质退化,养殖环境日益恶化,斑点叉尾鮰在养殖过程中常遇到各种病害,死亡率通常很高,使斑点叉尾鮰养殖具有较大的风险,阻碍了其养殖业的进一步发展。目前报道的斑点叉尾鮰病害病原主要有气单胞菌属[1-2]、爱德华氏菌[3]、嗜麦芽寡养单胞菌[4]、海豚链球菌[5]等。
2016 年1—2月湖南安化地区网箱养殖的斑点叉尾鮰暴发大规模死亡,发病涉及同一水域大部分网箱,死亡率接近80%,发病鱼体重为1.5~2.0 kg。由于当时气温较低,养殖的斑点叉尾鮰已经不进食,给病害防控带来了极大的难度。本研究从患病的斑点叉尾鮰体内分离到一株高致病性的菌株,通过回归感染、鉴定及药敏分析等研究,确定了斑点叉尾鮰该病的病原菌及其种类,为斑点叉尾鮰养殖中冬季病害防控提供了参考依据。
1 材料与方法
1.1 材料
1.1.1 实验用鱼
具备典型症状的患病斑点叉尾鮰取自湖南安化水库网箱养殖基地;回归感染用鱼规格(150±5) g,购自武汉白沙洲水产市场,鱼体无伤痕,体格健壮,活力强,暂养7 d后无异常进行实验。
1.1.2 实验试剂
细菌生化微量鉴定管、药敏纸片、营养肉汤、营养琼脂培养基、BHI液体及琼脂培养基与水解酪蛋白琼脂均购自杭州微生物试剂有限公司;细菌基因组DNA 提取试剂盒、DNA分子Marker均购自上海生工生物工程有限公司。
1.2 方法
1.2.1 临床诊断
对发病水域养殖条件、发病斑点叉尾鮰规格及发病情况进行现场调查;取濒死病鱼进行临床诊断,确定该病的典型症状,并取病鱼鳃、肝、肾及脾等重要组织器官进行光学显微观察。
1.2.2 病原菌分离纯化
取具有典型症状患病濒死斑点叉尾鮰的肝、肾、脾,在无菌条件下,在营养琼脂及脑心浸出液平板上划线。将平板置于28 ℃培养箱中24 h,挑取形态大小一致的优势菌落进一步纯化培养。分离纯化到的菌株加入浓度为25%的甘油,置于-80 ℃冰箱保存。
1.2.3 人工回归感染
将分离纯化后的菌株接种于普通营养琼脂平板上,28 ℃培养24 h,用无菌生理盐水洗下菌苔,参照麦氏比浊法调整菌悬液浓度为5. 9 × 107CFU/mL。
选取健康斑点叉尾鮰分为实验组和对照组,每组实验用斑点叉尾鮰数量均为10尾,实验组和对照组都设置2个重复。实验时,水体溶氧保持在6.0~7.5 mg/L,鲁氏耶尔森氏菌在20 ℃下能分泌溶血素的能力增强,细菌毒力较大[6],越易导致水生动物致病,故设定感染水温为18~20 ℃,实验过程中保持水质良好,不投喂饵料。在实验组每尾斑点叉尾鮰胸鳍基部注射制备的菌悬液,注射量为0.2 mL/尾,对照组在其胸鳍基部注射同等剂量的无菌生理盐水。每隔3 h观察斑点叉尾鮰的活动情况,以及体表是否出现异常症状,发病死亡病例及时进行记录,并对濒临死亡的斑点叉尾鮰进行解剖,观察器官组织变化情况,同时进行细菌的再分离,实验周期为7 d。
1.2.4 病原菌形态观察及生理生化特征测定
将分离纯化得到病原菌接种于普通营养琼脂平板上,置于28 ℃培养箱中培养24 h,观察菌落大小及形态特征,并挑取形态一致的单个菌落进行革兰氏染色,其他生理生化指标参照参考文献[7]及微量生化反应管说明书进行测定。
1.2.5 病原菌16S rDNA基因部分序列测定及系统发育分析
提取分离纯化得到的菌株总DNA作为模板,利用通用引物27F: 5′-AGAGTTTGATC(C/A)TGGCTCAG-3',反向1492R: 5′-GGTTACCTTGTTACGACTT-3′。PCR反应条件为95 ℃预变性3 min,94 ℃变性35 s,55 ℃退火35 s,72 ℃延伸1 min,此阶段35个循环,72 ℃温育10 min[7]。PCR产物由上海生工生物工程技术服务有限公司测序。测得的序列与NCBI 中的BLAST 进行相似性分析,用Mega5.1软件中Neighbor-Joining法构建系统进化树。
1.2.6 药敏特性分析
分离菌株药物敏感特性测定采用国际通用的纸片扩散法(K-B法),将分离纯化得到的菌株接种于营养肉汤,28 ℃摇床(200 r/min)培养18 h后,稀释菌液浓度至107CFU/mL,取200 μL均匀涂布于MH琼脂平板上,贴上不同的药敏纸片,置于28 ℃生化培养箱中培养24 h后测量其抑菌圈直径(mm),根据杭州微生物试剂有限公司药敏纸片抑菌圈标准,确定致病菌株对药物的敏感程度。
2 结果与分析
2.1 临床症状
2016年1—2月湖南安化网箱养殖斑点叉尾鮰出现大规模暴发性持续性死亡,发病鱼体主要集中在体重为1.5~2.0 kg的斑点叉尾鮰,发病迅速,发病死亡率很高,发病水温在5~15 ℃。经调查,斑点叉尾鮰养殖区域养殖用水未受到大规模污染,养殖水质状况符合渔业用水标准。通过对患病濒死斑点叉尾鮰临床诊断,发现该病的典型症状为发病初期病鱼表现为行动迟缓,体质瘦弱;体表胸鳍及头部有明显的出血症状,解剖发现组织器官有不同病变及充血,尤其是肾及脾严重充血等,腹腔有大量腹水;肠道多黏液,肠壁薄而发红,有出血症状。镜检没有发现寄生虫等感染。
2.2 病原分离纯化
选取具备典型症状濒死斑点叉尾鮰,解剖后对肝、肾和脾进行无菌接种,结果发现:在肝肾脾上均分离到一株优势菌,菌落在普通营养琼脂上形态特征为灰白色、圆形、表面光滑、边缘整齐,直径为0.3~0.8 mm;优势菌株在脑心浸出液琼脂上形成透明白色、圆形、表面光滑、边缘整齐,直径为0.4~0.9 mm的菌落。对该菌株挑取单一菌落于营养琼脂上进一步分离纯化,获得纯培养的菌株,暂命名为AH02。
2.3 回归感染
调节AH02菌液浓度为5.9×107CFU/mL后,人工攻毒感染斑点叉尾鮰,发现感染后斑点叉尾鮰在7 d内全部死亡。发病和死亡鱼体表现出与自然发病相似的症状,如重要组织器官病变及出血,腹腔有大量腹水等,而对照无异常情况。对人工回归感染濒死的病鱼体再次分离菌种,得到与菌株AH02形态特征一致的菌株,再分离菌株经后续鉴定显示与及菌株AH02为同一种。经人工回归感染实验,表明分离菌株AH02对斑点叉尾鮰具有很强的致病性。
2.4 病原菌主要生理生化特征
分离菌株AH02为革兰氏阴性杆菌,具有运动性,吲哚实验为阴性,生理生化特征见表1,菌株AH02生理生化特征与鲁氏耶尔森氏菌Yersiniaruckeri基本一致。
表1 AH02菌株的生理生化特征
Tab. 1 Physiological and biochemical characteristics of strain AH02

测定项目TestitemAH02Y.ruckeri吲哚Indoletest--甲基红Methylred++V-P试验Voges-Proskauertest--硫化氢H2S--明胶液化Gelatinliquefaction+d运动性Motility++尿素Urea--赖氨酸Lysine-(+)精氨酸Arginine--鸟氨酸Ornithine++柠檬酸盐Citrate--七叶苷Esculoside--丙二酸Malonicacid--木糖Xylose--麦芽糖Maltose++阿拉伯糖Arabinose--海藻糖Trehalose++果糖Fructose-+蔗糖Sucrose--棉子糖Raffinose--纤维二糖Cellobiose--鼠李糖Rhamnose--肌醇Inositol--山梨醇Sorbitol+-甘露醇Mannitol++D-阿东醇D-adonitol--蜜二糖Melibiose--水杨苷Salicin--乳糖Lactose--D-葡萄糖产气D-glucoseaerogenesis-(-)D-葡萄糖产酸D-glucoseacidproductionproduction++
注:“+”示阳性;“-”示阴性;“(+)”示阳性反应超过24 h; “(-)”示阴性反应超过24 h; “d”示11%~89%菌株为阳性。
2.5 分离菌株16S rDNA基因部分序列测定及系统发育树的建立
通过提取分离纯化得到的菌株DNA,以其为PCR模板扩增16S rDNA基因。经测序后在NCBI中进行比对分析,分离菌株AH02的16S rDNA基因与鲁氏耶尔森氏菌(Yersiniaruckeri;登录号:FJ908709.1,HQ222844.1,KJ606914.1,LAB681666.1)同源性为99%。选取GenBank中部分鲁氏耶尔森氏菌和常见肠杆菌的16S rDNA基因序列,利用Neighbor-Joining 方法进行系统发育学分析,结果显示分离菌株AH02均与鲁氏耶尔森氏菌聚为一簇(图1)。
2.6 药敏实验
实验测定了分离菌株AH02对14种抗生素的敏感性(表2)。结果显示,菌株AH02对氟苯尼考、新霉素、多西环素、左氧氟沙星、链霉素、妥布霉素、庆大霉素及丁胺卡那霉素高度敏感;对头孢拉定、阿奇霉素中度敏感;对苯唑西林、磺胺异噁唑、克林霉素及利福平不敏感。
3 讨论
鲁氏耶尔森氏菌隶属于肠杆菌科(Enterobacteriaceae)、耶尔森氏菌属(Yersinia),该菌主要引起鲑鳟等冷水性鱼类暴发红嘴病[8-9],随着水产养殖业的发展,鲁氏耶尔森氏菌已经成为中国淡水鱼类突发性出血病主要病原之一,其主要症状表现为鱼体表有出血,重要组织器官严重充血出血具有腹水,从而常导致大量死亡[10]。国内已经报道鲢、鳙[11]、鲟[12-13]等感染鲁氏耶尔森氏菌发病。本研究在湖南安化诊断的斑点叉尾鮰病害与此类似,而通过病原鉴定及人工回归感染也确定了该病的病原菌为鲁氏耶尔森氏菌。本研究开展鲁氏耶尔森氏菌抗生素敏感性研究,结果显示其对氟苯尼考、新霉素、多西环素、左氧氟沙星、链霉素、妥布霉素、庆大霉素及丁胺卡那霉素高度敏感。药敏实验与杨移斌等[13]分离的鲟鲁氏耶尔森氏菌HD0923对多西环素、丁胺卡那霉素、氟苯尼考、链霉素、左氧氟沙星、庆大霉素等药物高度敏感的结果一致,故在斑点叉尾鮰养殖生产上可选择水产常用抗生素如多西环素、氟苯尼考等进行治疗。但一般鱼类病原耐药性存在严重的地区性,建议采用抗生素治疗时先做药敏实验,以达到较好的治疗效果。本研究中鲁氏耶尔森氏菌AH02对一些常用抗生素产生了较强耐药性,这说明在斑点叉尾鮰养殖过程中病害防控措施需进一步改进。虽然目前药物治疗仍然是防治病害的主要手段,但尝试新的措施亦未尝不可,如注射疫苗法或者药物与生态防治结合法等。
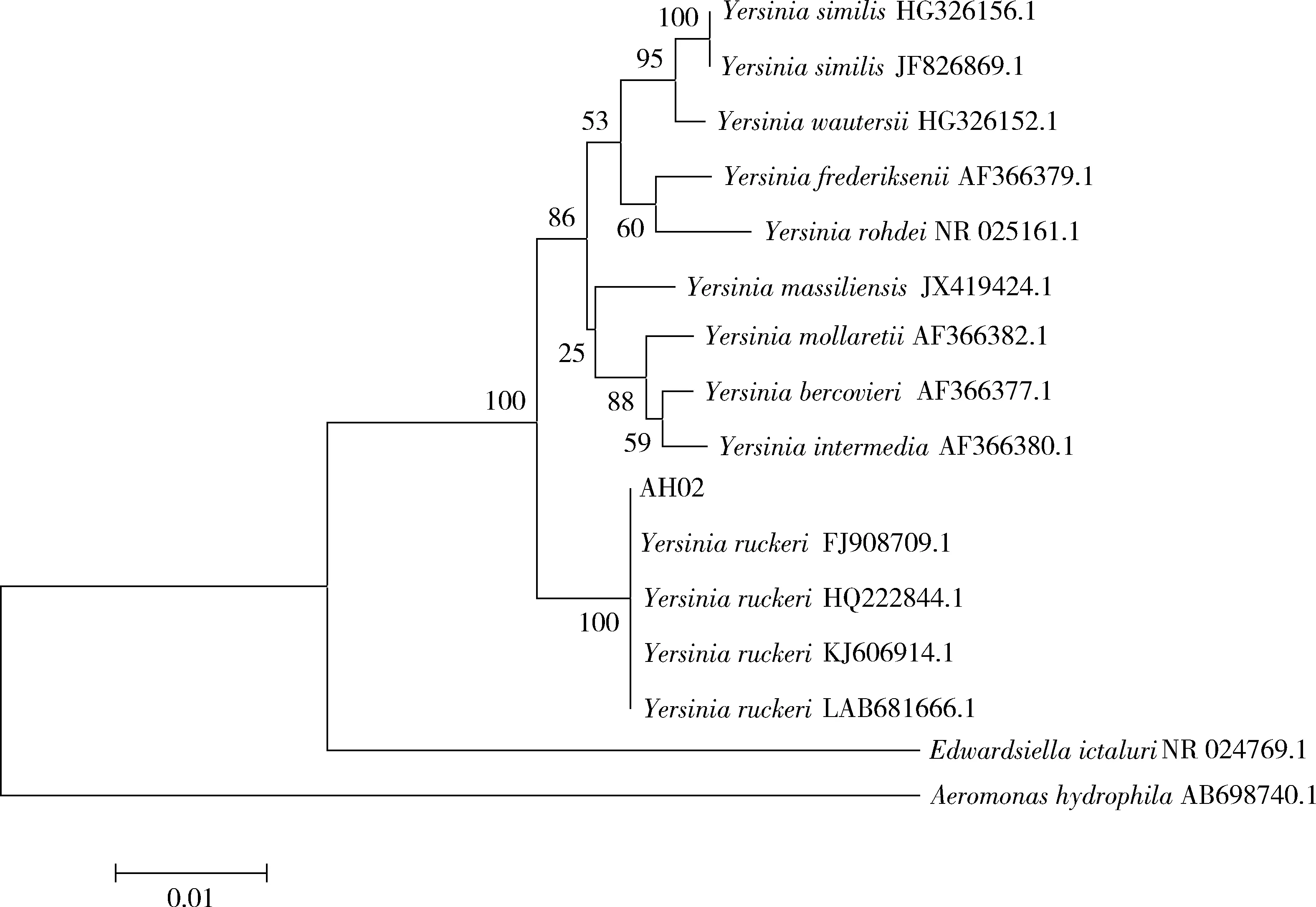
图1 根据菌株AH02 16S rDNA基因序列同源性构建的系统发育树Fig.1 Phylogenetic tree based on 16S rDNA sequence homolog of strain AH02
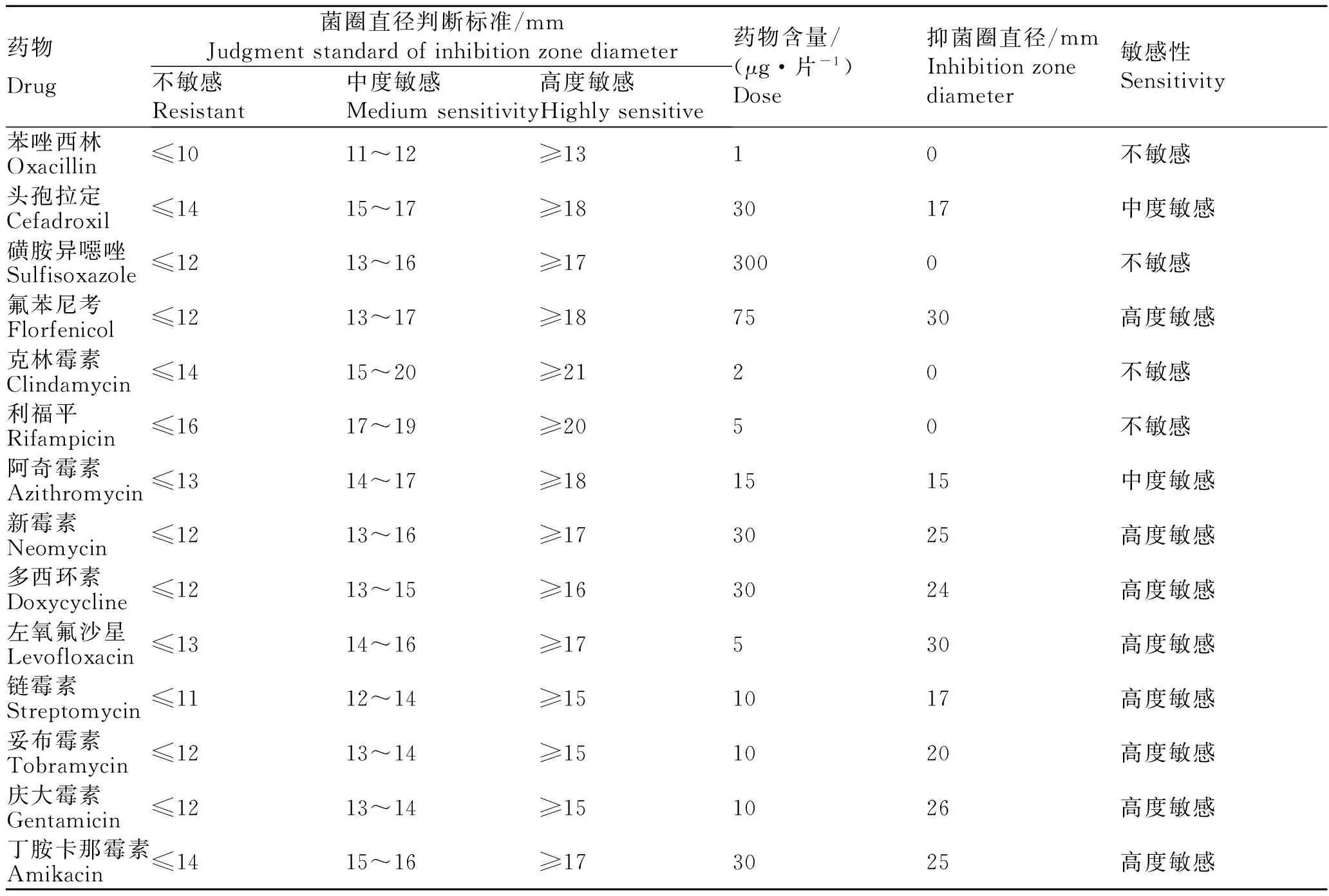
药物Drug菌圈直径判断标准/mmJudgmentstandardofinhibitionzonediameter不敏感Resistant中度敏感Mediumsensitivity高度敏感Highlysensitive药物含量/(μg·片-1)Dose抑菌圈直径/mmInhibitionzonediameter敏感性Sensitivity苯唑西林Oxacillin≤1011~12≥1310不敏感头孢拉定Cefadroxil≤1415~17≥183017中度敏感磺胺异噁唑Sulfisoxazole≤1213~16≥173000不敏感氟苯尼考Florfenicol≤1213~17≥187530高度敏感克林霉素Clindamycin≤1415~20≥2120不敏感利福平Rifampicin≤1617~19≥2050不敏感阿奇霉素Azithromycin≤1314~17≥181515中度敏感新霉素Neomycin≤1213~16≥173025高度敏感多西环素Doxycycline≤1213~15≥163024高度敏感左氧氟沙星Levofloxacin≤1314~16≥17530高度敏感链霉素Streptomycin≤1112~14≥151017高度敏感妥布霉素Tobramycin≤1213~14≥151020高度敏感庆大霉素Gentamicin≤1213~14≥151026高度敏感丁胺卡那霉素Amikacin≤1415~16≥173025高度敏感
本研究中斑点叉尾鮰发病时期处在冬天,水温在5~15 ℃,而此时斑点叉尾鮰已经停食,体质相对较弱,而此时鲁氏耶尔森氏菌却活力较强,并能分泌较多毒素[6],导致病害的大规模暴发。而在整个发病期间由于鮰不吃食,故只能通过外部消毒进行处理,而无法伴饵投喂,导致持续性死亡,引起较大经济损失。这个病例说明,在高密度养殖模式下,病害频发的同时病原特性正在发生变化,一是病原种类的多样化,二是病原的致病条件范围进一步扩大。为确保水产品质量安全,建议严格控制抗生素类药物的使用,加强鱼类病害预防措施的研发,探讨新的科学养殖模式,实现水产健康养殖,保障水产品质量安全。
[1] 刘韬, 王二龙, 汪开毓, 等. 河南中牟地区斑点叉尾鮰突发性败血症病原分离及鉴定[J]. 中国预防兽医学报, 2016, 38(1):53-57.
[2] 刘堂水, 汪成竹, 陈昌福. 斑点叉尾鮰细菌性病原的分离与鉴定[J]. 华中农业大学学报, 2006, 25(5):550-554.
[3] 梁万文, 陈明, 余晓丽, 等. 斑点叉尾鮰肠败血症病原菌的分离与鉴定[J]. 西南农业学报, 2007, 20(5):1124-1129.
[4] 耿毅, 汪开毓, 陈德芳, 等. 斑点叉尾鮰嗜麦芽寡养单胞菌的分离鉴定及系统发育分析[J]. 中国兽医学报, 2007, 27(3):330-335.
[5] 陈德芳. 斑点叉尾鮰海豚链球菌病病原学、病理学和诊断方法研究[D]. 雅安: 四川农业大学, 2011.
[6] 范方玲, 汪开毓, 耿毅, 等. 斑点叉尾(Ictalunespunctatus)源鲁氏耶尔森氏菌的分离鉴定及系统发育分析[J]. 海洋与湖沼, 2010, 41(6): 862-868.
[7] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
[8] Fouz B, Zarza C, Amaro C. First description of non-motileYersiniaruckeriserovar I strains causing disease in rainbowtrout,Oncorhynchusmykiss(Walbaum), cultured in Spain[J]. J Fish Dis, 2006,29: 339-346.
[9] 张晓君. 鲁氏耶尔森氏菌及鱼类相应感染症[J]. 河北科技师范学院学报, 2004, 18(3):77-80.
[10] 滕涛, 梁利国, 谢骏. 大宗淡水鱼细菌性疾病研究进展[J]. 江苏农业科学, 2015(11):8-12.
[11] 徐伯亥, 殷战, 陈燕燊, 等. 鲢、鳙鱼一种新的传染病——Yersiniaruckeri,一种新的鲢、鳙鱼病原菌[J]. 科学通报, 1991(8):620-622.
[12] 李绍戊, 王荻, 冯娟, 等. 养殖鲟鱼出血症病原鲁氏耶尔森菌的分离鉴定和致病性研究[J]. 海洋与湖沼, 2014, 45(3):561-567.
[13] 杨移斌, 夏永涛, 郑卫东, 等. 鲟源鲁氏耶尔森氏菌的分离鉴定及药敏特性研究[J]. 水生生物学报, 2013, 37(2):393-398.
Isolation and identification of pathogenic bacterium from Ictalurus punctatus
YANG Yibin1,2, LIU Tianqiang3,YANG Tao3, XU Ning1,2, DONG Jing1,2, YANG Qiuhong1,2, LIU Yongtao1,2, AI Xiaohui1,2*
(1.Yangtze River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Wuhan 430223, China;2. Hu Bei Freshwater Aquaculture Collaborative Innovation Center, Wuhan 430223, China;3. Animal Health Research Institute,Tongwei Co., LTD, Chengdu 610041, China)
In January—February 2016, a massive death ofIctaluruspunctatusby cage culture outbroke in Anhua region of Hunan province, and it was caused nearly 80% mortality rate, the body weight of onset fish being 1.5 ~ 2.0 kg. A predominant bacterium was isolated from the liver, spleen, and kidney of the infectedIctaluruspunctatusduring the disease outbreak period. The bacterium was identified by common biochemical tests and molecular biology experiments. And artificial infection tests and antibiotic sensitivity tests were also performed. Results showed that the physiological and biochemical characteristics of the bacterium were coincident well withYersiniaruckeri, and its 16S rDNA gene sequences had more than 99% homology toYersiniaruckeri, indicating that it belonged toYersiniaruckerifamily by phylogenetic analysis in NCBI. In addition, the artificially infectedIctaluruspunctatusexhibited similar clinical signs with the naturally infected cases, and the bacterium was able to be re-isolated from theIctaluruspunctatus. It showed thatYersiniaruckeriwas the pathogen for theIctaluruspunctatusdisease. The isolated bacterium was sensitive to florfenicol, doxycycline, neomycin and some other drugs. This study provided theoretical basis for the prevention and control of the explosive hemorrhagic disease ofIctaluruspunctatus. [Chinese Fishery Quality and Standards, 2016, 6(6):53-58]
Ictaluruspunctatus;Yersiniaruckeri; 16S rDNA; disease prevention and control;identification
AI Xiaohui, aixh@yfi.ac.cn
2016-06-24;接收日期:2016-08-24
公益性行业(农业)科研专项(201203085);通威合作项目(TWAH20150615)
杨移斌(1988-),男,实习研究员,研究方向为水生动物病害临床诊断及其防控技术,yangyb1988@126.com 通信作者:艾晓辉,研究员,研究方向为水产品质量安全,aixh@yfi.ac.cn
S94
A
2095-1833(2016)06-0053-06
