黄海海州湾海域腹泻性贝类毒素特征研究
2017-01-03李兆新宋才湖张婷婷董晓郭萌萌孙晓杰宋新成周德山
李兆新,宋才湖,张婷婷,董晓,郭萌萌,孙晓杰,宋新成,周德山
(1.中国水产科学研究院黄海水产研究所,山东 青岛266071;2.上海海洋大学食品学院,上海201306;3.连云港市水产品质量检测中心,江苏 连云港222001)
黄海海州湾海域腹泻性贝类毒素特征研究
李兆新*,宋才湖1,2,张婷婷1,2,董晓1,2,郭萌萌1,孙晓杰1,宋新成3,周德山3
(1.中国水产科学研究院黄海水产研究所,山东 青岛266071;2.上海海洋大学食品学院,上海201306;3.连云港市水产品质量检测中心,江苏 连云港222001)
黄海海州湾海域是中国重要的贝类养殖区之一,为阐明该海区腹泻性贝类毒素的组成成分及含量水平,保障贝类食用安全,应用固相吸附毒素示踪(solid phase adsorption toxin tracking,SPATT)技术,采用液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)检测方法,于2013年7—12月间,分别对黄海海州湾海域的连岛和秦山岛两个海区及海头和九里两个围塘海水中的大田软海绵酸(okadaic acid,OA)、鳍藻毒素-1(dinophysistoxin-1,DTX-1)、鳍藻毒素-2(dinophysistoxin-2,DTX-2)、蛤毒素(pectenotoxin-2,PTX-2)和虾夷扇贝毒素(yessotoxin,YTX)5种腹泻性贝类毒素(diarrhetic shellfish poisoning,DSP)进行定期采集和分析研究。结果显示,连岛和秦山岛海区海水中DSP成分相同,包括OA、DTX-1和PTX-2,未检出DTX-2、YTX。连岛和秦山岛海区海水中腹泻性贝类毒素含量存在空间差异性,连岛海区毒素含量普遍高于秦山岛海区;连岛和秦山岛海区海水中DSP的含量季节性变化趋势相似,OA和PTX-2在7—9月含量较高,DTX-1变化较小。在海头和九里围塘海水中检出OA和PTX-2,但含量极低;未检出DTX-1、DTX-2和YTX。近海养殖围塘受毒素污染较小,可选作经济实用的贝毒净化养殖区。研究填补了该海域贝类养殖区腹泻性贝类毒素组成成分及变化研究空白,为加强贝类毒素污染监管,保障贝类食用安全提供基础数据。 [中国渔业质量与标准,2016,6(6):47-52]
腹泻性贝类毒素;固相吸附毒素示踪;液相色谱-串联质谱;海州湾
海州湾是位于黄海中南部的开放型浅海性海湾,东以岚山头和连云港东西连岛的连线与黄海相通,岛礁周围水深多在20 m以上,面积约820 km2,年平均径流入海量17亿 m3。该海域是中国重要的渔场之一,地理位置优越,盛产多种鱼虾贝等,是国家重点建设的海洋渔港之一。
海州湾海域是赤潮多发区。据2003—2008年的赤潮监测资料显示,该海域存在赤潮生物121种,甲藻18种[1]。其中,2004—2007年发生的赤潮多是由甲藻和硅藻(无毒)引起的[2]。据国家海洋局2013年中国海洋灾害公报,2013年5月30日至6月1日,海州湾海域发生面积为450 km2赤潮过程。主要藻类为赤潮异弯藻(Heterosigmaakashiwo)(鱼毒)。多种甲藻可产生腹泻性贝类毒素(diarrhetic shellfish poisoning,DSP),严重影响海洋环境、海洋生物和人类健康。刘仁沿等[3]发现中国沿海部分贝类样品DSP污染严重。北黄海[4-5]、黄海胶州湾[6]、浙南海域[7]、福建海域[8]、广东近海[9-10]等海域均有DSP检出。而对于黄海海州湾贝类养殖海域,相关贝类毒素的研究报道较少。
固相吸附毒素示踪(solid phase adsorption toxin tracking,SPATT)技术是近年来建立的一种贝类毒素采集监测方法。该技术利用内含吸附剂的被动采样器富集海水中的贝类毒素,结合适当的检测方法,可以对产毒藻类的爆发以及贝类受到毒素污染的状况进行早期预报[12],相比于贝肉检测和藻类监测等传统方法,具有简单方便、准确灵敏、可连续监测的特点。实验室及野外实验证明,非极性芳香族树脂HP-20可用于吸附大田软海绵酸(okadaic acid,OA)、鳍藻毒素(dinophysistoxins,DTXs)、蛤毒素(pectenotoxins,PTXs)、虾夷扇贝毒素(yessotoxins,YTXs)和原多甲藻酸类毒素(azaspiracids,AZAs)等酯溶性贝类毒素[11-16]。其中致腹泻作用的毒素主要有OA、DTX1和DTX2。其他几种毒素PTXs、 YTXs、 AZAs致腹泻性作用较小或不致腹泻。本研究利用SPATT技术,分别先择“开放性海域”和“高位池(围塘)”作为取样地点,在2013年7—12月重点针对该海域海水中OA、DTX1、DTX2,以及部分PTX2 和YTX等5种腹泻性贝类毒素进行了定期监测。通过分析该海域海水中腹泻性贝类毒素的组成成分特征及含量水平,比较同一海域毗邻养殖区及不同环境条件下贝毒的水平差异,阐明该海域海水中腹泻性贝类毒素的变化规律,以期为海州湾DSP研究提供科学依据,为贝毒净化探寻经济实用的暂养环境,有效保障贝类食用安全。
1 材料与方法
1.1 样品采集与处理
连岛和秦山岛是两个海上取样点,直线距离20 km;海头和九里是两个近海围塘模式贝类养殖区。海水围塘养殖模式是一种四面包围、高度封闭的系统,规模约为0.013 3 km2左右,水深约1 m,杂色蛤、毛蚶、梭子蟹、对虾等混养,常为半月换一次海水。取样点位置如图1所示。
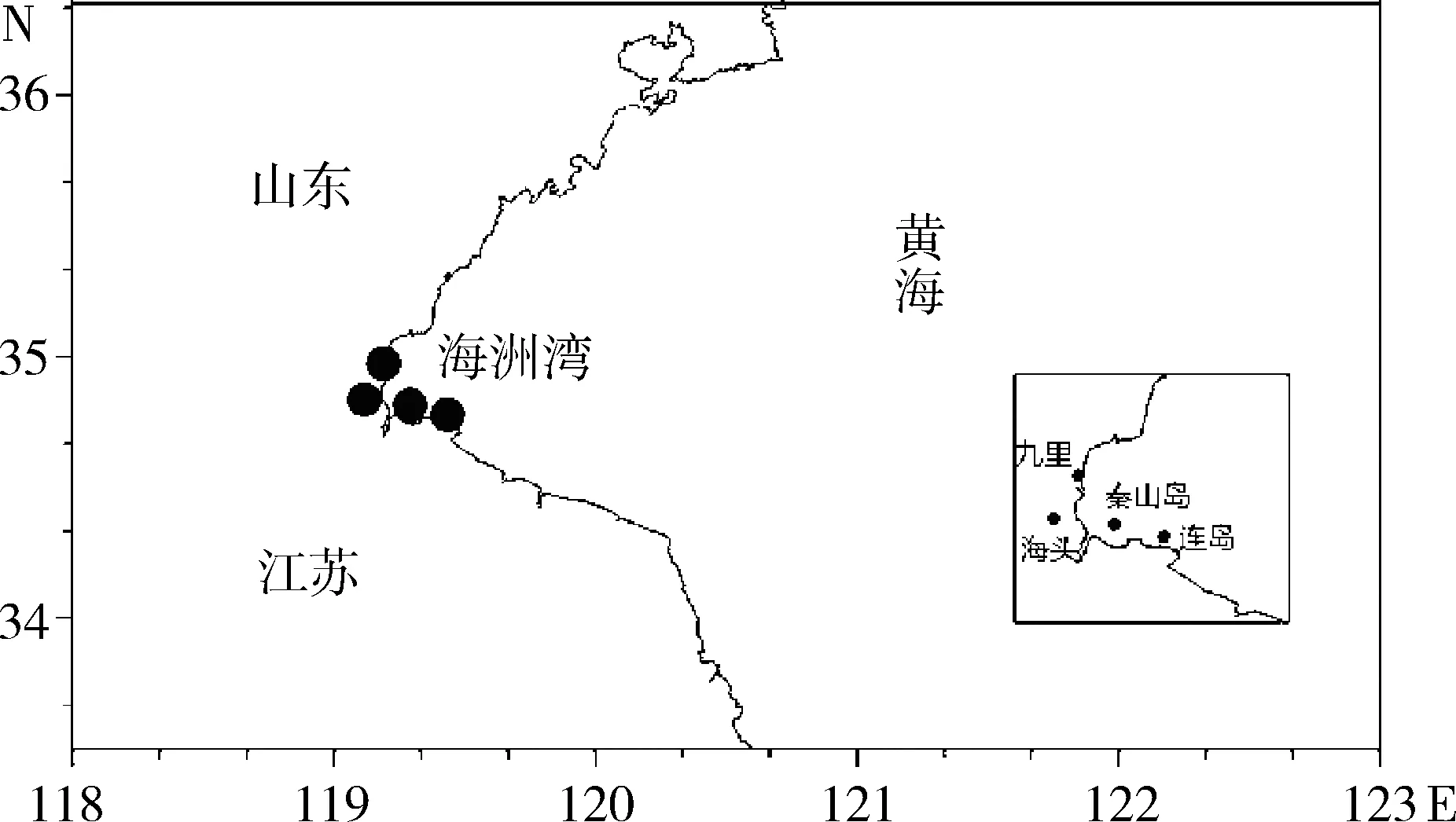
图1 黄海海州湾海域取样点Fig.1 Sampling sites in Haizhou Bay, Yellow Sea
以10.0 g HP-20型树脂装入48 μm孔径的聚酯网布中,缝制成吸附袋,进行毒素吸附。海上取样是将吸附袋系在的吊笼上,沉入水下3 m;围塘取样是在围塘的中心位置固定一杆,将吸附袋系在上面,并加一重物使小袋完全浸入水中,7—9月取样周期为7 d,10—12月周期为21 d。吸附袋带回实验室处理。将吸附袋的树脂转入砂芯滤柱中,用200 mL去离子水冲去盐分,柱中水分正压吹干,缓慢加入20 mL甲醇,使树脂充分浸泡,并静置2 h,滤入鸡心瓶中。再加入20 mL甲醇,重复提取一次。提取液在40 ℃蒸去甲醇,残余0.5 mL左右,加入5 mL二氯甲烷,涡旋萃取1 min,静置10 min后,取出二氯甲烷层。再加入5 mL二氯甲烷重复萃取一次,合并二氯甲烷层,40 ℃氮吹至干。用1 mL 80%甲醇水溶液定容,过0.22 μm有机相滤膜,LC-MS/MS测定。检测结果除以吸附剂量(g)和吸附天数(day),海水中毒素含量以每天(day)每克吸附剂(g resin)中毒素含量(ng)表示,即ng/(g resin·d)。
1.2 仪器、试剂与材料
TSQ Quantum Access液相色谱-串联质谱联用仪(美国Thermo Fisher Scientific公司);旋转蒸发器(瑞士Buchi公司);NVAP112氮吹仪(美国Organomation公司);聚酯网布(孔径48 μm,市购);HP-20树脂(日本三菱公司)。
OA、DTX-1、DTX-2、PTX-2 和YTX标准品(加拿大National Research Council);甲醇、乙腈(色谱纯,Merk公司);二氯甲烷(色谱纯,Cleman公司);甲酸、甲酸铵(色谱纯,Fluka公司);实验用水为Milli-Q超纯水。
1.3 LC-MS/MS分析
采用液相色谱法-串联质谱分析法(LC-MS/MS)同时测定海水中的大田软海绵酸(OA)、鳍藻毒素-1(DTX-1)鳍藻毒素-2(DTX-2)、蛤毒素(PTX-2)和虾夷扇贝毒素(YTX)[17]。
2 结果与讨论
2.1 海州湾贝类养殖海区海水中DSP成分
海州湾海域的连岛和秦山岛海区海水中的腹泻性贝类毒素成分相同(表1),分别是OA、DTX-1和PTX-2;主要成分是OA,分别占毒素总量的47.9%和53.5%;未检出DTX-2和YTX。海州湾海域的海头和九里围塘海水中的成分相同,分别是OA和PTX-2,未检出DTX-1、DTX-2和YTX。李兆新等[18]研究发现黄海胶州湾海域也存在PTX-2,含量最高为26.82 ng/(g resin·d)。
2.2 海州湾贝类养殖海区海水中DSP含量变化
海州湾连岛贝类养殖海区海水中DSP含量变化如图2。在2013年7—12月,OA和PTX-2含量变化波动较大,在7—9月含量较高,最高值分别达到14.86 ng/(g resin·d)和18.13 ng/(g resin·d),DTX-1含量变化波动较小,维持在3 ng/(g resin·d)以下,含量较低;9月份后,PTX-2与DTX-1维持一个较低的水平,而OA含量较高,且波动较大;进入11月,OA含量急剧降至较低水平,三者变化趋势一致。2013年5月30日至6月1日,江苏连云港海州湾海域发生面积为450 km2赤潮过程,主要藻类为赤潮异弯藻(Heterosigmaakashiwo)。赤潮异弯藻可产生血溶性物质,其毒性机制仍不明确,是一种鱼毒性赤潮藻,但不具有致腹泻性效用。因此该赤潮过程不是海区中的腹泻性贝毒产毒藻源,与海区腹泻性毒素水平不具有直接相关性。2013年7—12月没发生大面积赤潮,但仍可能存在低浓度的有毒藻类。据李伟才等[19]、刘吉堂等[20]研究显示,DSP产毒藻属-鳍藻和原甲藻在该海域均有分布。当海水温度在20~30 ℃时,海水中藻类丰度较高,产毒藻孢囊会大量繁殖;海州湾海域海水富营养化严重,海水交换能力差,营养物质不易稀释;适宜的温度和足够的营养,使产毒藻数量增加,DSP含量升高。
表1 海州湾海水中腹泻性贝类毒素含量及百分比
Tab.1 DSP content and percentage of seawater in Haizhou Bay
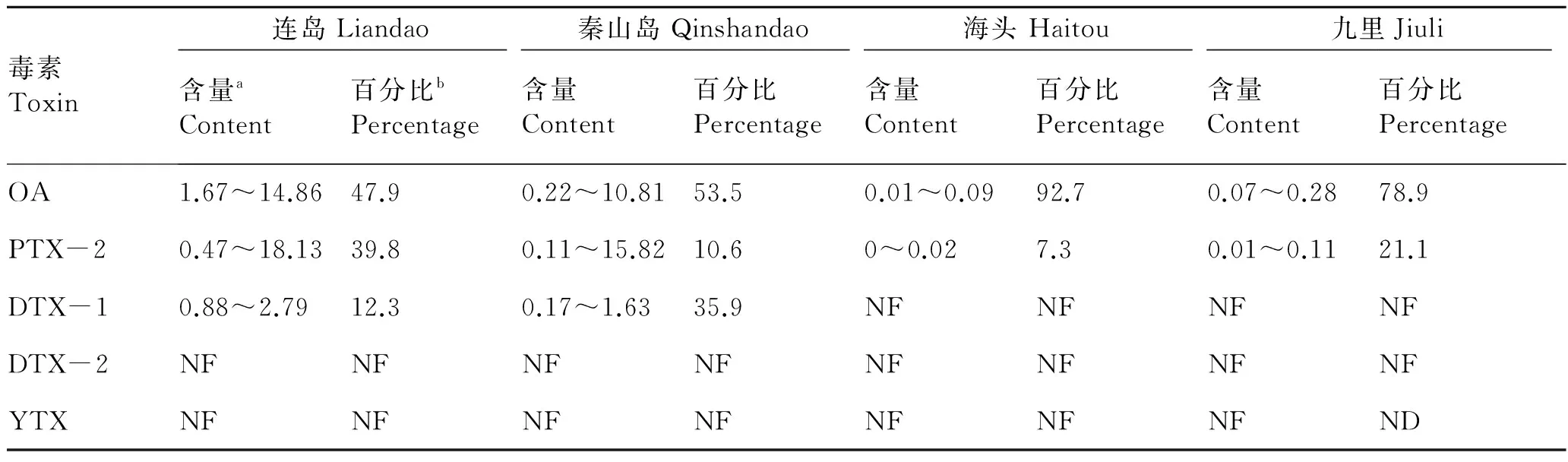
毒素Toxin连岛Liandao秦山岛Qinshandao海头Haitou九里Jiuli含量aContent百分比bPercentage含量Content百分比Percentage含量Content百分比Percentage含量Content百分比PercentageOA1.67~14.8647.90.22~10.8153.50.01~0.0992.70.07~0.2878.9PTX-20.47~18.1339.80.11~15.8210.60~0.027.30.01~0.1121.1DTX-10.88~2.7912.30.17~1.6335.9NFNFNFNFDTX-2NFNFNFNFNFNFNFNFYTXNFNFNFNFNFNFNFND
注:a示毒素浓度范围,单位为ng·g-1resin·d-1;b示某毒素含量占毒素总量的百分比,单位为%;NF表示未检出。
藻类的生长与水温、光照及营养盐等海洋因子相关。在适宜藻类繁殖水温范围内,藻类繁殖主要受光照和营养盐等的影响。在冬季水温较低,水温是藻类繁殖的决定因子。在7—9月水温较高,DSP含量水平较高。10—12月,水温较低,DSP含量水平较低(图2)。下一步需要深入研究毒素水平与海洋环境因子之间的关系。
秦山岛贝类养殖海区海水中DSP含量变化如图3。在2013年7—12月,OA和PTX-2含量变化波动较大,并在7—9月含量较高,最高值分别达到10.81 ng/(g resin·d)和15.82 ng/(g resin·d),DTX-1含量变化波动较小,维持在3 ng/(g resin·d)以下,含量较低。整体上,秦山岛海区毒素季节性变化趋势与连岛海区相似,在7月初—8月中旬期间PTX-2含量高于OA含量,出现了与连岛海区类似的现象。
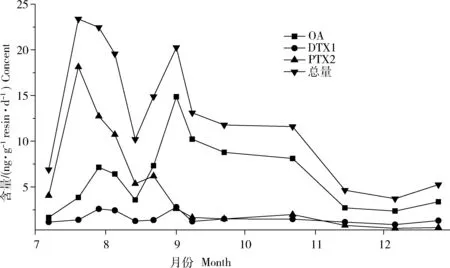
图2 连岛海区海水中DSP含量变化曲线Fig.2 The variation curves of DSP content in Liandao seawater, Haizhou Bay
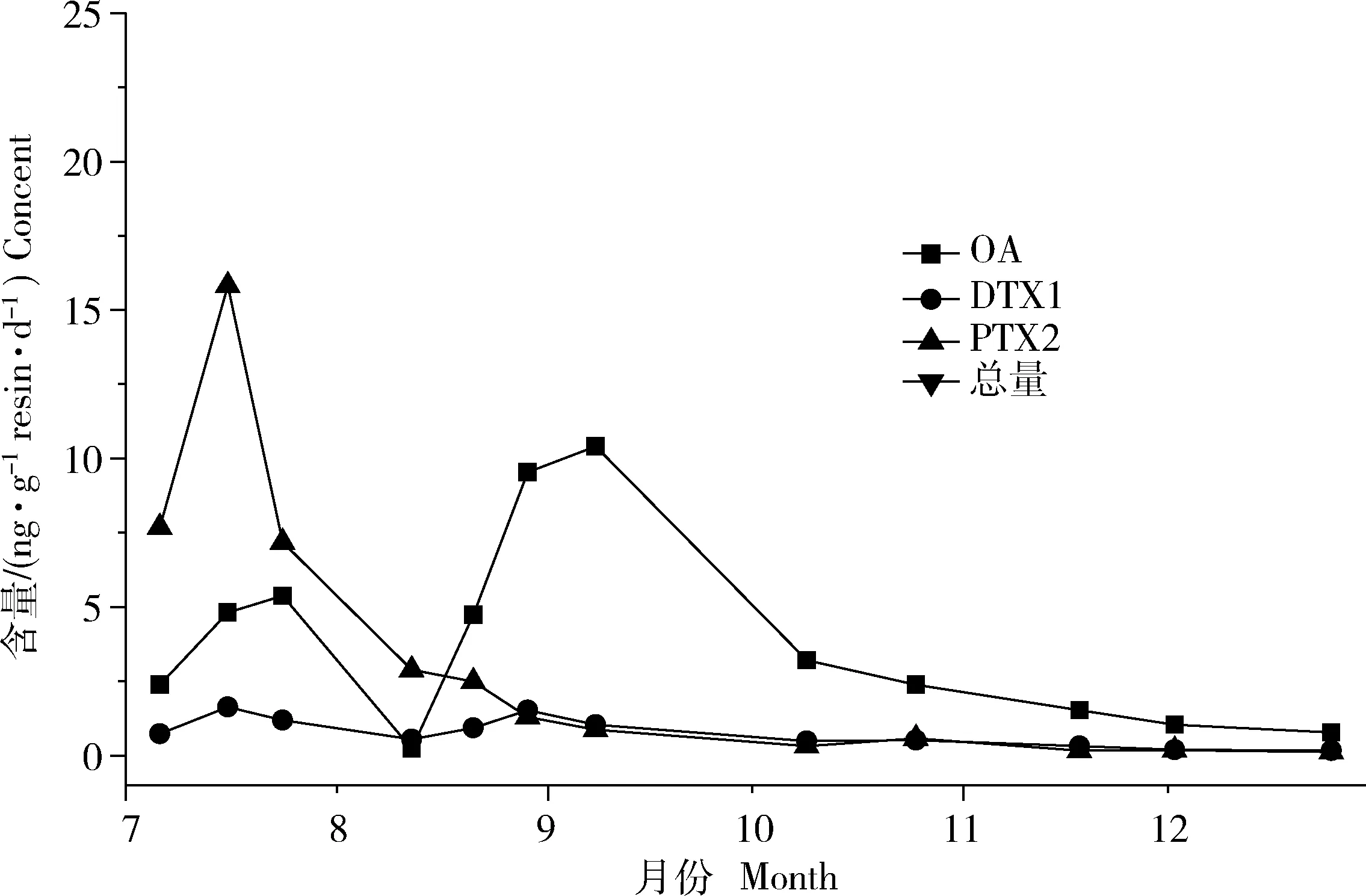
图3 秦山岛海区海水中DSP含量变化曲线Fig.3 The variation curves of DSP content in Qinshandao seawater, Haizhou Bay
2.3 海州湾贝类养殖海区海水中DSP空间差异性
2.3.1 连岛与秦山岛海区毒素差异
海州湾连岛和秦山岛贝类养殖区海水中腹泻性贝毒存在成分相同,包括OA、DTX-1和PTX-2,未检出DTX-2和YTX。OA、PTX-2和DTX-1这3种腹泻性贝类毒素含量季节性变化趋势相似(图2和图3),含量均在7—10月处于较高水平,之后逐步降至较低水平;其中,PTX-2与OA、DTX-1变化情况稍有不同,PTX-2在7月处于较高水平,随后逐步下降,而OA、DTX-1在8—10月处于较高水平。连岛与秦山岛同处海州湾海域(图1)两地相隔20 km,腹泻性贝类毒素含量季节性变化几乎同步。但两地的毒素含量水平存在差异:连岛海区海水中的腹泻性贝类毒素含量普遍比秦山岛海区高。与位于海面上的秦山岛相比(图1),连岛背靠大陆,海水污染严重,富营养化程度较高,交换能力较弱,这可能是连岛海域腹泻性贝类毒素含量比秦山岛海域高的原因。江天久等[21]、李嘉雯等[22]研究也表明,在地理间隔较近的不同采样点,贝类毒素含量存在差异。
2.3.2 贝类养殖海区与围塘养殖区毒素的差异
海州湾连岛和秦山岛贝类养殖海区均存在OA、DTX-1和PTX-2,而海头和九里围塘养殖区仅检出OA和PTX-2两种DSP成分,未检出DTX-1,且含量极低(表1)。
贝类通过摄食海水中的有毒藻而积累毒素。当开放海区受到污染时,围塘(高位池)中贝类毒素仍很少。这可能是由于当外海海水中有毒藻数量较多时,围塘水较少或不纳水,有毒藻种群密度较低,使得围塘中毒素含量水平较低。通常一旦发现贝类染毒,可把贝类置于无有害浮游生物的海水中暂养、净化一段时间后,使贝体内毒素自行代谢。现有贝类净化技术主要是针对微生物净化,还没有针对贝毒净化的工程技术。主要原因是进行大批量、较长时间的净化需要较大的场所,利用贝类净化工厂成本太高,代价太大。因此,已有围塘可能是进行贝类毒素净化的较经济实用的养殖环境。
3 结论
应用SPATT技术,分析了2013年7—12月黄海海州湾连岛和秦山岛贝类养殖海区海水中腹泻性贝类毒素成分特征及变化规律。该海域海水中毒素成分包括OA、DTX-1和PTX-2,OA整体含量最高,未检出DTX-2和YTX;OA和PTX-2在7—9月含量较高,DTX-1变化较小。连岛和秦山岛两海区海水中腹泻性贝类毒素含量存在空间差异性,连岛海区毒素含量普遍高于秦山岛海区。但两海区海水中腹泻性贝类毒素的含量季节性变化趋势相似。应用SPATT技术,分析了该海域围塘海水中腹泻性贝类毒素组成成分及含量水平。与该海域围塘外的海水相比,围塘内海水中未检出DTX-1、DTX-2和YTX,且OA和PTX-2含量极低。利用已有围塘进行贝类毒素净化是可选的养殖环境。
[1] 矫新明, 徐虹, 花卫华, 等. 海州湾海域的赤潮生物[J]. 水产养殖, 2010 (5): 25-29.
[2] 彭模, 梁晓红, 赵爱博. 连云港海州湾海域赤潮发生与水文气象环境因子特征分析[J]. 海洋开发与管理, 2010, 27(9): 48-53.
[3] 刘仁沿, 梁玉波, 张芳, 等. 中国沿海贝类腹泻性贝毒的酶联免疫分析方法[J]. 大连海事大学学报(自然科学版), 2008, 34(2): 33-36.
[4] 高春蕾, 刘仁沿, 梁玉波, 等. 虾夷扇贝毒素yessotoxins(YTXs), 中国沿海贝类中首次发现的一组贝类生物毒素[J]. 海洋学报, 2010 (3): 129-137.
[5] 陈建华, 于仁成, 孔凡洲, 等. 北黄海海域虾夷扇贝体内脂溶性藻毒素分析[J]. 海洋与湖沼, 2014, 45(4): 855-863.
[6] 杨守国. 黄海胶州湾海区腹泻性贝毒素的特征和时间变化规律研究[D]. 上海:上海海洋大学, 2010.
[7] 张树刚, 邹清, 陈雷, 等. 浙南海域腹泻性贝毒分析[J]. 海洋科学, 2011, 35(1): 44-47.
[8] 戴红, 李奶姜, 陈国斌. 福建三都湾赤潮监控区的麻痹性贝毒和腹泻性贝毒研究[J]. 海洋环境科学, 2005, 24(1): 44-47.
[9] 吴施卫, 曾淼, 卢大鹏, 等. 广东近岸海域 2005 年春季的腹泻性贝毒素特征分析[J]. 海洋环境科学, 2008, 27(2):165-168,181.
[10] 黄翔, 雷芳, 江天久. 我国东海和南海近岸海域腹泻性贝类毒素污染状况[J]. 暨南大学学报 (自然科学与医学版), 2013, 34(1): 101-105.
[11] MacKenzie L, Beuzenberg V, Holland P, et al. Solid phase adsorption toxin tracking (SPATT): a new monitoring tool that simulates the biotoxin contamination of filter feeding bivalves[J]. Toxicon, 2004, 44(8): 901-918.
[12] Fux E, Marcaillou C, Mondeguer F, et al. Field and mesocosm trials on passive sampling for the study of adsorption and desorption behaviour of lipophilic toxins with a focus on OA and DTX1[J]. Harmful Algae, 2008, 7(5): 574-583.
[13] Fux E, Bire R, Hess P. Comparative accumulation and composition of lipophilic marine biotoxins in passive samplers and in mussels (M.edulis) on the West Coast of Ireland[J]. Harmful Algae, 2009, 8(3): 523-537.
[14] Turrell E, Stobo L, Lacaze J P, et al. Development of an early warning system for harmful algal blooms using solid-phase adsorption toxin tracking (SPATT)[C]//OCEANS 2007-Europe. Aberdeen:IEEE, 2007: 1-6.
[15] Li A, Ma F, Song X, et al. Dynamic adsorption of diarrhetic shellfish poisoning (DSP) toxins in passive sampling relates to pore size distribution of aromatic adsorbent[J]. J Chromatogr A, 2011, 1218(11): 1437-1442.
[16] Rundberget T, Gustad E, Samdal I A, et al. A convenient and cost-effective method for monitoring marine algal toxins with passive samplers[J]. Toxicon, 2009, 53(5): 543-550.
[17] 郭萌萌, 谭志军, 吴海燕, 等. 液相色谱-串联质谱法同时测定贝类中大田软海绵酸, 鳍藻毒素, 蛤毒素和虾夷扇贝毒素[J]. 色谱, 2012, 30(3): 256-261.
[18] 李兆新, 郭萌萌, 杨守国, 等. 黄海胶州湾海水中蛤毒素特征及变化规律[J]. 渔业科学进展, 2011, 6: 012.
[19] 李伟才, 栾刚, 李立, 等. 中国沿海部分海区贝毒毒素的调查[J]. 海洋科学, 2000, 24(9): 19-22.
[20] 刘吉堂, 沙鸥, 徐国想, 等. 连云港海州湾海域赤潮生物的种类调查及形成原因[J]. 环境科学与管理, 2007, 32(7): 33-34.
[21] 江天久, 尹伊伟. 大亚湾和大鹏湾麻痹性贝类毒素动态分析[J]. 海洋环境科学, 2000, 19(2): 1-5.
[22] 李嘉雯, 江涛, 吴锋, 等. 珠江口与大亚湾海域腹泻性贝毒污染状况分析[J]. 暨南大学学报 (自然科学与医学版), 2014, 35(3): 228-234.
Research on characteristics and variations of diarrhetic shellfish poisoning inHaizhou Bay, Yellow Sea
LI Zhaoxin1*,SONG Caihu1,2, ZHANG Tingting1,2, DONG Xiao1,2, GUO Mengmeng1, SUN Xiaojie1,SONG Xincheng3, ZHOU Deshan3
(1.Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;2.College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China;3.Lianyungang Center for Quality Testing of Aquatic Products, Lianyungang 222001, China)
Waters in Haizhou Bay of the Yellow Sea is one of China's important shellfish aquaculture area. In order to protect shellfish food safety, the aim of this study is to clarify diarrhetic shellfish poison in composition and concentration levels in this the area. In this study, the monitoring of diarrhetic shellfish poisoning (DSP) in seawater was carried out at regular intervals in shellfish culture sites in Haizhou Bay, Yellow Sea from July 2013 to December 2013. We investigated the characteristics and variation of Okadaic acid (OA), dinophysistoxin-1 (DTX-1), dinophysistoxin-2 (DTX-2), pectenotoxin-2 (PTX-2) and yessotoxin (YTX) in Liandao and Qinshandao sea areas, Haitou and Jiuli aquaculture ponds. The five kinds of above-mentioned toxins were adsorbed using solid phase adsorption toxin tracking (SPATT) and then determined with liquid chromatography-tandem mass spectrometry (LC-MS/MS). The results showed that the detected toxins in Liandao and Qinshandao sea areas were the same, including OA, DTX-1 and PTX-2 but excluding DTX-2 and YTX. Extremely low amount of detected toxins including OA and PTX-2 were found in Haitou and Jiuli aquaculture ponds, but excluding DTX-1, DTX-2 and YTX. The content of OA, DTX-1 and PTX-2 had regional difference in Liandao and Qinshandao sea areas: the content was higher in Liandao sea area than that in Qinshandao sea area. The content of OA and PTX-2 had seasonal difference and showed parallel variation in Liandao and Qinshandao sea areas: the content was highest from July to September. On the other hand the low content of DTX-1 had the smooth variation. Offshore aquaculture ponds had less contaminated by diarrhetic shellfish poison and it could be selected as an economical and practical shellfish purification culture zone. The results filled in the blank of the composition of diarrhetic shellfish poison and their variation in this area. This study can give strong support to the supervision and management for shellfish poisoning pollution in this aquaculture area. [Chinese Fishery Quality and Standards, 2016, 6(6):47-52]
diarrhetic shellfish poisoning;solid phase adsorption toxin tracking; LC-MS/MS;Haizhou bay
LI Zhaoxin, lizx@ysfri.ac.cn
2016-06-13;接收日期:2016-08-12
农业部引进国际先进农业科学技术计划(948-2013-S8)
李兆新,研究员,研究方向为水产品质量安全与生物毒素,lizx@ysfri.ac.cn
S94
A
2095-1833(2016)06-0047-06
