基于分子对接技术研究漆酶与介质间的结合模式与相互作用机制
2017-01-03陶国翔李爱秀封加栋
陶国翔,李爱秀,封加栋,张 敏,战 丽
(1.武警后勤学院基础部药物设计实验室,天津 300309;2.武警后勤学院科研部,天津 300309;3.武警后勤学院训练部,天津 300309)
基于分子对接技术研究漆酶与介质间的结合模式与相互作用机制
陶国翔1,李爱秀1,封加栋1,张 敏2,战 丽3
(1.武警后勤学院基础部药物设计实验室,天津 300309;2.武警后勤学院科研部,天津 300309;3.武警后勤学院训练部,天津 300309)
为深入研究漆酶-介质体系中漆酶与介质间的相互作用,基于分子对接技术计算模拟了变色栓菌漆酶与5种典型介质之间的结合模式,并在分子水平阐明了漆酶与介质的相互作用机制。结果表明,漆酶活性位点的Leu164、Asn264、Phe265、Gly392、Ala393、Ile455等氨基酸残基与介质发生疏水作用,Asp206与介质中的羟基发生氢键作用;漆酶与介质作用时His458远离了T1Cu,对漆酶氧化电势的提高具有较大贡献。为漆酶与介质结构的进一步改造以及从天然资源中挖掘新介质提供了理论指导。
漆酶;介质;漆酶-介质体系;分子对接;结合模式;相互作用机制
漆酶(laccase,EC1.10.3.2)是一种多铜氧化酶,根据其来源不同可分为昆虫漆酶、植物漆酶、细菌漆酶和真菌漆酶[1]。真菌是漆酶最重要的来源,来源于变色栓菌(Trametesversicolor)的真菌漆酶具有易得、产量高的优势,因此变色栓菌一直被作为生产漆酶的真菌[2]。漆酶的特征底物为酚类和芳胺类,通过铜离子与底物之间的电子传递实现对底物的催化氧化作用,其催化氧化机制如图1所示。
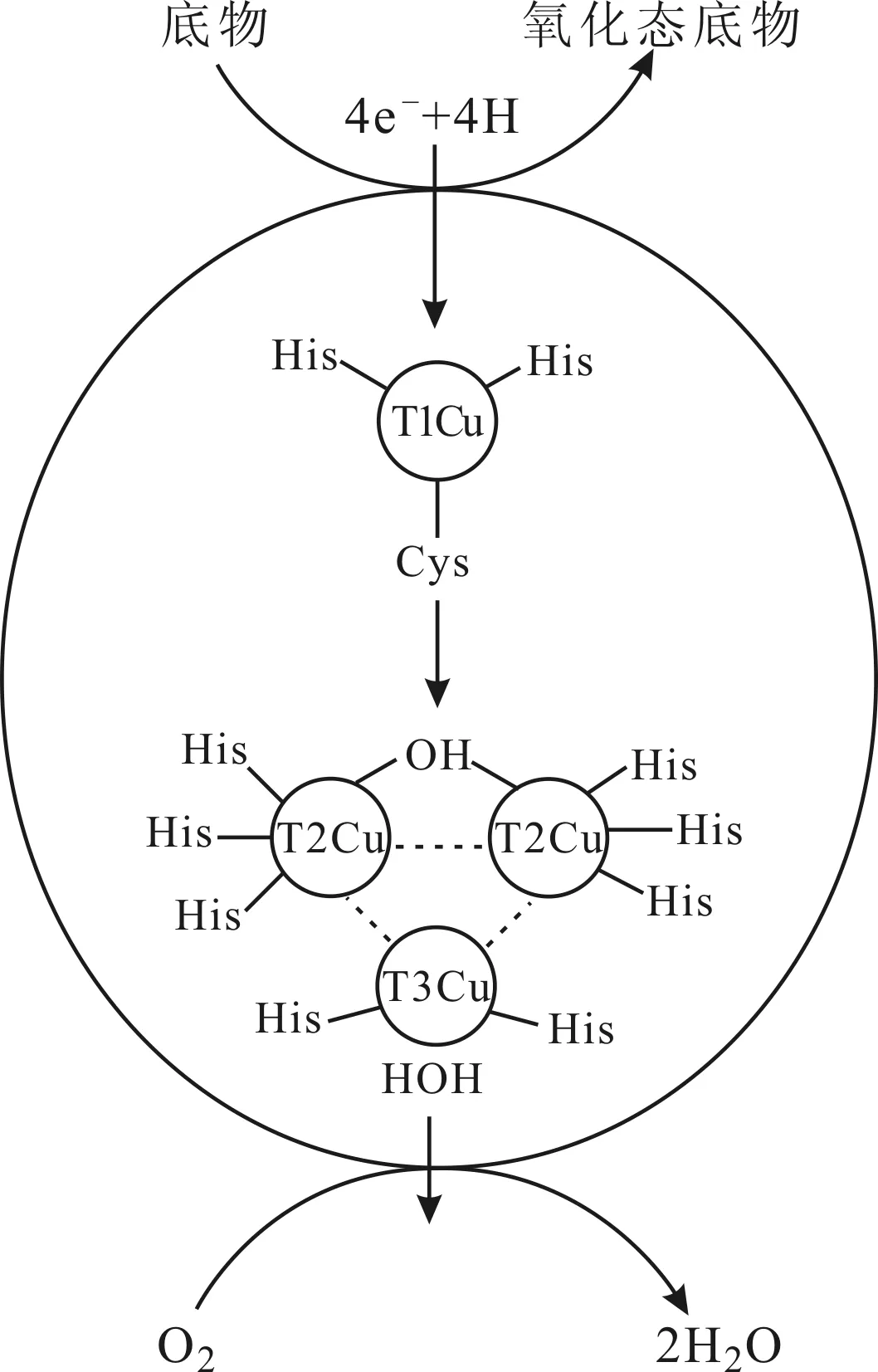
图1 漆酶活性位点的催化氧化机制
由于漆酶在催化氧化过程中副产物只有水,所以具有极高的环保价值,被称为“绿色催化剂”[3]。研究发现,在催化体系中加入一种小分子介质(mediator),与漆酶共同构成漆酶-介质体系(laccase-mediator system,LMS),漆酶的催化氧化能力会显著提升[4]。在LMS中,介质主要通过间接提高漆酶的氧化电势和减少漆酶与底物之间的空间阻碍等方式提高电子传递效率[5]。一是介质首先被漆酶氧化生成具有较高氧化电势的介质中间体,介质中间体再与底物反应,这样就间接提高了漆酶的氧化电势;二是底物不必直接结合到漆酶的活性位点,而让介质充当漆酶与底物之间的“电子梭”,克服了某些底物与漆酶活性位点空间匹配性不佳的问题。LMS的建立提高了催化效率、扩大了底物范围、拓宽了应用领域。例如:LMS用于催化氧化木质素降解,为实现木质素的高值化利用迈出了重要一步[6];LMS可有效催化降解工业废水中的多环芳烃、酚类等有毒物质,降低工业废水的化学耗氧量、生物耗氧量和色度等[7];LMS还可降解土壤中的残留农药[8](如毒死蜱、滴滴涕等)和抗生素[9](如磺胺地托辛)等。由此可见,LMS的应用有利于循环经济的开展和绿色化学的推广,具有极高的社会和环保意义。但是由于目前常用的介质成本较高、稳定性较差以及具有一定毒性和刺激性等因素[10],影响了LMS的进一步应用。作者基于分子对接技术,从已知变色栓菌漆酶复合物的晶体结构出发,从分子水平揭示漆酶与常见介质之间的结合模式和可能的相互作用机制,拟为新介质的发现和现有介质的合理改造奠定理论基础。
1 实验
1.1 技术平台
所有计算均利用分子模拟与分子设计软件包MOE 2009在计算机上完成。
1.2 漆酶和介质结构
实验用漆酶是变色栓菌漆酶与2,5-二甲基苯胺的复合物,蛋白数据库(PDB)编号为1KYA。文献报道1KYA中漆酶活性位点由Phe162、Leu164、Asp206、Asn264、Phe265、Phe332、Phe337、Pro391、Gly392、Ala393、Ile455和His458等氨基酸组成[11]。
介质为文献报道的3个天然介质和2个人工合成介质[5,12-13],天然介质为丁香酸甲酯、乙酰丁香酮、乙酰香草酮,人工合成介质为N-羟基苯并三唑(HBT)和N-羟基乙酰苯胺(NHA),其化学结构式如图2所示。
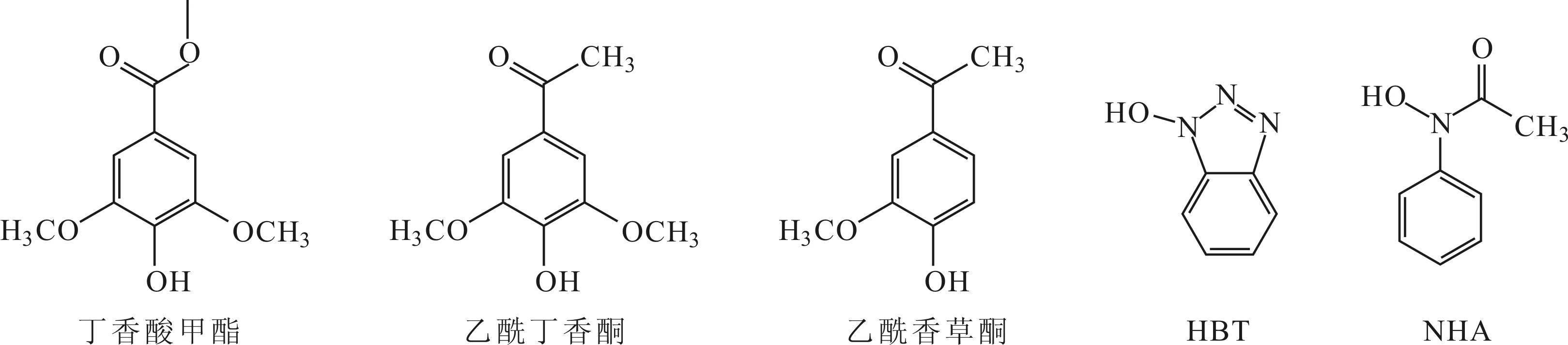
图2 介质的化学结构式
1.3 分子对接
分子对接是将小分子介质放置于漆酶活性位点处,并寻找合适的取向和构象,使介质与漆酶的形状和相互作用匹配最佳。
1.3.1 分子对接模型的建立
为保证分子对接的可靠性,首先建立了分子对接模型。将1KYA中的配体(2,5-二甲基苯胺)抽提出来作为初始构象,尝试不同的对接参数,再将2,5-二甲基苯胺对接回漆酶活性位点,根据对接前后2,5-二甲基苯胺在活性位点中的位置及其与氨基酸残基的相互作用关系,判断参数设置的合理性以及MOE 2009软件包研究漆酶与介质相互作用的适用性。
将1KYA导入MOE 2009,删除其杂原子、溶剂分子、2,5-二甲基苯胺等,保留漆酶A链,在Amber99力场下,利用Protonate 3D模块,在pH=5.0、温度300 K条件下对漆酶加氢加电荷。之后设置力场为MMFF94x,利用MOE-Dock模块将介质与漆酶活性位点对接,参数设置如下:Placement:Triangle Mather;Rescoring1:London dG;Refinement:Forcefield。对接完成后,选取合适的介质和以漆酶活性位点为中心、半径5 Å范围内的氨基酸残基,其余部分固定,在MMFF94x力场下进行能量优化[14]。
1.3.2 介质与漆酶的对接
介质结构首先由MOE 2009软件包中Builder模块绘制,然后以1KYA中配体2,5-二甲基苯胺的构象为模板,利用Flexible alignment模块分别将5种介质与之叠合,选择最佳的叠合构象作为介质对接的初始构象。采用已建立的分子对接模型将介质对接到漆酶活性位点。根据对接结果的评分大小、氢键作用和关键氨基酸残基的疏水作用等确定最佳对接结果。
2 结果与讨论
2.1 分子对接模型的建立与评价
2.1.1 1KYA中漆酶活性位点与2,5-二甲基苯胺的结合模式(图3)
漆酶表面的Ⅰ型Cu(T1Cu)是电子的初级接受位点,在T1Cu中心形成一个由若干氨基酸残基构成的活性位点。由图3可知,在1KYA中2,5-二甲基苯胺占据了漆酶的活性空腔,2,5-二甲基苯胺的氨基与His458形成氢键,His458作为电子入口与T1Cu配位,把接受的电子传递给T1Cu。漆酶活性位点的Phe162、Leu164、Phe265、Pro391、Gly392与2,5-二甲基苯胺发生疏水作用[11]。
2.1.2 分子对接后1KYA中漆酶活性位点与2,5-二甲基苯胺的结合模式(图4)
将1KYA中2,5-二甲基苯胺取出后,再对接回漆酶活性位点处,2,5-二甲基苯胺上的氨基与His458之间存在氢键作用,2,5-二甲基苯胺与Phe162、Leu164、Phe265、Pro391、Gly392存在疏水作用。对接结果从2,5-二甲基苯胺的结合位置氢键作用以及与关键氨基酸残基的疏水作用等方面较好地重现了复合物中漆酶活性位点与2,5-二甲基苯胺的结合特点,表明利用以上参数在MOE-Dock模块下建立的分子对接模型是可靠的。
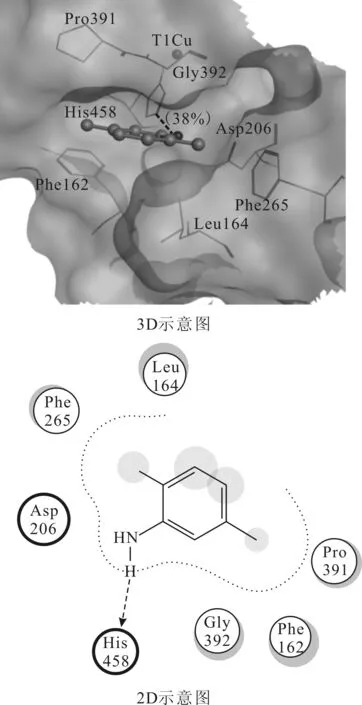
图3 1KYA中漆酶活性位点与2,5-二甲基苯胺的结合模式
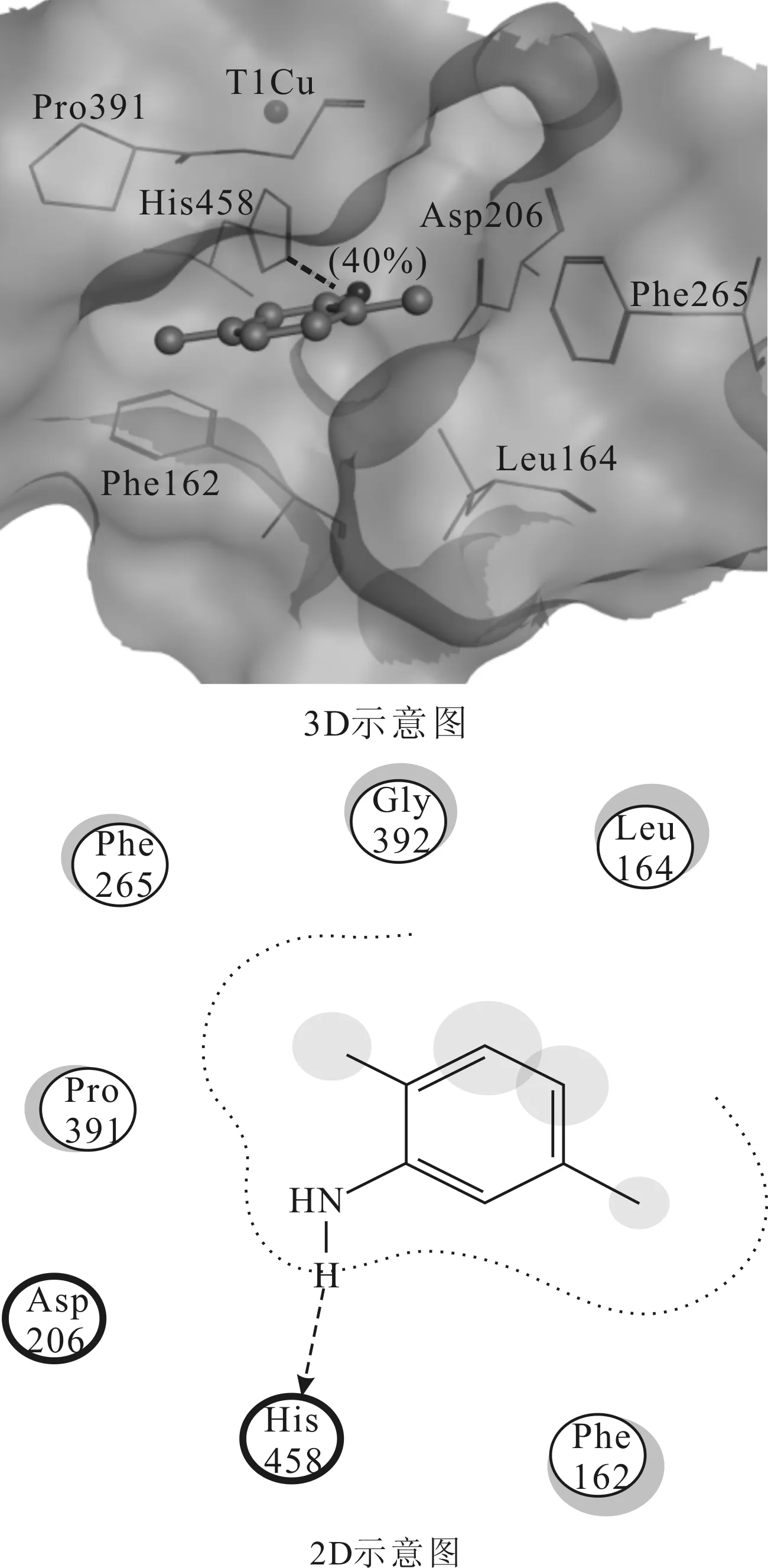
图4 分子对接后1KYA中漆酶活性位点与2,5-二甲基苯胺的结合模式
Fig.4 Binding mode of laccase active site and 2,5-dimethylaniline in 1KYA after molecular docking
2.2 介质与漆酶对接结果
2.2.1 漆酶活性位点与介质的结合模式
采用建立的分子对接模型,将介质与漆酶活性位点对接,得到漆酶活性位点与介质的结合模式,如图5所示。

丁香酸甲酯 乙酰丁香酮 乙酰香草酮 HBT
NHA
图5 漆酶活性位点与介质的结合模式
Fig.5 Binding mode of laccase active site and mediators
由图5可知,4个loop环勾勒出活性位点的轮廓,5种介质均能较好地结合在漆酶活性位点,被疏水氨基酸残基包围,介质的羟基深入到了活性位点内部的极性区。
2.2.2 漆酶活性位点氨基酸残基与介质相互作用的2D示意图(图6)
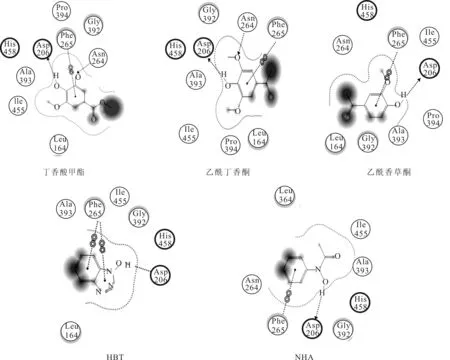
图6 漆酶活性位点氨基酸残基与介质相互作用的2D示意图
由图6可知,与介质发生相互作用的氨基酸包括1个酸性氨基酸Asp206、1个碱性氨基酸His458和若干中性氨基酸Leu164、Asn264、Phe265、Gly392、Ala393、Ile455。与介质发生疏水作用的氨基酸分别位于3个loop环上,分别为Leu164,Asn264、Phe265和Gly392、Ala393,其中Leu164和Gly392、Ala393分别位于活性位点两侧,构成进入活性位点的入口。酸性氨基酸Asp206与介质中的羟基发生氢键作用,Phe265的苯环与介质中的苯环平行,发生π-π相互作用,Asn264与丁香酸甲酯和乙酰丁香酮的甲氧基的氧原子发生氢键作用。
2.2.3 Asp206与羟基及His458与T1Cu的距离(表1)
表1 Asp206与羟基及His458与T1Cu的距离/Å
Tab.1 Distance of Asp206-hydroxyl and His458-T1Cu/Å
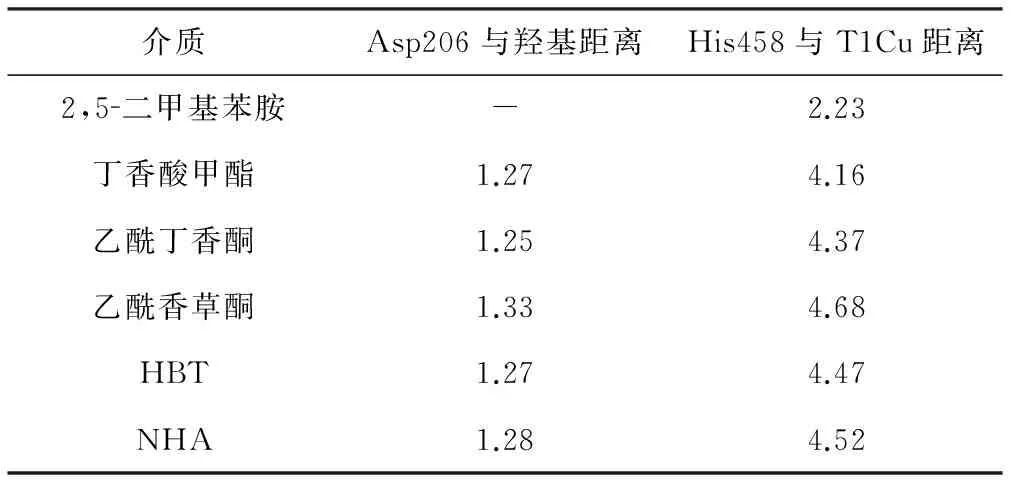
介质Asp206与羟基距离His458与T1Cu距离2,5二甲基苯胺-2.23丁香酸甲酯1.274.16乙酰丁香酮1.254.37乙酰香草酮1.334.68HBT1.274.47NHA1.284.52
注:1KYA晶体结构中2,5-二甲基苯胺的氨基与Asp206之间的距离为3.20 Å。
介质的羟基与1KYA中2,5-二甲基苯胺的氨基均可传递质子给Asp206。由表1可知,对接结果经能量优化后,介质中的羟基与Asp206的距离较1KYA中2,5-二甲基苯胺的氨基与Asp206的距离有显著差异;此外,介质与漆酶活性位点对接结果中His458均远离了T1Cu。
2.2.4 LMS质子转移机制
以上结果与文献报道的LMS中介质的质子转移机制相符,即漆酶首先与介质反应,介质失去氢形成含氮氧自由基或苯氧自由基的活性中间体(图7),活性中间体从活性位点脱离再与底物反应,夺取底物的氢,从而引发一系列非酶促反应导致底物的降解[15-16]。
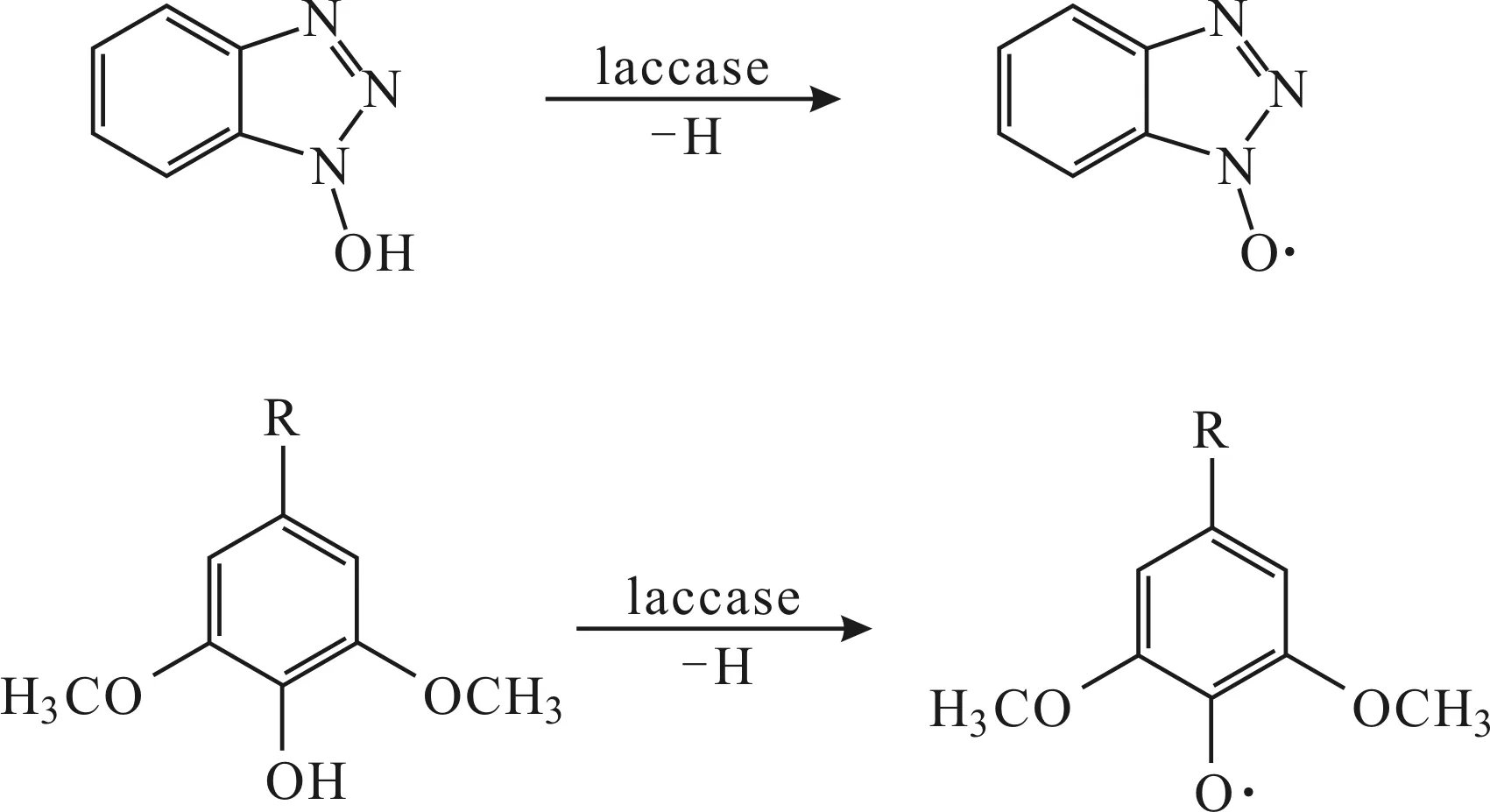
图7 LMS质子转移机制
据文献报道,活性位点中的酸性氨基酸Asp206在真菌漆酶中高度保守,与漆酶底物的pH值依赖性有关,当pH值为弱酸性时,Asp206的羧基发生解离,活性位点带上负电荷,有利于与含羟基或氨基取代基的底物结合[11]。Asp206作为质子受体可接受来自介质的质子,介质羟基与Asp206之间的氢键作用有利于质子的传递。在1KYA中2,5-二甲基苯胺的氨基与Asp206之间距离为3.20 Å,在介质与漆酶的对接结果中,氢键距离为1.25~1.33 Å,氢键距离的缩短有利于质子传递。
介质在传递质子的同时发生电子转移,碱性氨基酸His458具有接受电子的能力,与Asp206通过质子与电子的接受保持体系pH值平衡。His458作为电子受体,将接受的电子再传递给T1Cu。His458与T1Cu的距离会对漆酶的氧化电势产生影响,在对接结果中发现,漆酶活性位点与介质作用时,活性位点的氨基酸构象会发生改变,His458均不同程度远离了T1Cu。当His458远离T1Cu时,His458对T1Cu的电子贡献降低,T1Cu表现出更多“缺电子特性”,导致氧化电势升高。Leu164、Gly392、Ala393、Ile455与介质间的疏水作用使介质较好地结合在漆酶活性位点,Phe265与介质苯环之间的π-π相互作用、Asn264与甲氧基的氢键作用有利于介质构象的稳定。
3 结论
基于分子对接技术研究了漆酶活性位点与5种常见介质的结合模式,漆酶活性位点氨基酸与介质相互作用的关键在于酸性氨基酸Asp206与介质发生氢键作用,对介质中间体的生成有重要作用。酸性氨基酸Asp206可作为质子受体,介质将质子传递给Asp206形成介质中间体;His458作为电子受体,与Asp206共同维持体系pH值平衡。Leu164、Asn264、Phe265、Gly392、Ala393、Ile455与介质发生疏水作用,其中Phe265还会与介质中苯环发生π-π相互作用,达到稳定介质构象的目的。在漆酶与介质相互作用过程中,漆酶活性位点某些氨基酸构象发生变化,其中His458远离T1Cu,导致漆酶的氧化电势升高。本研究在分子水平深入阐明了漆酶与介质之间的相互作用机制,为新介质的发现和现有介质的合理改造提供了重要的理论依据。
[1] 靳蓉,张飞龙.漆酶的来源与分离纯化技术[J].中国生漆,2012,31(3):7-14.
[2] MARGOT J,BENNATI-GRANIER C,MAILLARD J,et al.Bacterial versus fungal laccase potential for micropollutant degradation[J].AMB Express,2013,3(1):63.
[3] MOT A C,SILAGHI-DUMITRESCU R.Laccases:complex architectures for one-electron oxidations[J].Biochemistry(Moscow),2012,77(12):1395-1407.
[4] BOURBONNAIS R,PAICE M G.Oxidation of non-phenolic substrates.an expanded role for laccase in lignin biodegration[J].FEBS Letters,1990,267(1):99-102.
[5] CANAS A,CAMARERO S.Laccases and their natural mediators:biotechnological tools for sustainable eco-friendly processes[J].Biotechnology Advances,2010,28(6):694-705.
[6] CHRISTOPHER L P,YAO B,JI Y.Lignin biodegradation with laccase-mediator systems[J].Frontiers in Energy Research,2014,2(12):1-13.
[7] LI X Z,WANG Y,LÜ Z Y,et al.Important role of natural mediators in oxidation of anthracene and pyrene by laccase producing fungi[J].Microbiology China,2014,41(7):1293-1298.
[8] 汪敏敏,赵林果,谢慧芳.漆酶/香草醛体系生物降解毒死蜱影响因素的研究[J].环境污染与防治,2012,34(8):26-30.
[9] WENG S S,LIU S M,LAI H T.Application parameters of laccase-mediator systems for treatment of sulfonamide antibiotics[J].Bioresource Technology,2013,141(7):152-159.
[10] RICO A,RENCORET J,del RIO J C,et al.Pretreatment with laccase and a phenolic mediator degrades lignin and enhances saccharification ofEucalyptusfeedstock[J].Biotechnology for Biofuels,2014,7(1):6.
[11] BERTRAND T,JOLIVALT C,BRIOZZO P,et al.Crystal structure of a four-copper laccase complexed with an arylamine:insights into substrate recognition and correlation with kinetics[J].Biochemistry,2002,41(23):7325-7333.
[12] ROSADO T,BEMARDO P,KOCI K,et al.Methyl syringate:an efficient phenolic mediator for bacterial and fungal laccases[J].Bioresource Technology,2012,124:371-378.
[13] KONST P,KARA S,KOCHIUS S,et al.Expanding the scope of laccase-mediator systems[J].ChemCatChem,2013,5(10):3027-3032.
[14] 刘海波,崔巍,徐峻,等.中药活性成分对血栓素A2受体抑制作用的分子模拟[J].物理化学学报,2010,26(9):2549-2556.
[15] d′ACUNZO F,GALLI C,GENTILI P,et al.Mechanistic and steric issues in the oxidation of phenolic and non-phenolic compounds by laccase or laccase-mediator systems.the case of bifunctional substrates[J].New Journal of Chemistry,2006,30(4):583-591.
[16] RIVERA-HOYOS C M,MORALES-ALVAREZ E D,POUTOU-PINALES R A,et al.Fungal laccases[J].Fungal Biology Reviews,2013,27(3/4):67-82.
Binding Mode and Interaction Mechanism of Laccase and Mediator Based on Molecular Docking Technique
TAO Guo-xiang1,LI Ai-xiu1,FENG Jia-dong1,ZHANG Min2,ZHAN Li3
(1.DrugDesignLaboratoryoftheBasicScienceDepartment,LogisticsUniversityofChinesePeople′sArmedPoliceForce,Tianjin300309,China;2.ScientificResearchDepartment,LogisticsUniversityofChinesePeople′sArmedPoliceForce,Tianjin300309,China;3.TrainingDepartment,LogisticsUniversityofChinesePeople′sArmedPoliceForce,Tianjin300309,China)
To discuss and reveal the interaction between laccase and mediator in laccase-mediator system,the binding mode of laccase fromTrametesversicolorand 5 kinds of typical mediators was simulated based on a molecular docking technique,the interaction mechanism of laccase and mediators was explained at a molecular level.Results indicated that,amino acid residues Leu164,Asn264,Phe265,Gly392,Ala393,Ile455 were bound with the mediators at laccase active site by hydrophobic force,and Asp206 was bound with the hydroxyl of mediator by hydrogen bond.At the same time,amino acid residues His458 stood off T1Cu,and this might contribute to increase the oxidation potential of laccase.This study provides foundations for further structure design of laccase and mediator,and finding new mediators from natural resources.
laccase;mediator;laccase-mediator system;molecular docking;binding mode;interaction mechanism
武警后勤项目(WJHQ2012-14),武警后勤学院重点项目(WHZ201201)
2016-07-04
陶国翔(1991-),男,河北南宫人,硕士研究生,研究方向:计算机辅助药物设计,E-mail:taoguoxiang91@126.com;通讯作者:李爱秀,教授,E-mail:liaixiu2006@126.com。
10.3969/j.issn.1672-5425.2016.12.009
陶国翔,李爱秀,封加栋,等.基于分子对接技术研究漆酶与介质间的结合模式与相互作用机制[J].化学与生物工程,2016,33(12):42-47.
O 641 Q 814.9
A
1672-5425(2016)12-0042-06
