唑、嗪和呋咱类富氮化合物热行为研究进展
2016-12-29韩志跃杨月桢杜志明张英豪
韩志跃,杨月桢,杜志明,张英豪,姚 谦
(北京理工大学爆炸科学与技术国家重点实验室,北京 100081)
唑、嗪和呋咱类富氮化合物热行为研究进展
韩志跃,杨月桢,杜志明,张英豪,姚 谦
(北京理工大学爆炸科学与技术国家重点实验室,北京 100081)
综述了近年来国内外关于唑、嗪和呋咱类富氮化合物热行为的研究进展,分析总结了热行为研究的方法,得出了化合物结构和取代基团对化合物热稳定性的影响规律。研究表明,富氮化合物热稳定顺序为:呋咱类>嗪类>唑类;三唑>四唑>五唑;三嗪>四嗪,这是由于含碳量、骨架张力和共平面等因素引起的。引入硝基、偶氮键、氰基和叠氮基等含氮基团会降低热稳定性,这是由于取代基团的吸电子效应引起的。富氮环之间的共轭效应可以有效增强分子化合物的热稳定性。指出将热分析与理论计算及气相色谱结合来推断反应机理是未来相关研究的一个方向。附参考文献55篇。
高能量密度材料;富氮化合物;热分析;热动力学参数;呋咱化合物;嗪类化合物;唑类化合物
引 言
高能量密度材料(HEDM)是含能材料发展的趋势,环保、高能和钝感是当今含能材料研究的主题。富氮化合物主要指含氮量达到20%以上的氮杂环类化合物[1],是HEDM中最主要的一类,其分子中主要含有C、N、H、O等元素,根据环上原子数不同分为五元杂环(唑类和呋咱类)和六元杂环(嗪类),又根据杂环中氮原子的数量将唑类分为咪唑、三唑、四唑和五唑,嗪类分为哒嗪、三嗪、四嗪。燃烧分解后气体产物的成分主要为N2、CO2和H2O,不会对环境造成污染,符合环保的理念。由于其结构中含有大量的N-N、C-N、N=N等化学键,从而拥有较高的生成焓和能量密度,符合高能的新理念;某些富氮化合物分子结构具有高度对称性,氮原子的电子形成了共轭效应,化学键的键能提高,使得富氮含能分子的稳定性得以提高[2],从而符合了钝感的理念。因此在生产和应用方面有广泛的前景,这些富氮化合物常常被应用于推进剂、炸药、高能添加剂、气体发生剂等方面,是国内外诸多学者关注的焦点。
热分析是广泛用于描述物质的性质与温度关系的一类技术,是对各类物质在较宽的温度范围内进行定性、定量表征的有效手段。富氮化合物通常热感度较高,存在一定的危险,热分析是了解富氮化合物热稳定性的直接手段,对物质的合成、贮存以及应用有重要的意义,因此对富氮化合物进行热分析研究十分必要。
本文系统地将富氮化合物分为唑类、嗪类和呋咱类3大类,归纳了近几年报道的每一类物质的热力学参数,分析了这些化合物的热分析结果,总结了其热分解行为,对富氮化合物的热行为研究进行了详实的综述,并对富氮化合物热分析提出新的研究思路。
1 唑类化合物及其衍生物热行为研究进展
唑类化合物是富氮含能化合物的一种,具有五元环结构,根据环中氮原子数的不同可分为咪唑、三唑、四唑、五唑4类。国内外学者将关注焦点集中于氮含量逐渐增加的三唑、四唑和五唑这3类物质上。唑类富氮分子化合物由于含有大量N-N和C-N键而具有非常高的正生成焓,其不但在环碳原子上能发生取代反应合成许多含氮杂环唑类衍生物,而且由于孤对电子,环上的氮原子易与过渡金属结合形成配位化合物。这些化合物具有优异的物理化学性能,是很好的功能材料。
1.1 三唑化合物及其衍生物的热行为
三唑化合物是由3个氮原子和2个碳原子组成的五元杂环结构化合物。1,2,3-三唑和1,2,4-三唑作为可以稳定存在的三唑化合物被广泛研究。这2种物质可以发生1,4-取代、4,5-取代和1,4,5-三取代等[3],在其衍生物制备方面可以根据这3类取代方式引入氨基、硝基、叠氮基、氰基等含氮基团,增加物质中的氮含量,提高正生成焓,燃烧爆炸时释放更多的能量,有优良的爆轰性能。
张建国[4]采用DSC和T-jump/FTIR对4-氨基-1,2,4-三唑-5-酮(ATO)进行了常规热分解和快速热分解研究,得到主要气相产物浓度变化曲线。DSC曲线显示ATO有两个吸热峰,峰温分别为187.70和234.10℃,代表ATO的熔化和分解温度。ATO快速热分解主要气相产物为HN3、HCHO,以及部分HCN、H2O和NO2。
Sinditskii等[5]根据3-硝基-1,2,4-三唑-5-酮(NTO)的燃烧波研究了该物质的热分解动力学。研究发现该物质的热分解动力学参数与通过实验测得的该物质的钾盐和乙二胺盐相吻合,说明NTO在高温条件下硝基异构成硝酸的形式,使得NTO分子结构类似于NTO的硝酸盐。
Wang等[6]对4-氨基-5-硝基-1,2,3-三唑(ANTZ)、2-(4-氨基-5-硝基-1,2,3-三唑-1-基)-1、3,5-三硝基苯(T-ANTZ)、4-氨基-5-硝基-1,2,3-三唑脒基脲盐(M-ANTZ)3种物质进行了热分析,得到在10℃/min的升温速率下,ANYZ有一个278.38℃吸热峰(熔化峰)和297.68℃放热峰(分解峰);T-ANTZ在244.01和367.83℃有两个放热峰,分别代表4-氨基-5-硝基-1,2,3-三唑和1,3,5-三硝基苯的分解;M-ANTZ在201.58和235.10℃分别为一个吸热峰和一个放热峰,进而推断出这两个峰分别代表脒基脲和4-氨基-5-硝基-1,2,3-三唑的分解。根据三者的放热分解峰可见芳香烃的结构相比于五元环的唑类更加稳定,然而其较高的碳含量势必会影响到物质的能量;有机盐的结构较不稳定,受热后最先受到破坏,导致物质的热稳定性下降。
赵凤起等[7]对三唑含能离子盐的热动力学行为进行了研究,用Ozawa方程和Kissinger方程计算了1,2,3-三唑硝酸盐、1,2,4-三唑硝酸盐、3,4,5-三氨基-1,2,4-三唑硝酸盐和3,4,5-三氨基-1,2,4-三唑二硝酰胺盐的活化能和指前因子,并计算得到4种物质的活化熵、活化焓和活化吉布斯自由能,结果见表1[7]。同时测试了4种物质的自加速分解温度、热爆炸临界温度和绝热至爆时间。结果表明,五元环的3个氮原子所处的位置影响三唑硝酸盐的热稳定性;引入氨基取代会明显降低三唑硝酸的热稳定性;三唑的二硝酰胺盐虽然具有更高的氮含量,但是其热稳定性明显下降。
Nimesh[8]采用TG-DTA研究了对N-(2,4-二硝基苯基)-3-硝基-1,2,4-三唑和N-(2,4-二硝基苯基)-3-叠氮-1,2,4-三唑的热分解。结果表明,两种物质的放热分解峰温分别为349和217℃,均有较好的热稳定性,其中叠氮根的引入会大幅度降低三唑的热稳定性;通过Kissinger法和Ozawa法计算了两者的非等温动力学参数;结合TG-GC/MS分析技术,测试出该物质的分解产物中存有大量的CO2、NO2、NO、HCN、N2和H2O。通过质谱分析技术可以发现两者分解机理有所不同,前者分解起始于硝基与三唑环化学键的断裂,接着是碳骨架的氧化;然后者先是叠氮基三唑的分解,后是二硝基苯的分解。
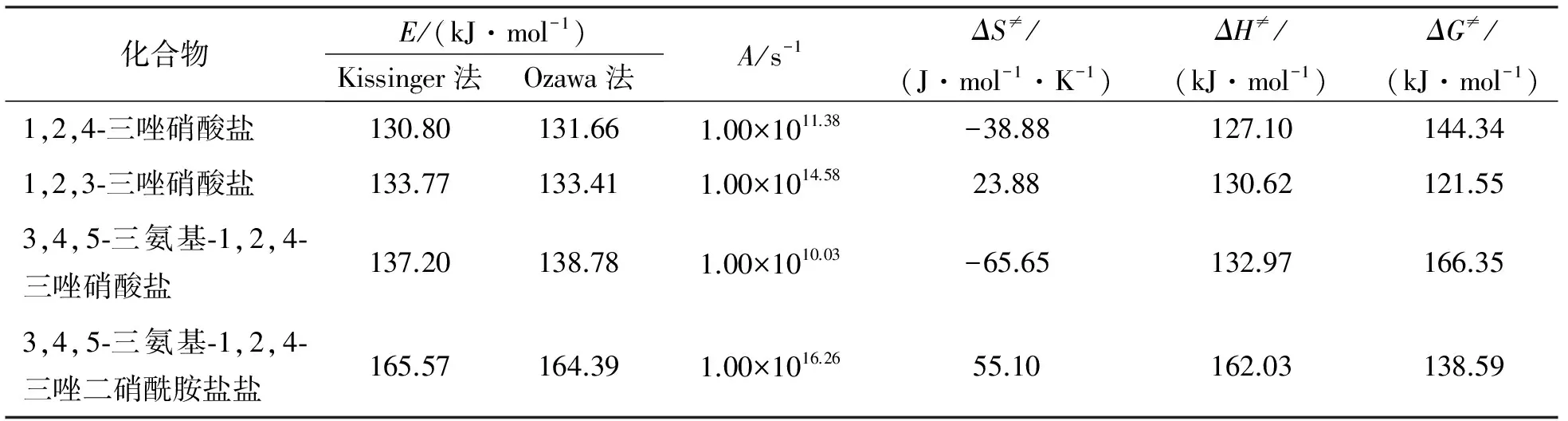
表1 三唑含能离子盐的热动力学参数[7]
注:E为活化能;A为Kissinger方法计算的指前因子;ΔS≠为活化熵;ΔH≠为活化焓;ΔG≠为活化吉布斯自由能。
Du等[9]用TG-DTG技术对1-氨基-1,2,3-三唑硝酸盐的热分解及其热分解反应动力学进行了研究,提出了分解机理。结果表明,1-氨基-1,2,3-三唑硝酸盐分解过程有两个失重阶段,先用Kissinger法和Ozawa法得到表观活化能(E)和指前因子(A),再采用Satava-Sesta法和Achar法得到几种可能的分解机理函数,最后通过Satava法、双因子外推法和Popescu法得到唯一分解机理函数。该物质分解分为两个阶段,第1阶段E=128.97kJ/mol,A=1.00×1013.78s-1;第2阶段E=117.37kJ/mol,A=1.00×1010.93s-1。该物质两个阶段反应机理都是随机成核和随后生长的模型,两个阶段的动力学方程分别见式(1)和式(2);动力学补偿效应表达式分别见式(3)和式(4)。
(1)
(2)
lgA=0.1213E-1.8946
(3)
lgA=0.1149E-2.5426
(4)
池钰等[10]对4,4′-联-1,2,4-三唑(BTz)的热行为进行了研究。运用不同升温速率的DSC测试方法,将数据代入Ozawa和Kissinger公式求出BTz的表观活化能分别为223.7和222.4kJ/mol,指前因子分别为6.31×1020s-1和3.98×1020s-1。DSC和TG-DTG曲线显示,10 ℃/min升温速率下BTz分解峰温度为290.0 ℃,在173.1 ℃的吸热峰代表晶型转变,275.4 ℃的吸热峰代表物质的熔化。联三唑的物质结构对称,有较好的热稳定性。
部分常见三唑化合物的熔点温度和分解温度的研究表明[11-13],1,2,4-三唑比1,2,3-三唑有更好的热稳定性,各取代基降低三唑衍生物稳定性的能力强弱为:-N3>-NHNO2>-NH2>-NO2,其中甲基(-CH3)会提高三唑衍生物的稳定性。当取代基取代三唑环中氮原子上的氢时,热稳定性显著降低。
1.2 四唑化合物及其衍生物的热行为
Lesnikovich等[14]对5-氨基四唑(5-AT)、1-甲基-5-氨基四唑(MAT)、1,5-二氨基四唑(DAT)、聚-1-乙烯基-5-氨基四唑(PVAT)和5-氨基四唑钠盐(SAT)进行了热分解研究。采用类热重分析法、热容分析法(TVA)、DSC、DTA和逸出气体分析法研究了这5种物质的热行为。采用Ozawa法和不变动力学参数法(IKP)计算化合物的热分解动力学参数,推导出分解机理函数。DSC测试条件下,升温速率为10K/min,氮气压强为1MPa,5种物质的热分解参数[14]、表观活化能、指前因子[14]、分解气体产物[14]见表2。由表2可以发现,甲基的取代能够提高物质的热稳定性;氨基取代越多,物质热稳定性越差。
Gerd等[15]对1,5-二氨基-4-甲基-1H-四唑硝酸盐、二硝酰胺盐和叠氮化物进行了TGA和DSC分析[15],采用红外光谱法分析了这3种物质热分解气体产物,按2、5、10、20、40 ℃/min的升温速率采用Ozawa法和Kissinger法计算出这3种物质的表观活化能[15]。根据其分解温度范围可以发现,随着外界阴离子中氮含量的增加,该含能离子盐的热稳定性逐渐下降,所以在追求高氮的同时需要考虑物质的热安定性。2011年,Nicholas等[16]也对1,5-二氨基-4-甲基-1H-四唑二硝酰胺盐和叠氮化物进行了热分解研究,采用微差示扫描量热仪进行快速加热分析研究,通过Ozawa法计算出两者的表观活化能为74和41kJ/mol,相比于Fischer等的实验结果相差甚远,说明在快速升温环境下富氮化合物的热分解机理与低速升温环境下有极大差异。
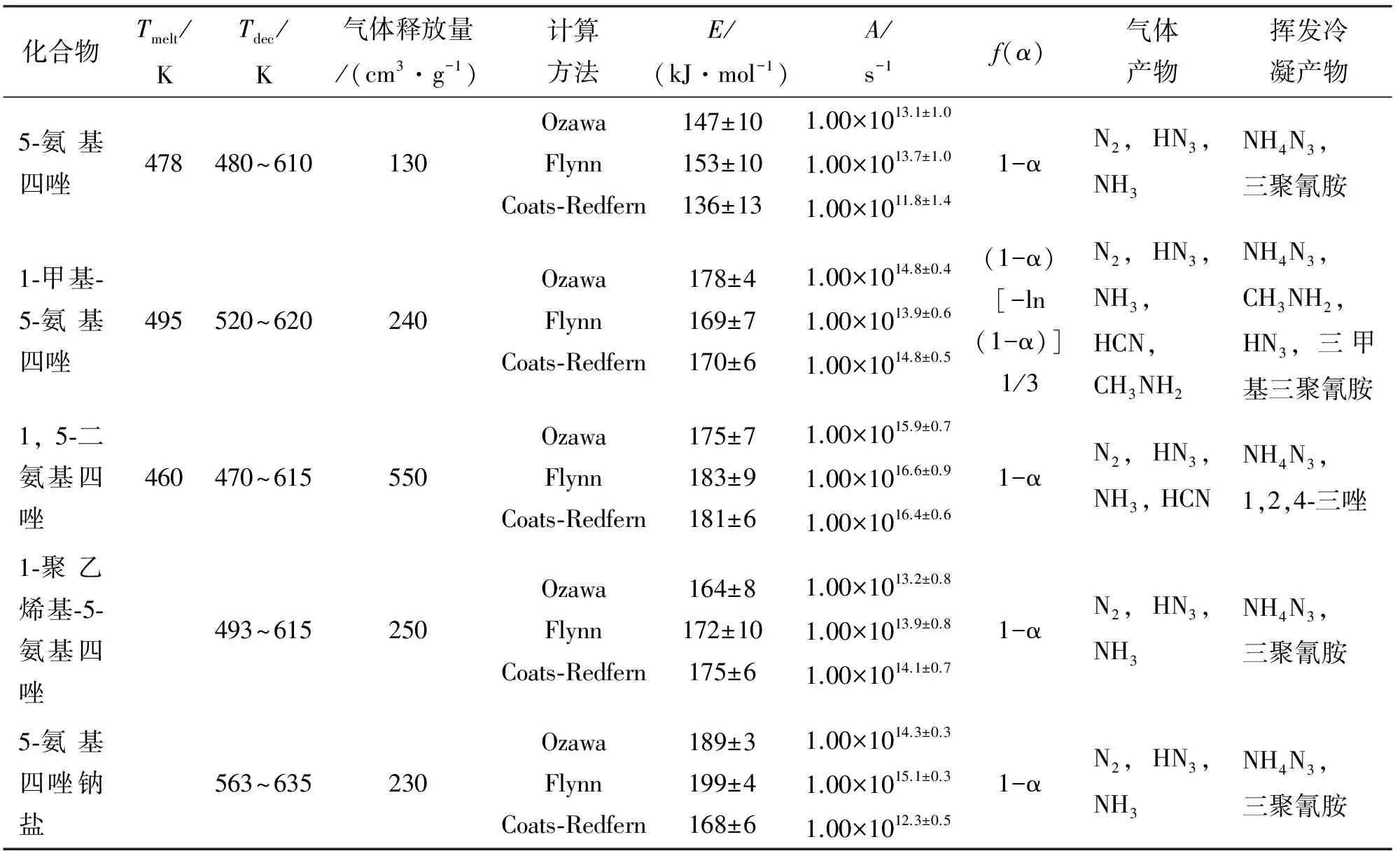
表2 氨基四唑化合物及其衍生物热分解特性参数[14]
Han等[17-18]对1,1′-二异亚丙氨基-5,5′-偶氮四唑(DPrZT)和1,1′-二氨基-5,5′-偶氮四唑(DAZT)的热行为进行了研究。根据2、5、10、15、20 ℃/min不同升温速率下化合物TGA-DSC曲线上的不同峰温,代入Kissinger公式计算出表观活化能为160.12和138.57kJ/mol,指前因子为10×1017和10×1014.14s-1。从TGA-DSC曲线上可以发现,DPrZT加热过程中有相变无熔点,151.22 ℃剧烈分解;DAZT有熔点,温度为159.79 ℃,在178.76 ℃发生分解。2013年研究发现,偶氮化合物中N=N的存在使得物质结构极其不稳定,热稳定性大幅度降低。
Neeraj等[19]运用了实验结合计算的方式研究了液态偶氮四唑胍盐的分解机理,在极高的加热速率下,运用了FTIR技术分析了气态分解产物,采用飞行时间质谱仪(ToFMS)气态物质的质谱,测出该物质分解产物主要为N2、NH3、HCN、胍和安聚氰胺。同时,运用从头算的方法,采用B3LYP/6-311++G(d,p)、CBS-QB3、MP2/6-311++G(d,p)等多种理论基组对偶氮四唑胍盐的生成焓、吉布斯自由能等参数进行估算并模拟其分解机理,从理论上解释了实验所得的液态偶氮四唑分解机理。随后也对液态5-氨基四唑胍盐进行了同样的研究[20]。将理论计算引入热分析研究可以从更深层次的机理方面解释实验研究中的现象,使得实验结果的推论更加有理有据。部分已报道的四唑类化合物及其衍生物的熔点温度(Tmelt)和(Tdec)分解温度见表3[21-26]。
表3 四唑化合物及其衍生物的熔点温度和分解温度
Table 3 Melting temperature and decomposition temperature of tetrazoles and their derivatives
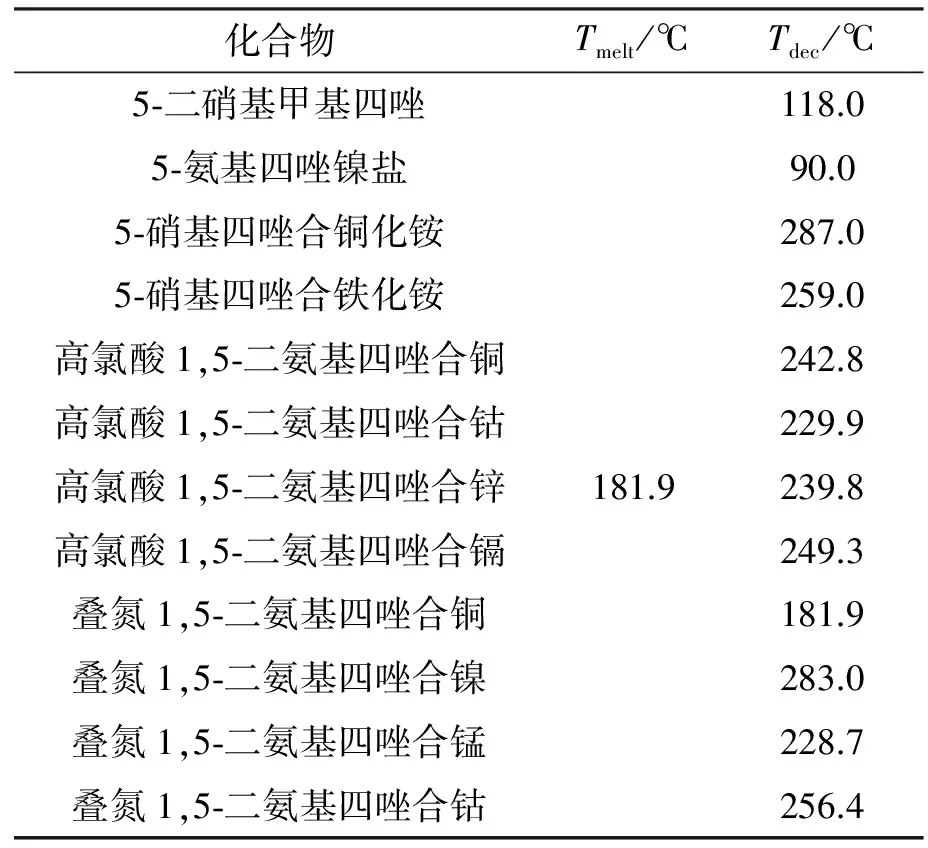
化合物Tmelt/℃Tdec/℃5⁃二硝基甲基四唑118.05⁃氨基四唑镍盐90.05⁃硝基四唑合铜化铵287.05⁃硝基四唑合铁化铵259.0高氯酸1,5⁃二氨基四唑合铜242.8高氯酸1,5⁃二氨基四唑合钴229.9高氯酸1,5⁃二氨基四唑合锌181.9239.8高氯酸1,5⁃二氨基四唑合镉249.3叠氮1,5⁃二氨基四唑合铜181.9叠氮1,5⁃二氨基四唑合镍283.0叠氮1,5⁃二氨基四唑合锰228.7叠氮1,5⁃二氨基四唑合钴256.4
1.3 五唑化合物的热行为
毕福强等[27]采用低温动态核磁分析技术研究了对丁叔基苯基五唑(p-tBPP)的分解动力学。低温动态核磁技术可获得p-tBPP在273K下不同时间(t)时的相对浓度(M),通过拟合lnM与t的关系式,得到该物质的分解速率常数k=5.77×10-4s-1。根据Arrhenius公式,以不同温度下不同的分解速率常数作图,计算出该物质的活化能和指前因子分别为93.1kJ/mol和3.80×1014s-1。根据低温动态核磁分析结果得出p-tBPP贮存的适宜温度为233.15K。五唑类化合物中五元环结构全为氮原子相连,其热稳定性极差,虽然有极高的氮含量,但是不具有实用性。
综上可以看出,单独唑环的热稳定性顺序为:三唑>四唑>五唑,这是由于唑环中氮原子含量增多,N-N、C-N、N=N的数量随之增多,唑环骨架张力增大,使分子结构不稳定引起的。在唑环中引入氨基、硝基、叠氮基、氰基等含氮基团,可以提高化合物的氮含量,取代基团根据吸推电子效应(包括诱导效应和共轭效应)使唑环的结构稳定性产生变化,进而影响化合物分子的热分解行为。
2 嗪类化合物及其衍生物热行为研究进展
嗪类化合物也是富氮化合物的一种,为六元杂环结构,根据结构中氮原子数的不同可以分为哒嗪、三嗪、四嗪3大类。与唑类相比嗪类物质氮含量较低,但仍高于普通化合物,因此在产气剂、固体推进剂和烟火剂领域被广泛研究。嗪类化合物的六元环结构更加稳定,同唑类化合物一样有较高的密度和正生成焓,热稳定性好。因此,嗪类化合物可以通过亲核取代反应制备多种衍生物,无论作为配体还是高能添加剂,这些衍生物都是较为理想的含能材料。
2.1 三嗪化合物及其衍生物的热行为
三嗪环张力较小,稳定性好,氮含量高达51.83%,有较高的生成焓[29]。三嗪化合物有3种同分异构体,分别为1,3,5-三嗪、1,2,4-三嗪和1,2,3-三嗪。由于结构稳定性不同,研究焦点一般为1,3,5-三嗪(均三嗪)。对均三嗪的2、4、6位进行亲核取代可以制备出多种衍生物,然后通过化学反应合成新型离子衍生物[29]。
李玉川等[30]对4,4′,6,6′-四叠氮基偶氮-1,3,5-三嗪(TAAT)进行了热分解研究。在20 ℃/min升温速率下对此化合物进行了DSC分析,在153.78 ℃有一个吸热峰,为该物质的熔点;在221.74 ℃分解速率达到最大,238 ℃时放热结束。结合程序升温FT-IR分析结果,推断出TAAT的热分解机理:缓慢升温下TAAT缓慢释放氮气,保留四嗪环,交联形成新型网状结构;快速升温下TAAT直接剧烈分解成气体。
周诚等[31]对2-硝亚氨基-5-硝基-六氢化-1,3,5-三嗪(NNHT)的热分解行为进行了研究。采用升温速率10 ℃/min的DSC、TG与固体原位反应池/FT-IR联用的手段进行了研究。NNHT的放热分解峰温度在219.54 ℃,热稳定性较好。通过固体原位反应池/FT-IR联用技术分析出了NNHT分解始于-NO2的断裂,并伴随三嗪环的破裂,产生N2O、CO2、HCN、NO和CO等气体。
Yan等[32]研究了2-氨基-4,6-二叠氮基-s-三嗪(DAAT)、N-硝胺基-4,6-二叠氮基-s-三嗪(DANT)、4,4′,6,6′-四叠氮基-s-三嗪肼(TAHT)、4,4′,6,6′-四叠氮基偶氮-s-三嗪(TAAT)4种三嗪衍生物的热行为。采用TG和DSC技术测试了4种物质的热分解曲线,DAAT分解峰温在217 ℃,相比于DANT的153 ℃峰温高很多,说明硝胺基使物质的热稳定性下降;THAT的分解温度在219 ℃,相比于THAT的分解温度195 ℃略高,这也说明了N=N的不稳定性。
Liu等[33]研究了2,5-二氨基-4-酮-均三嗪的硝酸盐、硫酸盐、高氯酸盐和二氰胺盐的分解温度,分别为303.3、258.5、336.4、135.3 ℃。
2.2 四嗪化合物及其衍生物的热行为
Huo等[34]合成了3,6-双硝基胍基-1,2,4,5-四嗪(DNGTz)、其三氨基胍基盐(TGA-DNGTz)和脒基脲盐(M-DNGTz),并对这些化合物的热行为进行了研究。按10℃/min的升温速率对3种化合物进行了DSC和TG-DTG分析,其分解温度分别为248.7、246.2和190.2℃。
周诚等[35]对3,6-二氨基-1,2,4,5-四嗪(DATz)进行了热行为研究。通过DSC和TG-DTG(升温速率10℃/min)曲线发现该物质放热峰温为351.15℃,起始分解温度为265.15℃。采用固体原位反应池/FT-IR联用技术,得出DATz分解始于四嗪环的破裂,最后才是氨基的分解。
部分已经报道的四嗪类化合物及其衍生物的熔化温度(Tmelt)和(Tdet)分解温度见表4[36-40]。均四嗪因为其结构对称,很容易在四嗪环中的两个碳原子上发生取代反应,因此也有多种衍生物被制备出来。对位碳上的取代基不同,影响着化合物的热稳定性。取代基中氮含量越高,物质的热稳定性越低,因此将化合物制备成含能有机离子盐是同时提高其稳定性和氮含量的一种手段。
表4 四嗪化合物及其衍生物的熔化温度和分解温度
Table 4 Melting temperature and decomposition temperature of tetrazines and their derivatives
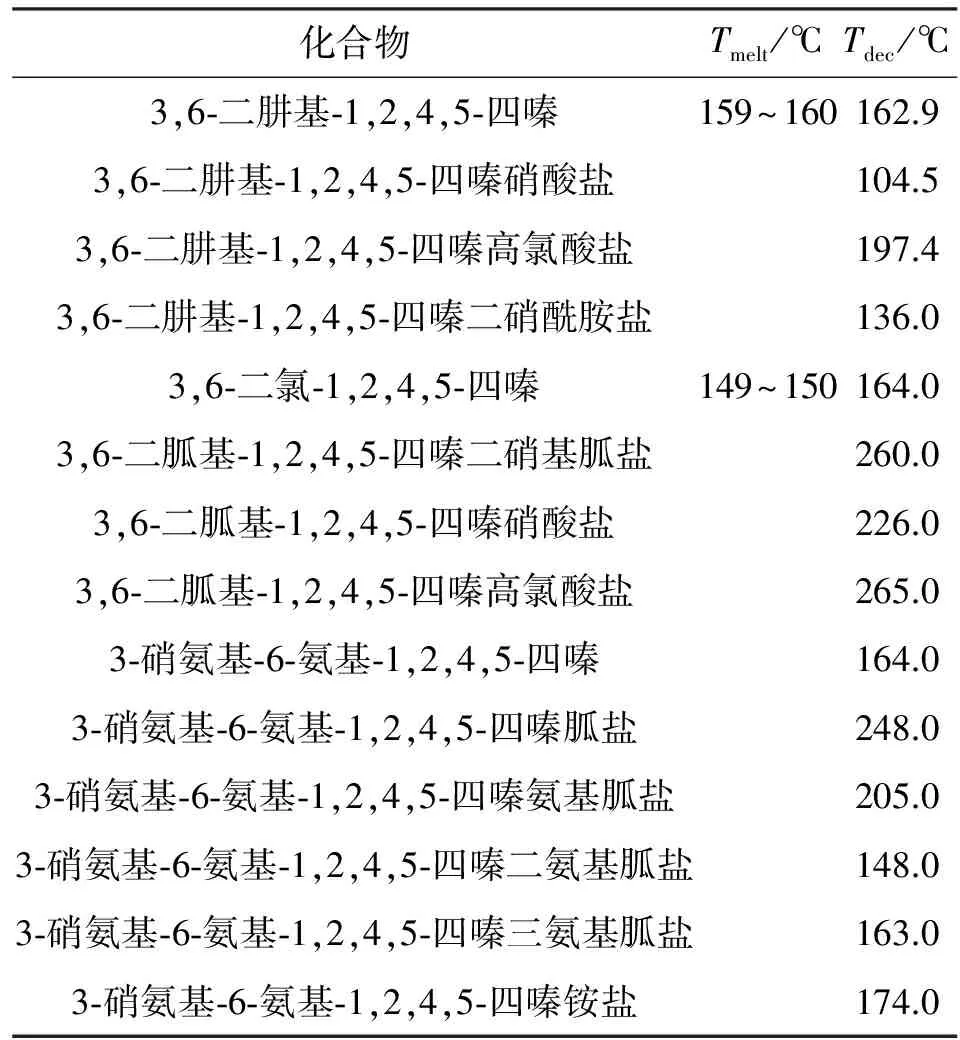
化合物Tmelt/℃Tdec/℃3,6⁃二肼基⁃1,2,4,5⁃四嗪159~160162.93,6⁃二肼基⁃1,2,4,5⁃四嗪硝酸盐104.53,6⁃二肼基⁃1,2,4,5⁃四嗪高氯酸盐197.43,6⁃二肼基⁃1,2,4,5⁃四嗪二硝酰胺盐136.03,6⁃二氯⁃1,2,4,5⁃四嗪149~150164.03,6⁃二胍基⁃1,2,4,5⁃四嗪二硝基胍盐260.03,6⁃二胍基⁃1,2,4,5⁃四嗪硝酸盐226.03,6⁃二胍基⁃1,2,4,5⁃四嗪高氯酸盐265.03⁃硝氨基⁃6⁃氨基⁃1,2,4,5⁃四嗪164.03⁃硝氨基⁃6⁃氨基⁃1,2,4,5⁃四嗪胍盐248.03⁃硝氨基⁃6⁃氨基⁃1,2,4,5⁃四嗪氨基胍盐205.03⁃硝氨基⁃6⁃氨基⁃1,2,4,5⁃四嗪二氨基胍盐148.03⁃硝氨基⁃6⁃氨基⁃1,2,4,5⁃四嗪三氨基胍盐163.03⁃硝氨基⁃6⁃氨基⁃1,2,4,5⁃四嗪铵盐174.0
熊鹰、周阳等[41]采用从头算分子动力学方法,对均四嗪的5种衍生物分子的热分解轨迹进行了模拟,获得了它们的各种热分解途径及其难易程度。用密度泛涵理论在B3LYP/6-311G( d, p)水平下计算了各稳定点和过渡态的几何结构和能量,得到了各反应途径的能垒高度,从能量的角度对从头算分子动力学模拟结果进行了验证。得到了5种不同类型的取代基对四嗪环的开环方式、稳定性以及对四嗪类高氮化合物热分解机理的影响规律。当取代基的稳定性高于四嗪环的稳定性时,该化合物首先发生开环反应;反之,则首先发生取代基反应。
综上可以看出,嗪类富氮化合物的热稳定性明显优于唑类富氮化合物,三嗪化合物的热稳定性优于四嗪化合物。将化合物制备成含能有机离子盐是提高其稳定性和氮含量的一种有效途径。
3 呋咱类化合物热行为研究进展
呋咱化合物是五元环结构,但与唑类不同的是,呋咱环中含有一个活泼氧原子,该氧原子会在环中形成一个隐藏的硝基结构[42]。呋咱类化合物也有高生成焓和高含氮量[43]。通过偶联反应、取代反应,呋咱化合物的种类也相当多。
3.1 简单呋咱化合物的热行为
一般典型的呋咱化合物和氧化呋咱化合物分解[42]过程如式(1)和式(2)所示:
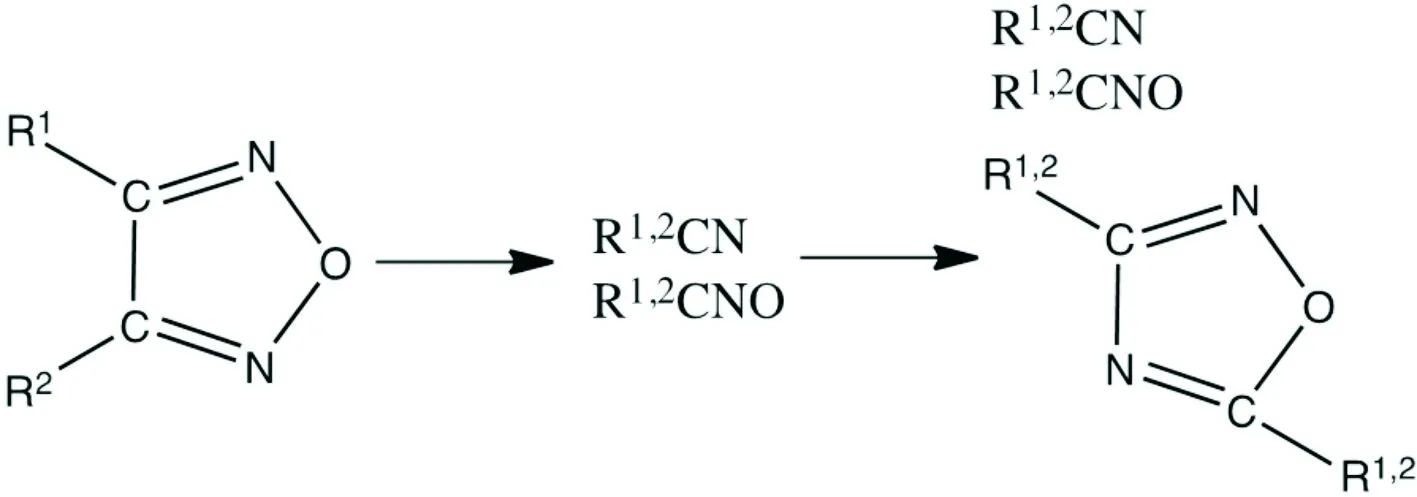
(1)
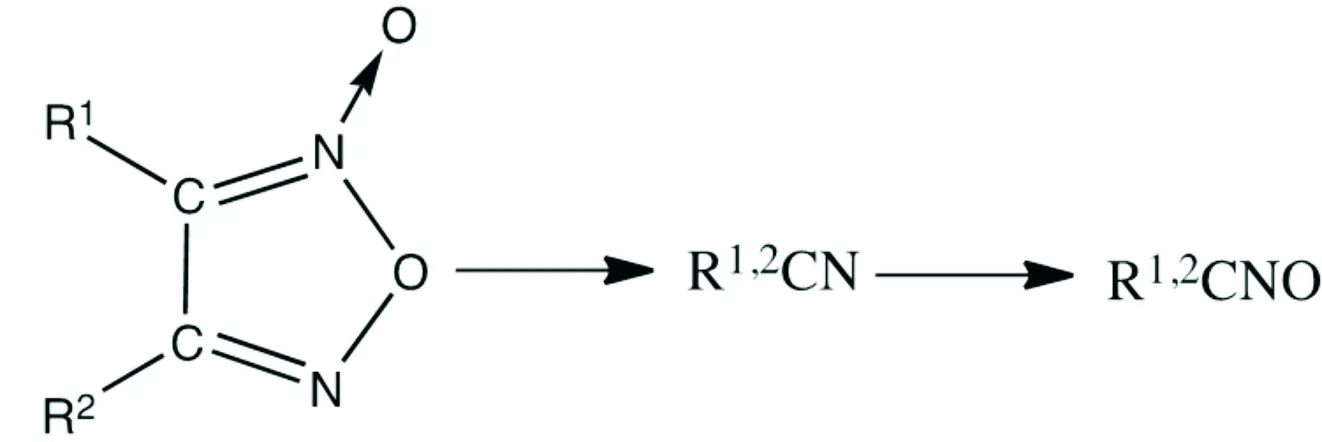
(2)
呋咱环上的取代基往往对分解机理有很大的影响。G.K.Willams等[44]对3,4位取代呋咱及其衍生物进行了快速热分解研究。采用T-jump/FT-IR法分析了3-氨基-4-硝基呋咱(ANF)的分解产物为CO2、CO、H2O、HCN、N2O、N2和H2;3-硝胺基-4-硝基呋咱(NNF)的分解产物会根据快速加热温度和氩气压力的不同有所不同,当压力较低时会因为呋咱的开环产生NCCNO,当温度较低时会产生硝酸,其研究结果见表5[45]。
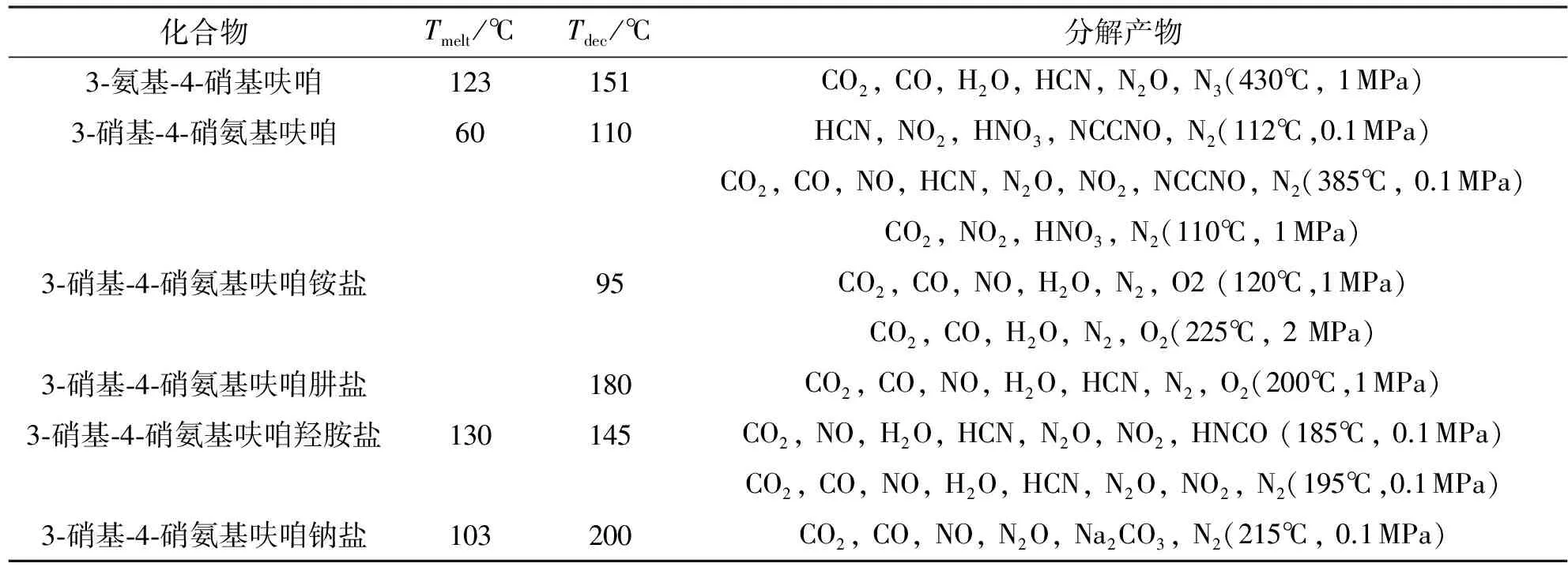
表5 呋咱化合物的熔点温度、分解温度和分解产物
付占达等[46]对新型异呋咱类含能材料的热行为进行了研究,该材料为3-硝基-5-胍基-1,2,4-噁二唑(NOG)。采用多重升温速率(5、10、15、20℃/min)DSC曲线通过Kissinger方程和Ozawa方程计算出该物质的表观活化能分别为271.98和267.57kJ/mol,指前因子A为1.00×1025.20s-1(Kissinger方程)。
Hui等[47]对氧桥联双(1H-四唑-5-基)呋咱的热行为进行了研究,采用DSC和TG-FTIR-MS联用的分析手段研究了该物质分解过程。在10℃/min升温条件下得出该物质的熔化峰温为219.9℃,两个阶段的放热分解温度分别在217.9~254.0和254~500 ℃。按5、10、15、20℃/min的升温速率测量放热峰峰温,由Kissinger方程求出表观活化能E为152.87kJ/mol,由Ozawa方程求出指前因子A为1×1013.45s-1。并得出物质的分解机理为:先是四唑取代基的开环,接着是呋咱环上取代基的脱落,最后是呋咱环的开环,生成稳定的气态产物。整个过程中氧桥直到最后呋咱开环时才断裂。
3.2 氧化呋咱化合物的热行为
前苏联炸药合成领域专家 Новиков[48]和Годовикова[49]的专著系统介绍了氧化呋咱的结构、合成方法以及相关化学反应,深入介绍了呋咱的基础科学研究,主要包括单取代氧化呋咱、双取代氧化呋咱、4-氧化呋咱硝肟酸、金刚烷氧化呋咱等,并多次提及呋咱类的热分析研究。
王鹏等[48]采用DTA技术对8种苯并氧化呋咱化合物的热分解进行了研究,结构论证了氧化呋咱基团对化合物活性的影响,不仅影响了化合物的分解温度,也影响了化合物的熔点。苯环上氧化呋咱基团的增加会降低其热稳定性;若苯环本身含有硝基基团,再引入碱性基团会大幅降低化合物的热稳定性。
苗艳玲等[50]对4,6-二硝基苯并氧化呋咱(DNBF)进行了热分解机理研究。采用TG-DTG和DSC研究了该物质的热分解过程,结果表明该物质没有熔点,受热熔化后随温度升高从液相完全分解成CO、CO2、NO、HCN和H2O等气相产物。
王鹏等[51]对苯并氧化呋咱化合物的热分析得出的熔点、分解温度、表观活化能和指前因子如表6所示。
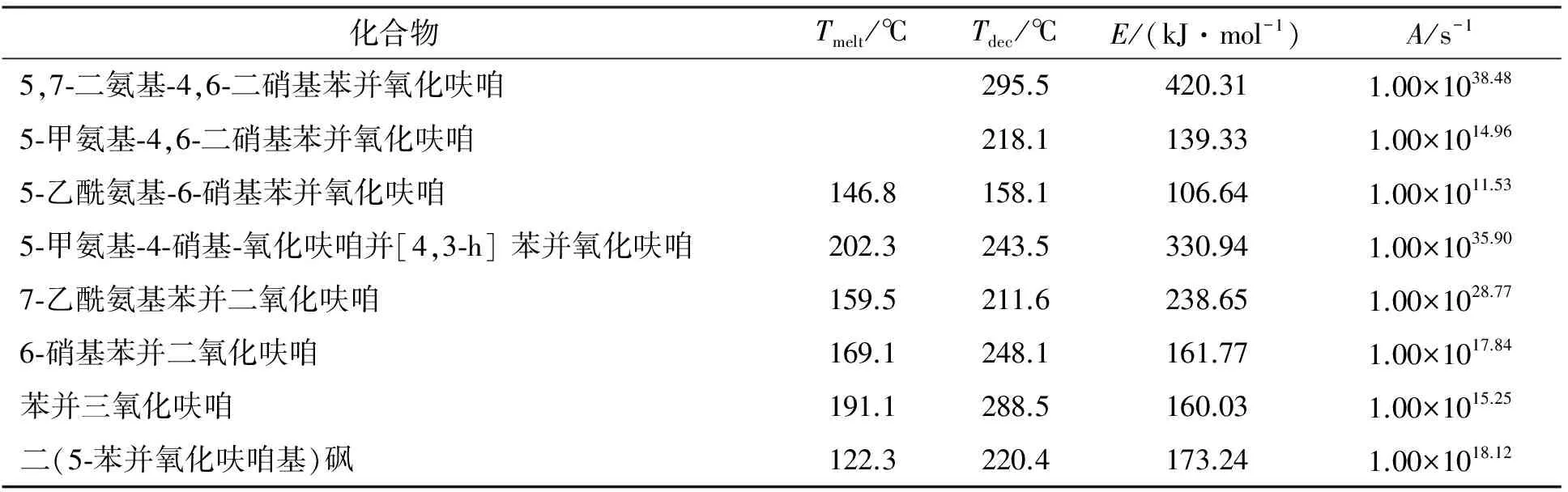
表6 苯并氧化呋咱化合物的热动力学参数
3.3 双呋咱环和多呋咱环化合物的热行为
Royce等[52]采用T-jump/FT-IR技术对3种偶氮呋咱化合物(二氨基偶氮呋咱DAAzF、氨基硝基偶氮呋咱ANAzF、二硝基偶氮呋咱DNAzF)、3种氧化偶氮化合物(二氨基偶氮氧化呋咱DAAF、氨基硝基偶氮氧化呋咱ABAF、二硝基偶氮氧化呋咱DNAF)和3种氢化偶氮呋咱(二氨基氢化偶氮呋咱DAHzF、氨基硝基氢化偶氮呋咱ANHzF、二硝基氢化偶氮呋咱DNHzF)的热行为进行了研究,得出了这些物质的分解温度,推断出分解产物。
张兴高等[53]对3,3′-二硝基-4,4′-氧化偶氮呋咱(DNOAF)的热分解特性进行了研究。常压下TG曲线显示DNOAF分解温度在100 ℃左右,到187.63℃失重完毕。在对DNOAF进行DSC分析时改变所处环境压强,得到该物质热分解对压强敏感的结论。采用固体原位反应池/FT-IR联用技术对DNOAF分解机理进行研究,得出该物质的分解步骤为:第1步是氧化偶氮双键一侧链接的呋咱环脱离;第2步是两部分呋咱环的开环。由于两个呋咱环上取代基不同,其开环后的物质也有所不同。与之前氧桥联呋咱环不同,DNOAF分解的第1步是偶联的破坏,因此其热稳定性较差。
舒远杰等[54]研究了3,3′-二氨基-4,4′-偶氮呋咱、3,4-二呋咱基氧化呋咱(DNTF)及苯并氧化呋咱(CL 18)等呋咱类化合物的热分解机理和热分解温度并做了阶段性综述。
Sinditskii等[55]研究了3,3′-二氨基-4,4′-偶氮呋咱(DAAzF)的热行为,包括固相、气相以及液相DAAzF的热分解机理。研究结果表明,固相的DAAzF表观活化能异常高,为271.5kJ/mol,其原因为分解过程中汽化试样的分解反应影响了固相DAAzF的热分解。为此,对DAAzF的气相和液相的热分解做了进一步研究,得到该物质的气相表观活化能为174kJ/mol,溶解后状态下的表观活化能为138kJ/mol。说明在计算出化合物的表观活化能后,如有异常值,需要对该物质固液气三相进行进一步的系统研究,才能得到合理的解释。
综上可以看出,呋咱类化合物的平面性较好,所以热稳定性普遍较高,但呋咱类化合物中的氮含量明显低于唑类和嗪类。分解产生的气体中氮气的含量会降低,碳氧化物的含量会增多,这会使其燃烧产物的环保性降低。
4 结论及展望
通过综述近几年国内外唑、嗪和呋咱类富氮化合物热行为的研究现状,分析总结了热行为研究方法。 研究结果表明,大部分唑、嗪和呋咱类富氮化合物具有较好的热稳定性,化合物结构对其热稳定性影响有规律可循:
(1)唑环热稳定性顺序为:三唑>四唑>五唑,这是由于唑环中氮原子含量增多,N-N、C-N、N=N的数量随之增多,唑环骨架张力增大,使分子结构不稳定引起的;
(2)嗪类富氮化合物的热稳定性明显优于唑类富氮化合物,三嗪化合物的热稳定性优于四嗪化合物;
(3)呋咱类化合物的含碳量较高而且分子平面性较好,所以热稳定性普遍较高,但呋咱类化合物中的氮含量明显低于唑类和嗪类。同时也由于碳骨架相对稳定,呋咱类更易发生活性反应,在引入含氧基团的同时未降低其热稳定性;
(4)在大多数富氮环中引入氨基、硝基、叠氮基、氰基等含氮基团,可以提高化合物的氮含量,其热稳定性也有所提高;
(5)将化合物制备成含能有机离子盐是提高其稳定性和氮含量的一种有效途径,降低其热稳定性。
目前,研究富氮化合物热行为的方法主要集中在热重和差示扫描量热法,而这两种方法只能简单从质量和热流基本的物理变化来衡量热分解行为。而目前鲜有报道的TG-DSC与气相色谱联用法实现了热分析仪器和气相色谱的联用,从而不仅可以从物理层面研究物质分解,而且可以分离研究分解气体成分,从而可以验证和推断物质的热分解机理。
富氮化合物的研究已经从单一的唑类、嗪类、呋咱类转变成多种类型富氮环结合的新型化合物的研究。这样的结合不仅可以提高富氮化合物的密度,还能提高物质的含氮量,使其结构更加稳定,是未来的研究趋势。通过热分析发现分子中共平面结构和电子效应可以降低物质的热感度,可以在后续富氮化合物的设计和合成中引入这类结构,在保证含氮量增加的同时热稳定性不会向低方向发生大的波动。
[1] 张兴高. 高氮化合物的合成及其含能材料热分解研究[D]. 长沙: 国防科技大学, 2005. ZHANG Xing-gao. The synthesis and thermal decomposition study of high-nitrogen energetic compounds[D]. Changsha: National University of Defense Technology, 2005.
[2] 王宏社,杜志明. 富氮化合物研究进展[J]. 含能材料, 2005, 13(3): 196-199. WANG Hong-she, DU Zhi-ming. Progress in synthesis and properties of nitrogen rich compounds[J]. Chinese Journal of Energetic Material, 2005, 13(3): 196-199.
[3] 王景梅,李凌君,张贵生. 1,2,3-三唑化合物的合成研究进展[J]. 有机化学, 2009, 29(1):13-19. WANG Jing-mei, LI Ling-jun, ZHANG Gui-sheng. Progress in syntheses of 1,2,3-triazole[J]. Chinese Journal of Organic Chemistry, 2009, 29(1): 13-19.
[4] 张建国,张同来. 4-氨基-1,2,4-三唑-5-酮的制备和快速热分解过程研究[J]. 火炸药学报, 2001, 24(2): 19-21. ZHANG Jian-guo, ZHANG Tong-lai. Preparation and the flash pyrolysis of 4-amino-1,2,4-triazol-5-one(ATO)[J]. Chinese Journal of Explosives & Propellants(Huozhayao Xuebao), 2001, 24(2): 19-21.
[5] Sinditskii V P, Egorshev V Y, Serushkin V V, et al. Evaluation of decomposition kinetics of energetic materials in the combustion wave[J]. Thermochimica Acta, 2009: 1-12.
[6] WANG Bo-zhou, LI Ji-zhen, HUO Huan, et al. Synthesis,characterization and thermal behaviors of 4-Amino-5-nitro-1,2,3-triazole (ANTZ) and its derivatives[J]. Chinese Journal of Organic Chemistry, 2010, 28:781-784.
[7] 赵凤起,薛亮,邢晓玲,等. 三唑含能离子盐等热化学性质和热动力学行为[J]. 中国科学: 化学, 2010,40(9): 1430-1443. ZHAO Feng-qi, XUE Liang, XING Xiao-ling, et al. Thermochemical properties and thermokinetic behavior of energetic triazole ionic salts[J]. Scientia Sinica Chimica, 2010, 40(9): 1430-1443.
[8] Nimesh Sasidharan, Hariharanath B, Rajendran A G.Thermal decomposition studies on energetic triazole derivatives[J]. Thermochimica Acta, 2011: 139-144.
[9] DU Xu-jie, LI Xiao-dong, YANG Rong-jie. Thermal decomposition reaction kinetics of 1-amino-1,2,3-triazolium nitrate[J]. Chinese Journal of Explosives & Propellants(Huozhayao Xuebao), 2013, 36(5): 22-28.
[10] 池钰,张勇,黄明,等. 4,4′-联-1,2,4-三唑的晶型转变及热分解行为[J]. 含能材料, 2012, 20(6): 697-700. CHI Yu, ZHANG Yong, HUANG Ming, et al. Phase transition and thermal decomposition behaviors of 4,4′-bis-1,2,4-triazole[J]. Chinese Journal of Energetic Material, 2012, 20(6): 697-700.
[11] Crawford M J, Karaghiosoff K, Klapötke T M. Synthesis and characterization of 4,5-dicyano-2H-1,2,3-triazole and its sodium, ammonium, and guanidinium salts[J]. Inorganic Chemistry, 2009, 48: 1731-1743.
[12] ZHANG Yan-qiang, Parrish D A, Shreeve J M. Derivatives of 5-nitro-1,2,3-2H-triazole——high performance energetic materials[J]. Electronic Supplementary Material (ESI) for Journal of Materials Chemistry A, 2013(1): 585-593.
[13] Chavez D E, Parrish D A. Synthesis and characterization of 1-nitroguanyl-3-nitro-5-amino-1,2,4-triazole[J]. Propellants,Explosives,Pyrotechnics, 2012, 37: 536-539.
[14] Lesnikovich A I, Ivashkevich O A, Levchik S V, et al. Thermal decomposition of aminotetrazoles[J]. Thermochimica Acta, 2002, 388: 233-251.
[15] Fischer Gerd, Holl Gerhard, Klapötke T M, et al. A study on the thermal decomposition behavior of derivatives of 1,5-diamino-1H-tetrazole (DAT): a new family of energetic heterocyclic-based salts[J]. Thermochimica Acta, 2005, 437: 168-178.
[16] Piekiel N W, Cavicchi R E, Zachariah M R. Rapid-heating of energetic materials using a micro-differnetial scanning calorimeter[J]. Thermochimica Acta, 2011, 521:125-129.
[17] HAN Zhi-yue, YAO Qian, ZHANG Ying-hao, et al. Synthetic process optimization and thermal analysis of 1,1′-diamino-5,5′-azotetrazole[J]. Journal of Thermal Analysis & Calorimetry, 2015; DOI 10.1007/s10973-015-4612-2.
[18] HAN Zhi-yue, YAO Qian, ZHANG Ying-hao, et al. 1,1′- Diisopropylideneamino-5,5′-azotetrozole: synthesis and performance[J]. Journal of Thermal Analysis & Calorimetry,2015,119: 461-469.
[19] Kumbhakarna N R, Shah K J, Chowdhury A, et al. Identification of liquid-phase decomposition species and reactions for guanidinium azotetrazolate[J]. Thermochimic Acta, 2014, 582:51-65.
[20] Kumbhakarna N, Thynell S T. Development of a reaction mechanism for liquid-phase decomposition of guanidinium 5-amino tetrazole[J]. Thermochimica Acta, 2014, 590: 25-34.
[21] 齐书元,张同来,杨利,等. 1,5-二氨基四唑及其化合物研究进展[J]. 含能材料, 2009, 17(4): 486-489. QI Shu-yuan, ZHANG Tong-lai, YANG Li, et al. Progress in 1,5-diamino-1-H-tetrazole and its derivatives[J]. Chinese Journal of Energetic Material, 2009, 17(4): 486-489.
[22] 武碧栋,李富刚,张同来,等. 含能叠氮配合物[M(DAT)2(N3)2](DAT=1,5-二氨基四唑)的制备、结构表征和性能研究[C]∥全国强动载效应及防护学术会议暨复杂介质/结构的动态力学行为创新研究群体学术研讨会. 北京: 北京理工大学出版社, 2013. WU Bi-dong, LI Fu-gang, ZHANG Tong-lai, et al. The synthesis ,structure and properties of [M(DAT)2(N3)2](DAT=1,5- diaminotetrazole)[C]∥ 2013 International Workshop on Intensive Loading and Its Effects & Innovation Research Group Symposium on Dynamic Mechanical Behavior of Complex Media Structure. Beijing: Beijing Institute of Technology Press, 2013.
[23] 尚静,张建国,崔燕,等. 含能配合物[Zn(DAT)6](ClO4)2(DAT=1,5-二氨基四唑)的合成、晶体结构及性质[J]. 化学学报, 2010, 68(3): 233-238. SHANG Jing, ZHANG Jian-guo, CUI Yan, et al. Synthesis, crystal structure, and properties of an energetic compound [Zn(1,5-diaminotetrazole)6](ClO4)2[J]. Acta Chimica Sinica, 2010, 68(3): 233-238.
[24] 赵卫星,姜红波,王宏社. 5-氨基四唑镍的合成及热分析研究[J]. 应用化工, 2011, 40(11): 1868-1870. ZHAO Wei-xing, JIANG Hong-bo, WANG Hong-she. Synthesis and thermal analysis of nickel(Ⅱ) complex of 5-aminotetrazole[J]. Applied Chemical Industry, 2011, 40(11): 1868-1870.
[25] 李坤. 两种5-硝基四唑类含能配合物的制备与表征[D]. 南京: 南京理工大学,2014: 35-38. LI Kun. The preparation and characterization of two kinds of energetic coordination compounds with 5-nitrotetrazole as ligand[D]. Nanjing: Nanjing University of Science & Technology, 2014: 35-38.
[26] 佘剑楠,徐抗震,张航,等. 1,4-二氢-5H-(二硝基亚甲基)-四唑(DNMT)的合成、晶体结构和热行为研究[J]. 化学学报, 2009, 67(23): 2645-2649. SHE Jian-nan, XU Kang-zhen, ZHANG Han, et al. Preparation, crystal structure and thermal behavior of 1,4-dihydro-5H-(dinitromethylidene)-tetrazole(DNMT)[J]. Acta Chimica Sinica, 2009, 67(23): 2645-2649.
[27] 毕福强,许强,樊学忠,等. 对叔丁基苯基五唑的合成及分解动力学[J]. 火炸药学报, 2012, 35(2): 15-18. BI Fu-qiang, XU Qiang, FAN Xue-zhong, et al. Synthesis and decomposition kinetics of p-tert-butylphenylpentazole[J]. Chinese Journal of Explosives & Propellants(Huozhayao Xuebao), 2012, 35(2): 15-18.
[28] Chand D, Parrish D A, Shreeve J M. Di(1H-tetrazol-5-yl)methanone oxime and 5,5′-(hydrazonomethylene)bis(1H-tetrazole) and their salts: a family of highly useful new tetrazoles and energetic materials[J]. Electronic Supplementary Material (ESI) for Journal of Materials Chemistry A, 2013(1):15383-15389.
[29] 张雪娇,李玉川,刘威,等. 三嗪类含能化合物的研究进展[J]. 含能材料, 2012, 20(4): 491-500 ZHANG Xue-jiao, LI Yu-chuan, LIU Wei, et al. Review on triazines energetic compounds[J]. Chinese Journal of Energetic Material, 2012, 20(4): 491-500.
[30] 李玉川,张雪娇,付耿,等. 4,4′,6,6′-四叠氮基偶氮-1,3,5-三嗪(TAAT)的合成、表征与热分解研究[J]. 有机化学, 2011, 31(9): 1484-1489. LI Yu-chuan, ZHANG Xue-jiao, FU Geng, et al. Synthesis, characterization and thermal decomposition mechanism of 4,4′,6,6′-tetra(azido)azo-1,3,5-triazine(TAAT)[J]. Chinese Journal of Organic Chemistry, 2011, 31(9): 1484-1489.
[31] 周诚,周彦水,霍欢,等. 2-硝亚氨基-5-硝基-六氢化-1,3,5-三嗪的合成及热分解行为[J]. 火炸药学报, 2012, 35(2): 32-35. ZHOU Cheng, ZHOU Yan-shui, HUO Huan, et al. Synthesis and thermal behavior for 2-nitrimino-5-nitrohexahydro-1,3,5-triazine[J]. Chinese Journal of Explosives & Propellants(Huozhayao Xuebao), 2012, 35(2): 32-35.
[32] YAN Qi-long, Tomas Musil, Svatopluk Zeman, et al. Preparation, morphologies and thermal behavior of high nitrogen compound 2-amino-4,6-diazido-s-triazine and its dertivatives[J]. Thermochimica Acta, 2015, 604: 106-114.
[33] LIU Wei, LIN Qiu-han, YANG Yu-zhang, et al. Energetic salts based on an oxygen-containing cation: 2,4-diamino-1,3,5-triazine-6-one[J]. Chemistry Asian Journal, 2013(1): 280-287.
[34] HUO Huan, WANG Bo-zhou, LUO Yi-fen, et al. Synthesis, characterization and thermal properties of energetic compound 3,6-dinitroguanidino-1,2,4,5-tetrazine (DNGTz) and its derivatives[J]. Journal of Solid Rocket Technology, 2013, 36(4): 500-505.
[35] 周诚,王伯周,王友兵,等. 3,6-二氨基-1,2,4,5-四嗪等百克量合成、晶体结构和热行为[J]. 火炸药学报, 2014, 37(2): 13-17. ZHOU Cheng, WANG Bo-zhou, WANG You-bing, et al. Hectogram quantity synthesis, crystal structure and thermal behavior of 3,6-diamino-1,2,4,5-tetrazine[J]. Chinese Journal of Explosives & Propellants(Huozhayao Xuebao), 2014, 37(2): 13-17.
[36] 张海昊,贾思媛,王伯周,等. 3,6-二肼基-1,2,4,5-四嗪及其含能盐的合成与性能[J]. 火炸药学报, 2014, 37(2): 23-30. ZHANG Hai-hao, JIA Si-yuan, WANG Bo-zhou, et al. Synthesis and properties of 3,6-dihydrazine-1,2,4,5-tetrazine and its energetic salts[J]. Chinese Journal of Explosives & Propellants(Huozhayao Xuebao), 2014, 37(2): 23-30.
[37] 王锡杰,姜俊,葛忠学,等. 3,6-二氯-1,2,4,5-四嗪的合成与表征[J]. 精细化工中间体, 2008, 38(4): 53-55. WANG Xi-jie, JIANG Jun, GE Zhong-xue, et al. Synthesis and characterization of 3,6-dicholo-1,2,4,5-tetrazine[J]. Fine Chemical Intermediates,2008, 38(4): 53-55.
[38] 金兴辉,胡炳成,刘祖亮,等. 3,6-二胍基-1,2,4,5-四嗪二硝基胍盐的合成及性能预估[J]. 火炸药学报, 2014, 37(2): 18-22. JIN Xing-hui, HU Bing-cheng, LIU Zu-liang, et al. Synthesis and property prediction of 3,6-diguanidine-1,2,4,5-tetrazine dinitroguanidinate salt[J]. Chinese Journal of Explosives & Propellants(Huozhayao Xuebao), 2014, 37(2): 18-22.
[39] ZHANG Jian-guo, YIN Xin, WU Jing-ting, et al. Two high-nitrogen energetic salts based on 3,6-dihydrazino-1,2,4,5-tetrazine[J]. Chinese Journal of Inorganic Chemistry, 2013, 29(12): 2587-2594.
[40] 薛金强,尚丙坤,王伟,等. 四嗪类该分子及离子含能化合物的研究进展[J]. 化学推进剂与高分子材料, 2011, 9(4): 1-7. XUE Jin-qiang, SHANG Bing-kun, WANG Wei, et al. Research situation and development trends of degradable polyurethane materials[J]. Chemical Propellants and Polymeric Materials, 2011, 9(4): 1-7.
[41] 熊鹰,舒远杰,周歌,等.均四嗪热分解机理的从头算分子动力学模拟及密度泛涵理论研究[J].含能材料, 2006, 14(6):421-424. XIONG Ying, SHU Yuan-jie, ZHOU Ge, et al. Thermal decomposition mechanism of s-Tetrazine by ab initio molecular dynamics and density functional theory[J]. Chinese Journal of Energetic Materials, 2006, 14(6):421-424.
[42] 张英豪,杜志明,韩志跃,等. 无氢富氮含能化合物的研究进展[J]. 含能材料, 2015, 23(5): 496-503. ZHANG Ying-hao, DU Zhi-ming, HAN Zhi-yue, et al. Review on nitrogen-rich compounds without hydrogen[J]. Chinese Journal of Energetic Material, 2015, 23(5): 496-503.
[43] 张兴高,朱慧,张玮,等. 呋咱类含能化合物及其在推进剂中等应用[J]. 化学推进剂与高分子材料, 2006, 4(3): 1-5. ZHANG Xing-gao, ZHU Hui, ZHANG Wei, et al. Furazan energetic compounds and its application in propellant[J]. Chemical Propellant and Polymer Material, 2006, 4(3): 1-5.
[44] 郑伟,王江宁. 呋咱化合物的热分解及其应用进展[J]. 化学推进剂与高分子材料, 2005, 4(1): 91. ZHENG Wei, WANG Ning. Thermal decomposition and application of furan compounds[J]. Chemical Propellant and Polymer Material, 2005, 4(1): 91.
[45] William G K, Brill T B. Thermal decomposition of energetic materials 72: unusual behavior of substituted furazan compounds upon flash pyrolysis[J].Combustion and Flame, 1998, 114:569-576.
[46] 付占达,王阳,陈甫雪. 新型异呋咱类含能材料NOG的热行为[J]. 含能材料, 2012, 20(5): 583-586. FU Zhan-da, WANG Yang, CHEN Fu-xue. Thermal behavior of 3-nitro-5-guanidino-1,2,4-oxadiazole[J]. Chinese Journal of Energetic Material, 2012, 20(5): 583-586.
[47] LI Hui, YU Qian-qian, ZHAO Feng-qi, et al. Crystal structure and thermal behavior of oxy-bridged bis(1H-tetrazol-5-yl)furazan[J]. Journal of Analytical and Applied Pyrolysis, 2014, 110: 333-337.
[48] Новиков. Synthesis and Structure of Foruxan Chemistry[M]. Moscow: Russian Science Press, 1981.
[49] Новиков. Reaction and Application of Foruxan Chemistry[M]. Moscow: Russian Science Press, 1983.
[50] 苗艳玲,张同来,乔小晶,等. 4,6-二硝基苯并氧化呋咱的制备、晶体结构及热分解机理[J]. 有机化学, 2004, 24(2): 205-209. MIAO Yan-ling, ZHANG Tong-lai, QIAO Xiao-jing, et al. Preparation crystal structure and thermal decomposition mechanism of 4,6-dinirobenzofuroxan[J]. Chinese Journal of Organic Chemistry, 2004, 24(2): 205-209.
[51] 王鹏,温玉全,金韶华,等. 苯并氧化呋咱化合物的热分解[J]. 含能材料, 2000, 8(1): 27-30. WANG Peng, WEN Yu-quan, JIN Shao-hua, et al. Thermal decomposition of benzofuroxan compounds[J]. Chinese Journal of Energetic Material, 2000, 8(1): 27-30.
[52] Royce W B, Thomas B B. Thermal decomposition of energetic materials 77: behavior of N-N bridged bifurazan compounds on slow and fast heating[J]. Propellants,Explosives,Pyrotechnics,2000, 25: 241-246.
[53] 张兴高,张炜,朱慧,等. 3,3′-二硝基-4,4′-氧化偶氮呋咱(DNOAF)的热分解特性[J]. 推进技术, 2007, 28(4): 445-448. ZHANG Xing-gao, ZHANG Wei, ZHU Hui, et al. Thermal decomposition of 3,3′-diamino-4,4′-azoxyfurazan (DNOAF)[J]. Journal of Propulsion Technology, 2007, 28(4): 445-448.
[54] 霍冀川,吴瑞荣,舒远杰,等. 氮杂环类含能材料热分解研究进展[J].爆破, 2007, 24(4):21-25. HUO Ji-chuan, WU Rui-rong, SHU Yuan-jie, et al. Investigative development of thermal decomposition of zaohetercycline energetic materials[J]. Blasting, 2007, 24(4):21-25.
[55] Sinditskii V P,Vu M C,Sheremetev A B, et al. Study on thermal decomposition and combustion of insensitivity explosive 3,3′-diamino-4-4′-azofurazan(DAAzF)[J]. Thermochimic Acta, 2008, 473: 25-31.
Progress of Study on Thermal Behaviors of Nitrogen-rich Compounds as Azole, Triazine and Furazan
HAN Zhi-yue, YANG Yue-zhen, DU Zhi-ming, ZHANG Ying-hao, YAO Qian
(State Key Laboratory of Explosion Science and Technology, Beijing Institute of Technology, Beijing 100081, China)
The progress of study on thermal behaviors of nitrogen-rich compounds as azole, triazine and furazan in recent years at home and abroad were summarized. The methods of thermal behavior research were analyzed and summarized. The influence law of compound structure and substituted groups on the thermal stability of the compound was obtained.The research results show that the thermal stability decreases in the order of furazan > triazine > azole; triazole > tetrazolium > pentazole; triazine > tetrazine, which is caused by the carbon content, skeleton tension and co-plane etc. Introducing nitro group, azo bond, cyano group and azide group etc. nitrogen-containing groups into nitrogen-rich compounds will reduce the thermal stability, which is caused by electronic absorption effect of substituted groups.The conjugation effects among nitrogen-rich rings can effectively enhance the thermal stability of the molecular compound.The combination of thermal analysis with theoretical calculation and gas phase chromatography to deduce the reaction mechanism is one of the direction of the future research,with 55 references.
high energy density material;nitrogen-rich compounds; thermal analysis; thermokinetics parameters;furazan compound;triazine compound;azole compound
10.14077/j.issn.1007-7812.2016.06.001
2015-12-24;
2016-07-29
北京理工大学基础研究基金(No. 20130242017); 爆炸科学与技术国家重点实验室重点课题(YBKT16-09)
韩志跃 (1984-),男,讲师,从事富氮化合物合成以及烟火技术研究。E-mail: hanzhiyue@bit.edu.cn
TJ55;O62
A
1007-7812(2016)06-0001-11
