植物乳杆菌的功能评价
2016-12-28王延斌
熊 强,王 凯,王延斌
(南京工业大学食品与轻工学院,江苏南京211800)
植物乳杆菌的功能评价
熊 强,王 凯,王延斌
(南京工业大学食品与轻工学院,江苏南京211800)
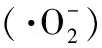
植物乳杆菌;胞外多糖;抗氧化
益生性乳酸菌可黏附到人体肠道上皮细胞、在黏膜表面定殖,并且能在人的胃肠道存活,调节胃肠道微生态平衡。它在人体中起着积极的作用,有降低胆固醇、抗氧化、提高免疫力、优化肠道微环境等生物学功能[1]。Liu等[2]研究发现,L.paracaseispp.paracaseiNTU 101和102 合成的多糖EPSs,对DPPH自由基(·DPPH)的清除能力与阳性对照品Vc相接近,且均表现出温和的脂质过氧化抑制作用和Fe2+螯合能力。乳酸菌产生胆盐水解酶,催化胃肠道中结合态胆盐水解为氨基酸残基和游离的胆酸[3],从而降低血清胆固醇。益生菌还可以通过同化吸收或细胞表面结合的方式降低胆固醇[4]。目前,国内对优良的益生性乳酸菌发酵剂的研发尚缺乏,因此乳酸菌益生性的研究有待深入,这将有助于提升乳酸菌发酵产品的品质,从而促进我国食品发酵行业的发展。
本文中,笔者对实验室筛选得到的乳酸菌株进行耐酸、耐胆盐和耐人工肠胃液试验,考察乳酸菌的环境耐受性;结合乳酸菌降胆固醇及其胞外多糖抗氧化试验,考察乳酸菌的益生性。最终筛选出具有环境耐受性的优良益生性乳酸菌,为乳酸菌发酵剂的开发提供优良菌种。
1 材料与方法
1.1 材料与设备
1.1.1 培养基
基础培养基(PYG)[5](1 L):葡萄糖10 g,蛋白胨5 g,胰酶解酪朊5 g,酵母提取物10 g,盐溶液40 mL,琼脂20 g,溴甲基酚紫0.04 g;pH 6.8。
乳酸细菌液体培养基(MRS)[5](1 L):胰蛋白胨5 g,酵母浸出粉5 g,柠檬酸铁铵2 g,乙酸钠5 g,Na2HPO42 g,MnSO4·H2O 0.05 g,MgSO4·7H2O 0.5 g,葡萄糖15 g,乳糖5 g,L-半胱氨酸盐酸盐0.5 g,吐温-80 1 mL;pH 6.7。
乳酸细菌降胆固醇培养基(MRS-CHOL-THIO)[6]:MRS液体培养基中加入已过滤除菌的质量分数0.20%的巯基乙酸钠、3 g/L胆盐和100 μg/mL胆固醇,加热溶解。
以上培养基在121 ℃条件下灭菌15 min。
1.1.2 主要仪器设备
752s型紫外可见分光光度计,上海棱光技术有限公司;SW-CJ-1FD型超净台,苏州安泰空气技术公司;KH3200型超声波破碎仪,昆山禾创超声仪器有限公司;GL-21M型立式高速冷冻离心机,盐城市凯特实验仪器有限公司;氮吹仪,上海济成分析仪器厂。
1.2 方法
1.2.1 植物乳杆菌的分离鉴定
从实验室自制泡菜中,按照初筛、复筛步骤分离纯化乳酸菌[5]。利用过氧化氢酶试验、H2S试验、糖发酵试验等生理生化试验及16S rDNA分子鉴定方法[5],对分离得到的菌株进行鉴定。
1.2.2 环境耐受性试验
1)耐酸性试验
利用乳酸细菌培养基(MRS),在37 ℃下活化两代。取2 mL活化好的菌液,分别接种至pH 3.0和pH 6.4的100 mL液体MRS培养基中,37 ℃下培养3 h后取样进行平板菌落计数。
2)耐胆盐试验
将活化好的菌株以2%接种量(体积分数)接至含30 g/L牛胆盐的MRS液体培养基中,37 ℃培养8 h。分别取0和8 h时的菌液进行平板菌落计数。
3)人工胃液和人工肠液耐受性试验
以2%接种量将活化好的菌株接种至无菌的pH 3.0的人工胃液[6]中,37 ℃培养,3 h后取样进行平板菌落计数。然后,取人工胃液中培养3 h后的菌液,以2%接种量接种至无菌的pH 8.0的人工肠液[6]中,37 ℃培养8 h后测定活菌数。
4)评价指标
以存活率作为环境耐受性试验的评价指标,存活率计算见式(1)。
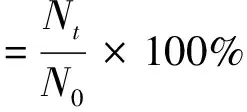
(1)
式中:N0、Nt分别为在上述试验条件下,0 h和th后测得的活菌数。
1.2.3 体外降胆固醇能力的测定
植物乳杆菌降胆固醇能力的测定参照文献[6]的方法,胆固醇标准曲线见图1。
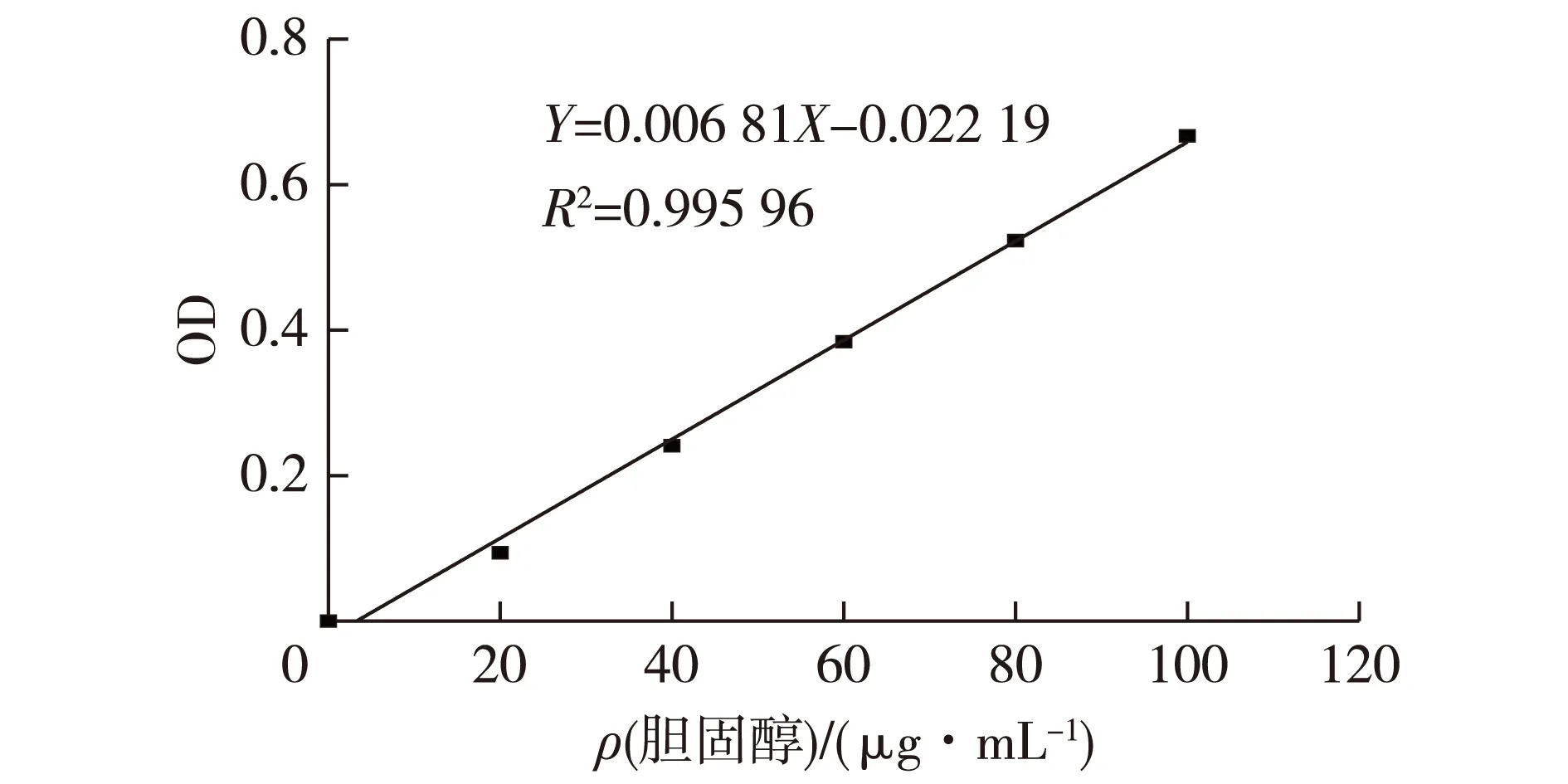
图1 胆固醇标准曲线Fig.1 The standard curve of cholesterol
1.2.4 植物乳杆菌胞外多糖的抗氧化能力测定
1)植物乳杆菌胞外多糖的分离纯化
粗多糖分离后[7],采用DEAE-Sepharose Fast Flow 离子柱和Sepharose CL-6B凝胶柱分步纯化,测定收集管中多糖,合并收集峰组分,经透析、浓缩、冷冻干燥得到多糖样品。
2)植物乳杆菌胞外多糖结构的初步鉴定
通过紫外分光光度法测蛋白核酸吸收[8],傅立叶红外光谱仪(FT-IR)分析多糖的结构[9],凝胶层析分析多糖的相对分子质量,HPLC分析多糖的单糖组成[10]。
3)·DPPH清除能力的测定
参照文献[11]的方法测定植物乳杆菌胞外多糖对·DPPH清除能力。
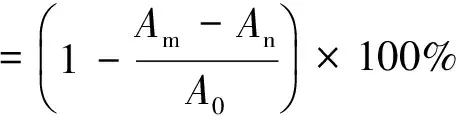
(2)
式中:A0为等体积甲醇代替·DPPH溶液的吸光值,作空白;An是等体积蒸馏水代替样品溶液后的吸光值,为对照组;Am为样品溶液与·DPPH甲醇溶液在室温下避光反应0.5 h后,517 nm处测的吸光值。
4)羟基自由基清除能力的测定
参照文献[12]的方法测定植物乳杆菌胞外多糖对羟基自由基清除能力。
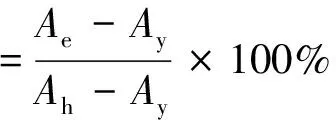
(3)
注:Ah为用1 mL蒸馏水代替1 mL H2O2后测得的吸光值;Ae为用样品代替1 mL蒸馏水后的结果;Ay为邻二氮菲溶液,FeSO4溶液和H2O2溶液,在37 ℃的水浴中,反应1.5 h后,在536 nm处测得的吸光度。
5)超氧阴离子自由基清除能力的测定
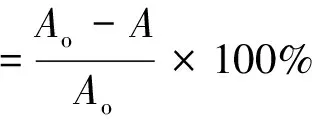
(4)
式中:A为在3 mL Tris-HCl缓冲液中加入适量样品,测样品的邻苯三酚自氧化速率,Ao为对照值。
1.2.5 数据分析
文中数据为3次平行测定值的平均值,数据以X±SD表示。显著性分析采用 SPSS 20.0(SPSS 公司)进行单因素方差分析(One-Way ANOVA,Student-Newman-Keuls)。
2 结果与讨论
2.1 乳酸菌鉴定结果
筛选得到的6株菌,它们都是革兰氏阳性菌(G+)、无芽孢杆菌,接触酶阴性、不产生H2S,结合糖发酵试验的结果初步鉴定为乳杆菌属[1]。对菌株Z22进行16S rDNA分析及系统发育树的建立,结果见图2和3。由图3可知,菌株Z22与植物乳杆菌相似度为99%。
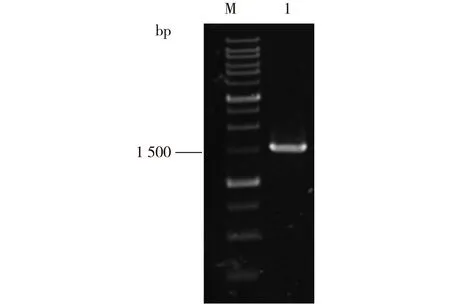
M—GeneRuler 1 kb DNA Ladder;1—菌株Z22的16S rDNA PCR结果图2 菌株Z22的16S rDNA基因扩增电泳Fig.2 Electrophoresis of PCR-amplified16S rDNA from Z22
2.2 耐酸及耐胃液试验结果
当进食时,通常人胃部的pH维持在3.0左右[13],食物在胃中停留时间较短,一般为1~3 h[14]。因此,选择在pH 3.0的条件下,检测供试菌株在酸性培养基和人工胃液培养3 h后的存活率,结果见图4。
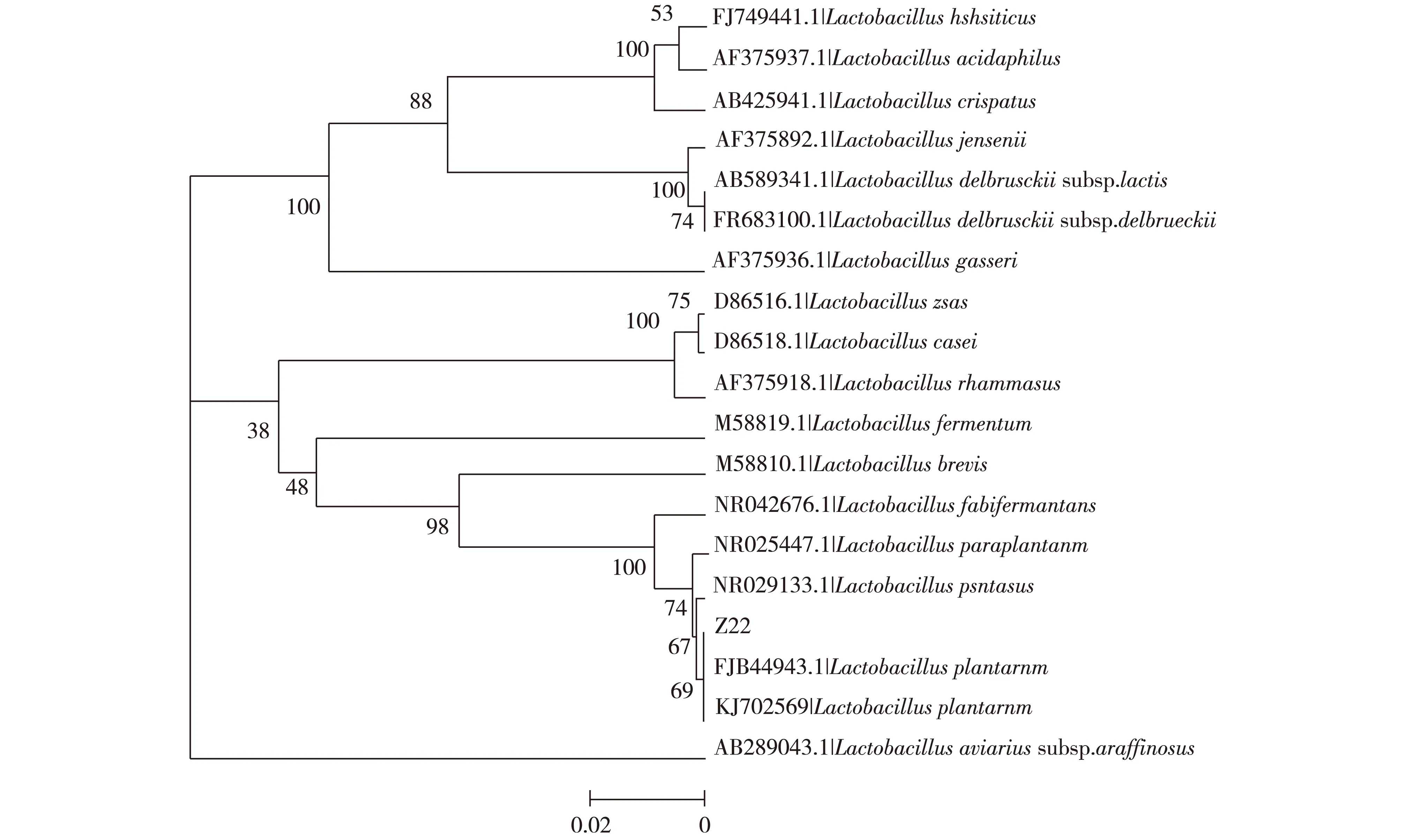
图3 基于16S rDNA建立的乳杆菌系统发育树Fig.3 Phylogenetic tree of Lactobacillus based on 16S rDNA gene sequence
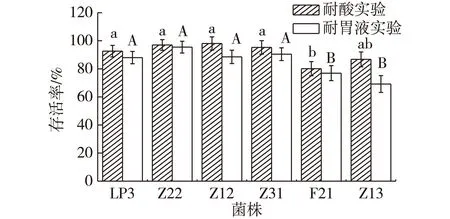
注:不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)图4 6株植物乳杆菌分别在pH3.0和人工胃液的条件下培养3 h后的存活率Fig.4 The survival rates of six strains L.plantarum in pH 3.0 and simulated gastric fluidafter three hours
由图4可知:6株植物乳杆菌在pH 3.0的条件下,培养3 h后,均有很高的存活率,表现出很好的耐酸性。其中,Z12存活率最高,达到98.08%;Z22次之,为96.75%;6株植物乳杆菌在人工胃液中培养3 h后,同样有较高的存活率,Z22最高,为95.45%;Z31次之,为90.42%,说明这几株菌都有较好的耐胃蛋白酶和耐酸的能力。
2.3 耐胆盐及耐肠液试验结果
食物在小肠中停留的时间为3~8 h[14],小肠内胆酸盐浓度通常低于4 g/L[15],一般维持在3 g/L。因此测定3 g/L胆盐的条件下,8 h后供试菌株的存活率,结果见图5。
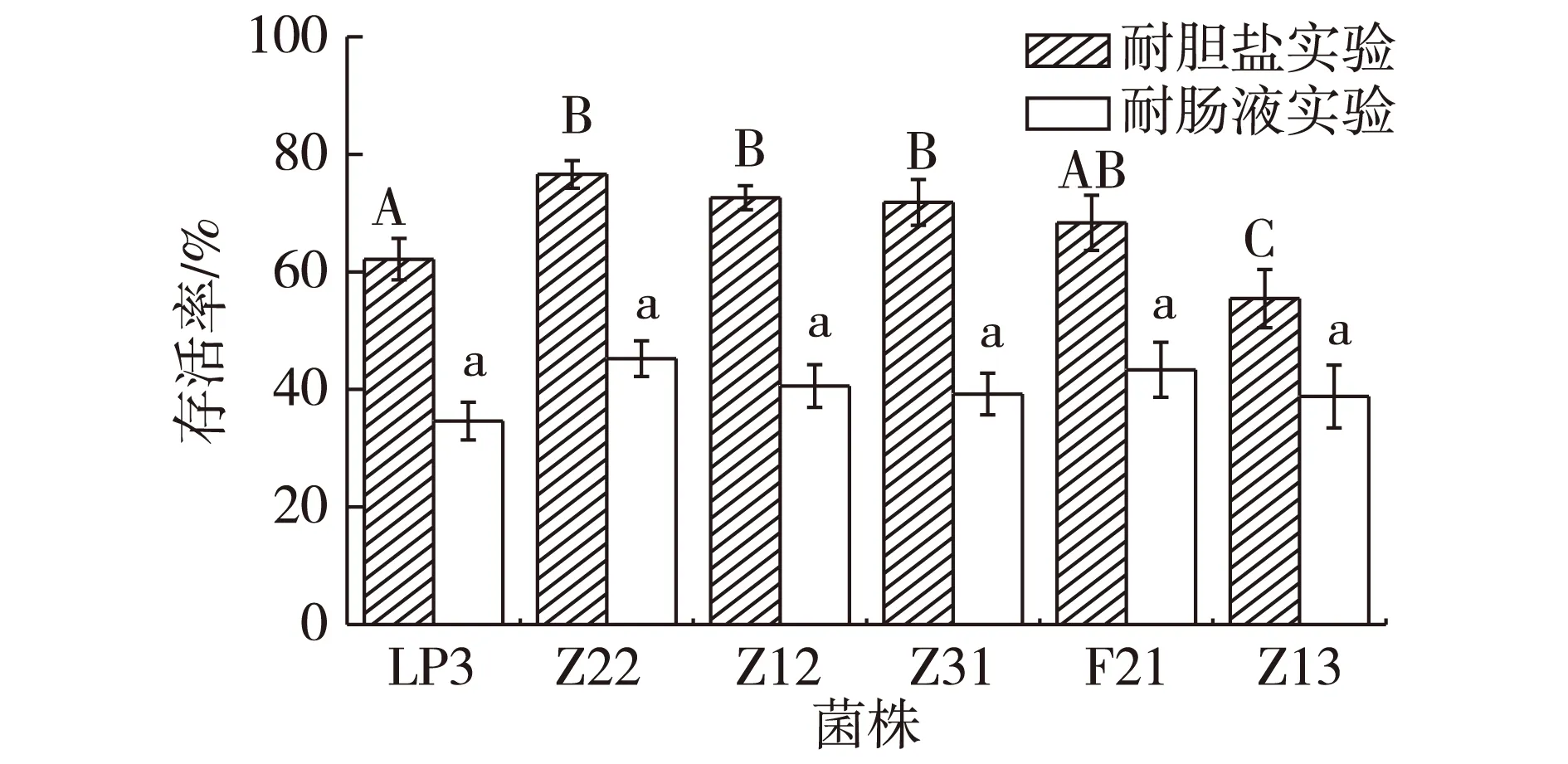
注:不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)图5 6株植物乳杆菌分别在3 g/L胆盐和人工肠液的条件下培养8 h后的存活率Fig.5 The survival of six strains L.plantarum in thecondition of 3 g/L bile salt and simulatedintestinal fluid
由图5可知:所有的供试菌株在3 g/L胆盐条件下维持8 h后,仍然保持较高的存活率,Z22存活率最高为76.59%;Z12次之,为72.63%。胃液培养4 h后的菌株在人工肠液中继续培养8 h后,存活率明显下降,Z22存活率最高,仅为45.24%;F21次之,为43.35%。这些结果表明植物乳杆菌对胆盐比较敏感,Hamon等[16]对LC56 的研究和Karasu等[17]关于LP3 的试验也说明了这一点。同时,胃液环境对植物乳杆菌生长不利,从而导致了6株菌在肠液中的存活率显著下降。尽管如此,Z22还是表现出了较好的耐胆盐和耐肠液的能力。
2.4 降胆固醇试验结果
考察6株菌的降胆固醇试验,结果如图6所示。由图6可知:6株供试菌株均有较好的胆固醇脱除能力,胆固醇脱除率均超过了40%,其中,Z22对胆固醇脱除率最高,达到65.80%;Z31次之,脱除率为55.95%。由于胆固醇的脱除率会随着胆酸盐浓度提高而增加[18-19],同时也与培养基中添加的胆固醇质量浓度成正比[20],因此在不同的条件下,试验结果也会不同。但总体而言,菌株Z22和Z31还是表现出较好的胆固醇去除能力。
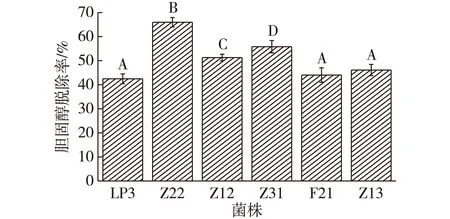
不同字母表示差异极显著(P<0.01)图6 6株植物乳杆菌胆固醇脱除率Fig.6 The cholesterol removal of six strains L. plantarum
2.5 植物乳杆菌胞外多糖结构的初步表征
综上可以发现,植物乳杆菌Z22表现出较好的性能,因此,选择菌株Z22进行胞外多糖的分离纯化。通过粗提取和层析柱分离纯化,得到不带电荷的中性多糖EPS-Z(平均相对分子质量为2.42×105)和带负电荷的酸性多糖EPS-S(平均相对分子质量为3.20×105)。利用色谱法研究两种多糖的单糖组成,结果见图7和图8。
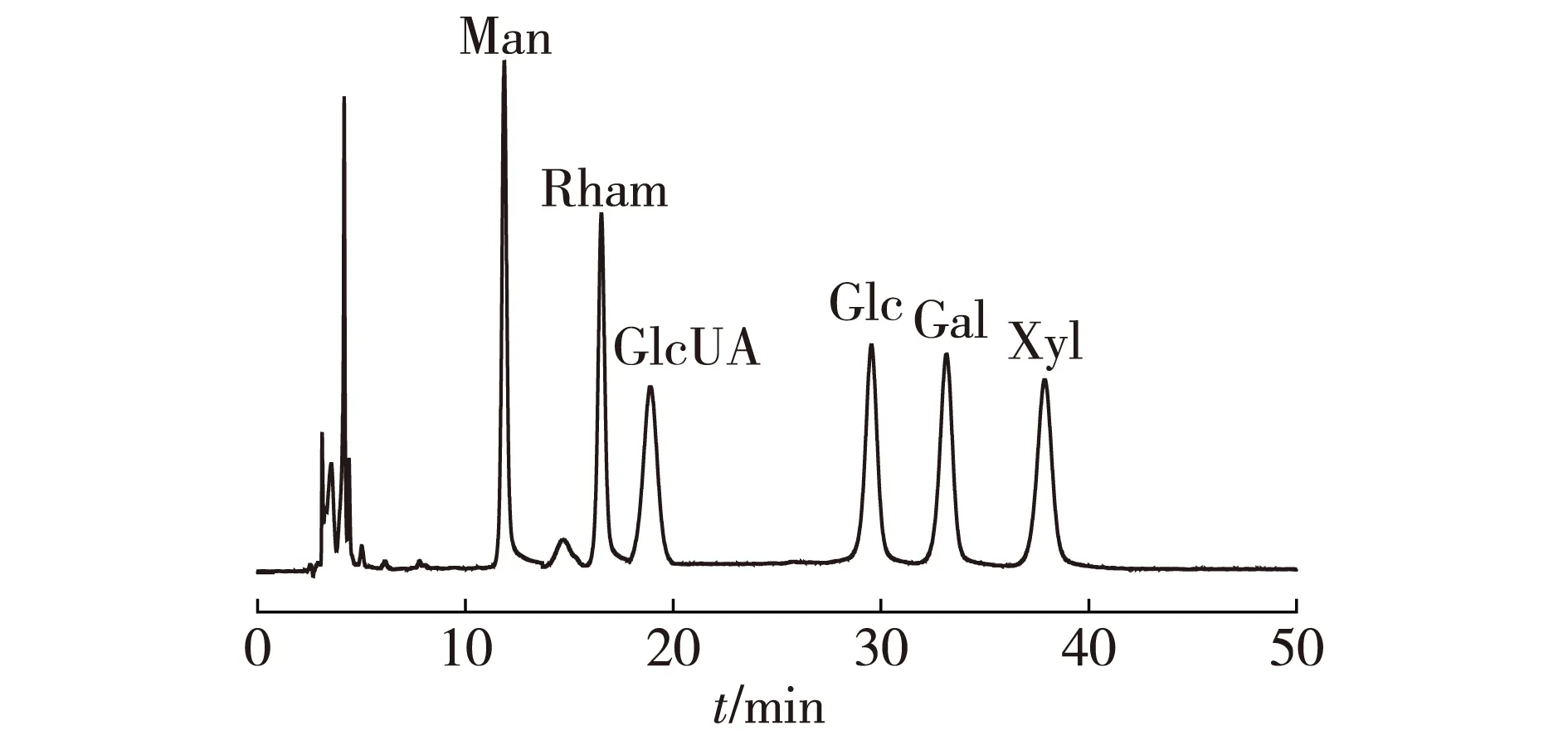
图7 6种单糖标准品的PMP衍生物的液相色谱Fig.7 HPLC chromatogram of PMP derivatives of the six kinds of monosaccharides
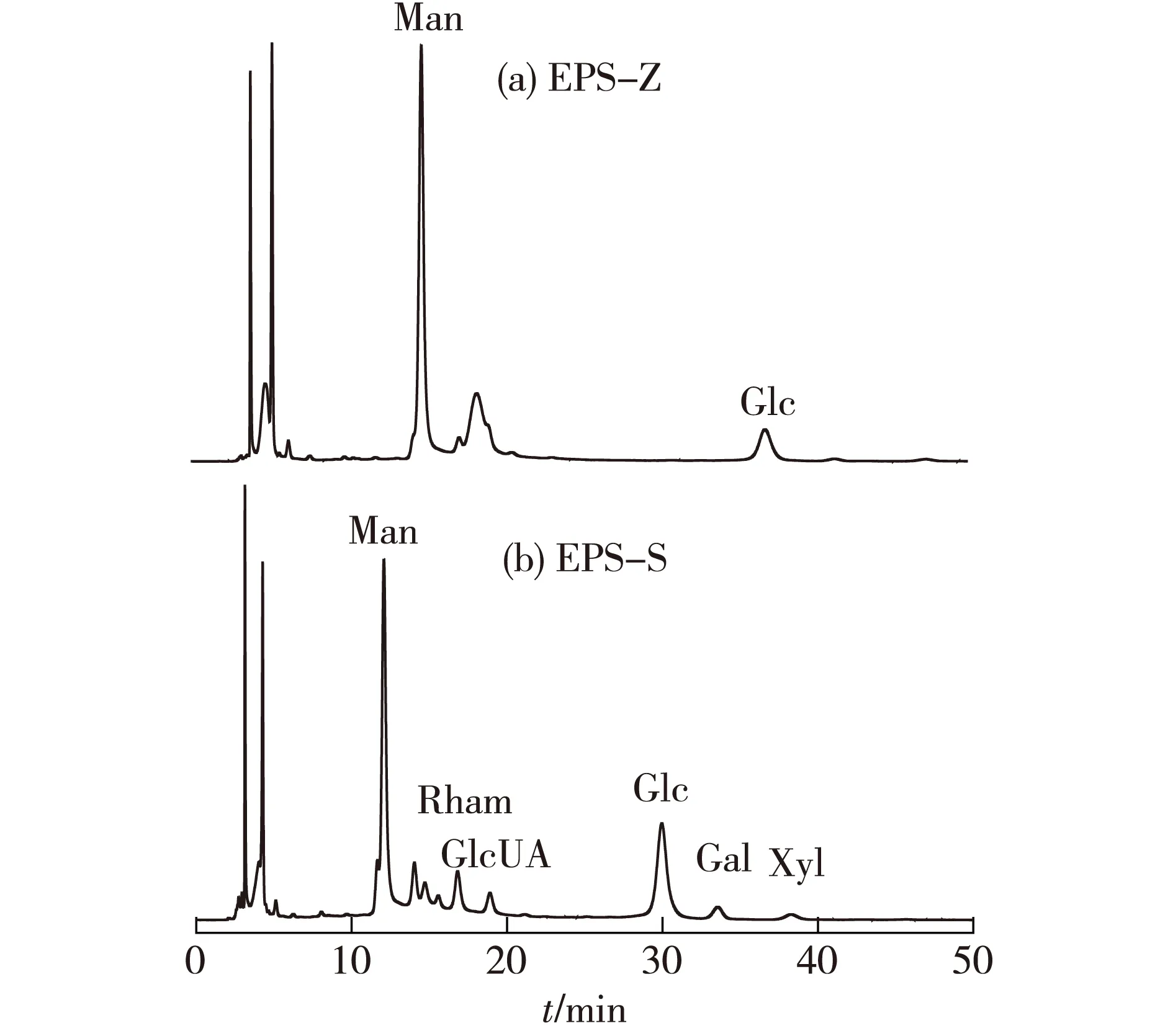
图8 EPS-Z(a)和EPS-S(b)的液相色谱Fig.8 HPLC chromatogram of EPS-Z(a)and EPS-S(b)
由图7和图8可知,EPS-Z含Man和Glc,其质量比为3.22∶ 1.00,没有检测到糖醛酸的存在;EPS-S由Man、Glc、Rham、Gal和Xyl组成,其质量比为8.57∶ 6.10∶ 2.42∶ 1.29∶ 1.00,其含GlcUA占单糖总和的7.29%,这正是酸性多糖带负电荷的原因。
利用紫外分析这两种胞外多糖,结果见图9。由图9可知:EPS-S和EPS-Z在260~280 nm之间没有吸收峰,表明多糖组成中不含核酸和蛋白。
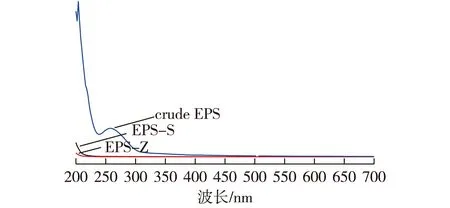
图9 EPS-Z和EPS-S紫外分析谱Fig.9 UV analysis spectra of EPS-Z and EPS-S
利用傅里叶变换红外光谱(FT-IR)来分析这两种多糖,结果见图10。由图10可以发现:EPS-Z和EPS-S均为β-型吡喃糖,具有多糖特征吸收峰,具有—OH、—O—、—COO—等官能团。
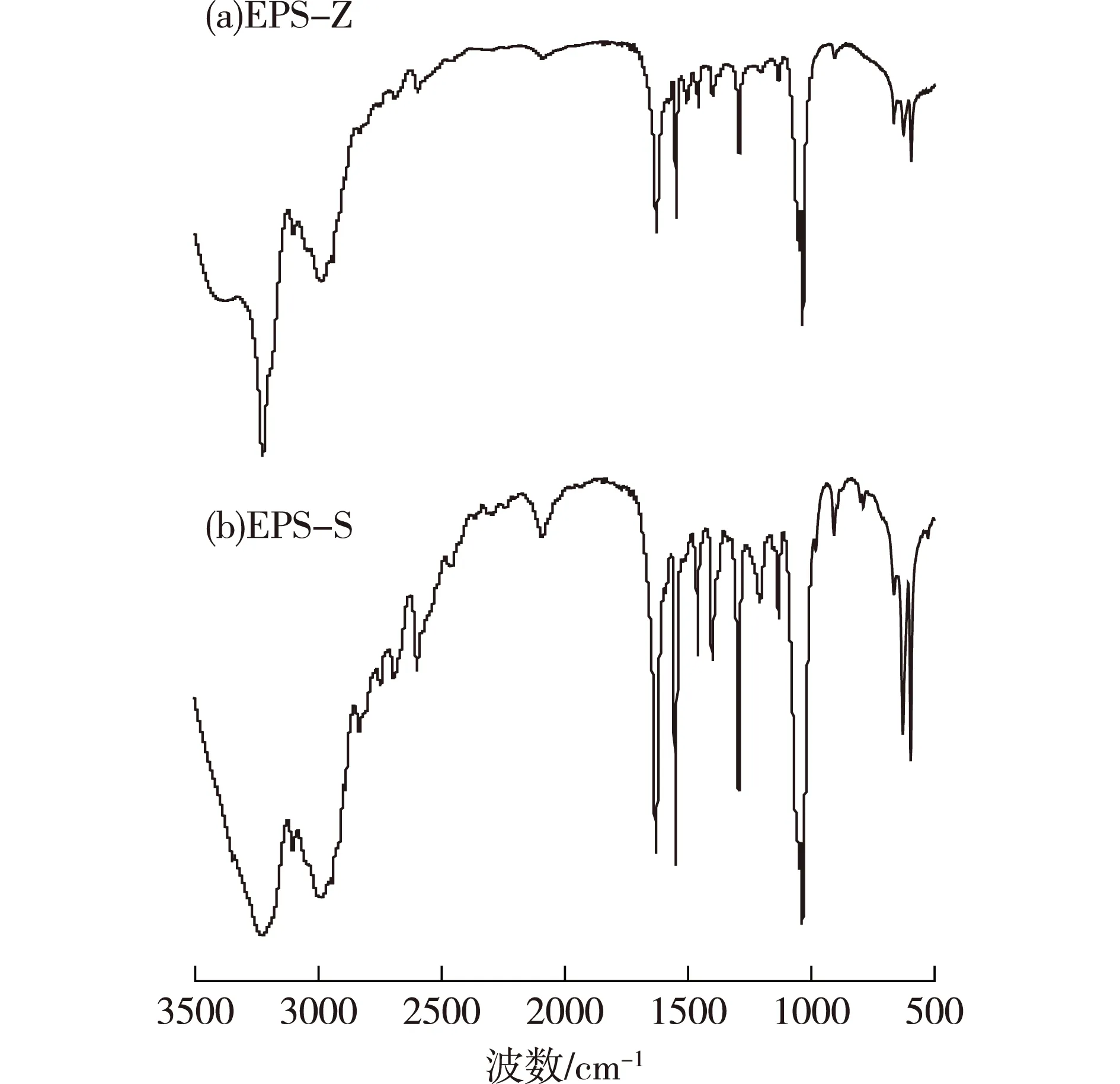
图10 植物乳杆菌Z22胞外多糖 EPS-Z和EPS-S红外光谱图Fig.10 FT-IR spectra of the extracellular polysaccharideEPS-Z and EPS-S from L. plantarum Z22
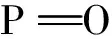
2.6 植物乳杆菌多糖胞外抗氧化能力的测定
分别考察植物乳杆菌Z22 EPS-Z和EPS-S对·DPPH、·OH、·O2-基的清除能力,结果见图11~13。
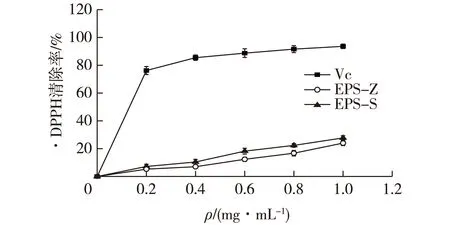
图11 植物乳杆菌Z22胞外多糖对·DPPH的清除能力Fig.11 Scavenging activity of extracellular polysaccharideL. plantarum Z22 on DPPH radical
由图11可知:以Vc做阳性对照,植物乳杆菌Z22的胞外酸性多糖EPS-S和中性多糖EPS-Z对·DPPH的清除能力随着多糖浓度的增加而增强,在1 mg/mL时,分别达到27.75%和24.02%。酸性多糖EPS-S的清除效果总体要优于EPS-Z,可能是酸性多糖含有糖醛酸,提升了其对·DPPH的清除能力。在多糖中含有的糖醛酸,为其提供大量的负电荷,这些带负电荷的多糖分子,由于内部的排斥使其结构更加伸展,从而降低了自由基攻击分子时的空间位阻[21],加速自由基的猝灭反应,从而提升多糖的抗氧化活性。
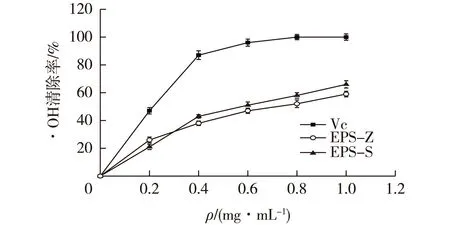
图12 植物乳杆菌Z22胞外多糖对·OH清除能力Fig.12 Scavenging activity of extracellular polysaccharide of L.plantarum Z22 on hydroxyl radical
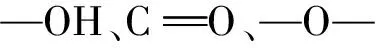
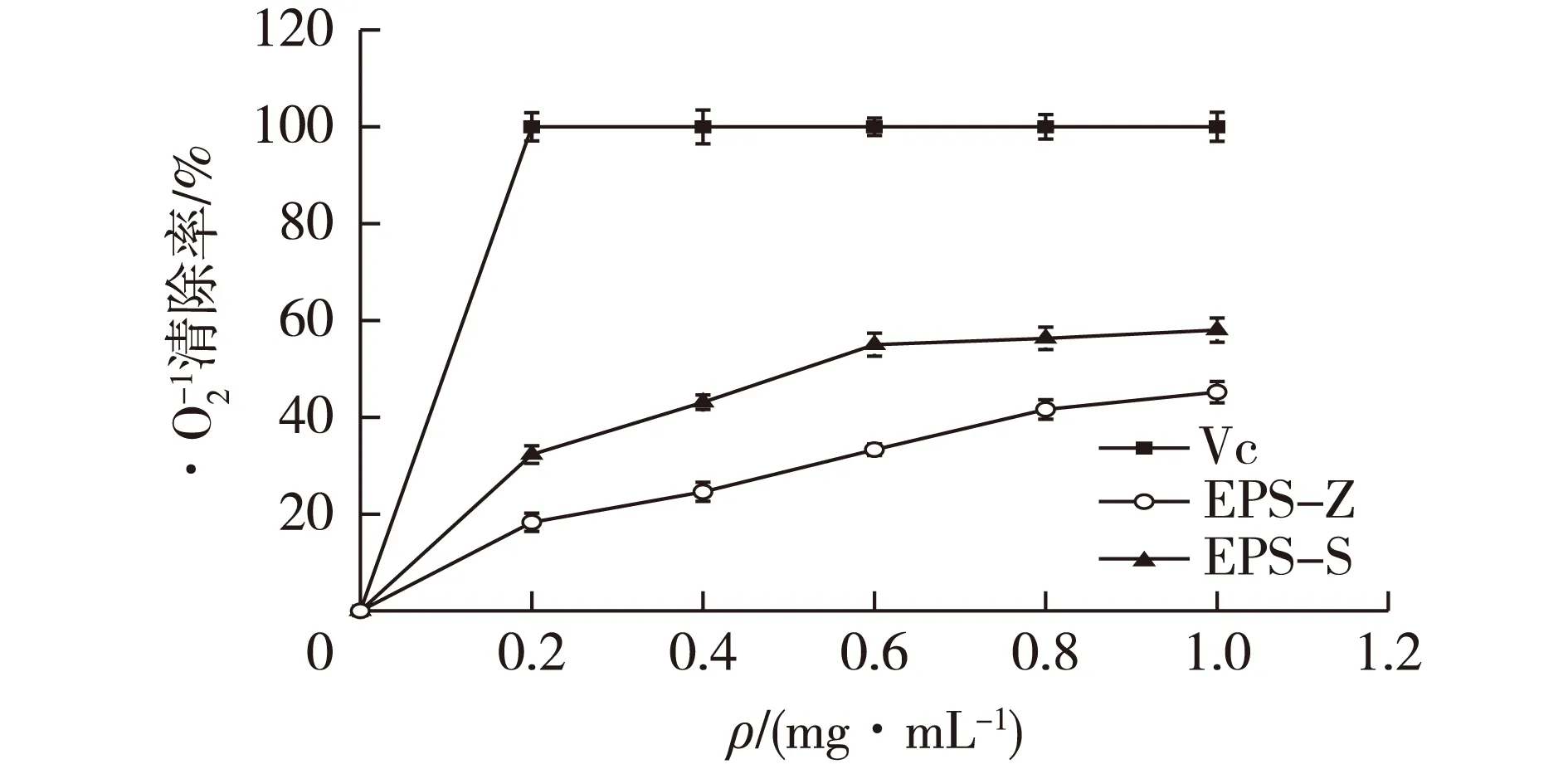
图13 植物乳杆菌Z22胞外多糖对清除能力Fig.13 Scavenging activity of extracellular polysaccharideL. plantarum Z22 on superoxide radical
2.7 功能性评价分析
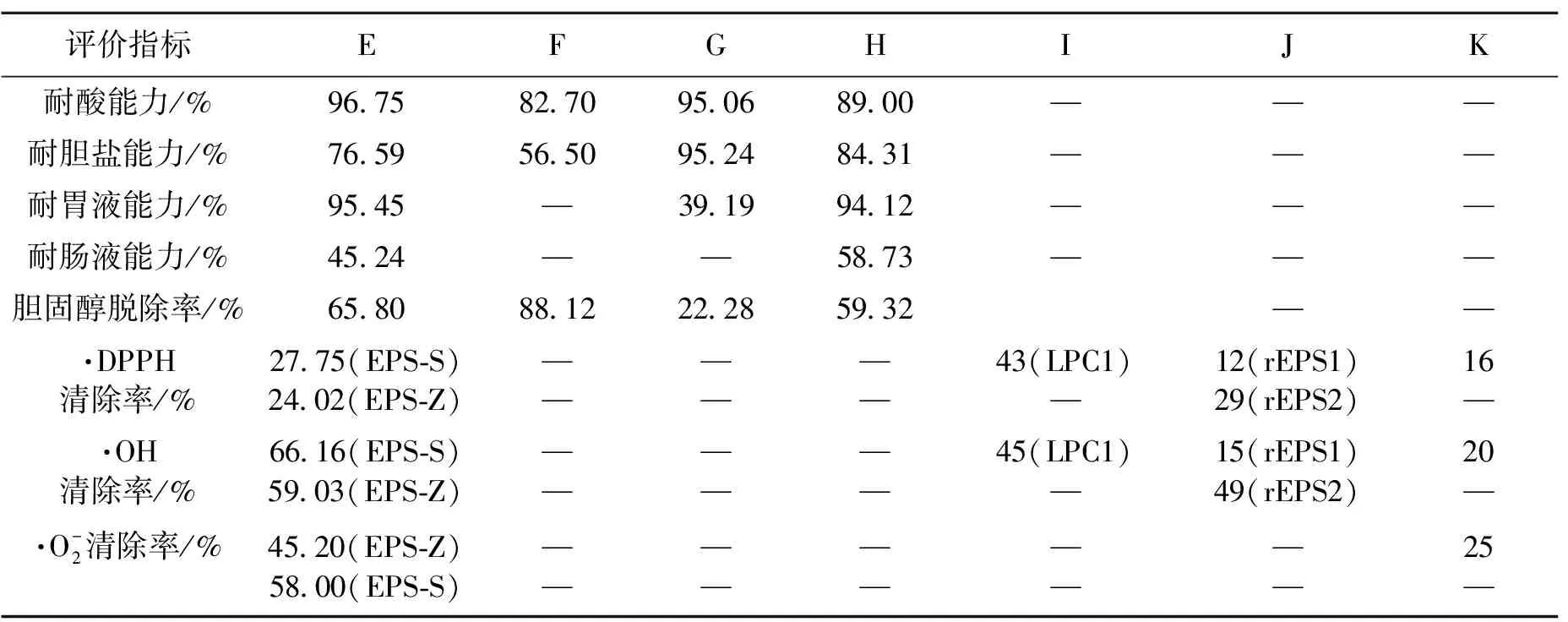
表1 植物乳杆菌功能性评价结果Table 1 Results of gastrointestinal survival and benificial properties of L.plantarum
注:“—”表示文献中无记录;E~K分别代表L.plantarumZ22、L.plantarumEM[24]、L.plantarumS4-1[25]、L.plantarumNDC 7501[2]、L.plantarumC88[26]、L.plantarum70810[27]和L.plantarumYW32[28]。
3 结论
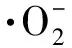
[1] KANG K O,KU K H,LEE H J,et al.Effect of enzyme and inorganic salts addition and heat treatment on kimchi fermentation[J].Kor J Food Sci Technol,1991,23(2):183-187.
[2] LIU C F,TSENG K C,CHIANG S S,et al.Immunomodulatory and antioxidant potential ofLactobacillusexopolysaccharides[J].J Sci Food Agric,2011,91(12):2284-2291.
[3] SMET I D,HOORDE L V,SAEYER N D,et al.In vitro study of bile salt hydrolase (BSH) activity of BSH isogenicLactobacillusplantarum80 strains and estimation of cholesterol lowering through enhanced BSH activity[J].Microb Ecol Health Dis,1994,7(6):315-329.
[4] LIONG M T,SHAH N P.Optimization of cholesterol removal,growth and fermentation patterns ofLactobacillusacidophilusATCC 4962 in the presence of mannitol,fructo-oligosaccharide and inulin:a response surface methodology approach[J].J Appl Microbiol,2005,98(5):1115-1126.
[5] 凌代文.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999.
[6] 王今雨,满朝新,杨相宜,等.植物乳杆菌NDC 75017的降胆固醇作用[J].食品科学,2013,34(3):243-247.
[7] AI L,ZHANG H,GUO B,et al.Preparation,partial characterization and bioactivity of exopolysaccharides fromLactobacilluscaseiLC2W[J].Carbohydr Polym,2008,74(3):353-357.
[8] 丁益,华子春.生物化学分析技术实验教程[M].北京:科学出版社,2015.
[9] YAN W,CUI S W,JIAN T,et al.Preparation,partial characterization and bioactivity of water-soluble polysaccharides from boat-fruited sterculia seeds[J].Carbohydr Polym,2007,70(4):437-443.
[10] 徐瑾,李彤,张庆合,等.柱前衍生化高效液相色谱等度洗脱分析单糖的方法建立[J].生命科学仪器,2005,3(2):30-32.
[11] WU H C,CHEN H M,SHIAU C Y.Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel (Scomberaustriasicus)[J].Food Res Int,2003,36(9/10):949-957.
[12] JIN M,CAI Yaxin,LI J,et al.1,10-Phenanthroline-Fe2+oxidative assay of hydroxyl radical produced by H2O2/Fe2+[J].Progr Biochem Biophys,1996,23(6):553-555.
[13] PEREIRA D I A,GIBSON G R.Cholesterol assimilation by lactic acid bacteria and bifidobacteria isolated from the human gut[J].Appl Environ Microbiol,2002,68(9):4689-4693.
[14] 姜叙诚,袁耀宗,徐家裕,等.消化系统[M].上海:上海交通大学出版社,2010:57-59.
[15] USMAN,HOSONO A.Bile tolerance,taurocholate deconjugation,and binding of cholesterol byLactobacillusgasseristrains[J].J Dairy Sci,1999,82(2):243-248.
[16] HAMON E,HORVATOVICH P,IZQUIEDO E,et al.Comparative proteomic analysis ofLactobacillusplantarumfor the identification of key proteins in bile tolerance[J].BMC Microbiol,2011,11:63.
[18] PEREIRA D I A,McCARTNEY A L,GIBSON G R.An in vitro study of the probiotic potential of a bile-salt hydrolyzingLactobacillusfermentumstrain,and determination of its cholesterol lowering properties[J].Appl Environ Microbiol,2003,69:4743-4752.
[19] TAHRI K,GRILL J P,SCHNEIDER F.Involvement of trihydroxyconjugated bile salts in cholesterol assimilation by bifidobacteria[J].Curr Microbiol,1997,34(2):79-84.
[20] 李常营,卢晓霆,于志会,等.酸菜来源植物乳杆菌S4-5的降胆固醇作用[J].食品科学,2011(7):69-72.
[21] DUH P D,TU Y Y,YEN G C.Antioxidant activity of water extract of Harng Jyur (ChrysanthemummorifoliumRamat)[J].LWT-Food Sci Technol,1999,32(5):269-277.
[22] YUAN H,ZHANG W,LI X,et al.Preparation and in vitro antioxidant activity ofκ-carrageenan oligosaccharides and their oversulfated,acetylated,and phosphorylated derivatives[J].Carbohydr Res,2005,340(4):685-692.
[23] LIU C H,WANG C H,XU Z L,et al.Isolation,chemical characterization and antioxidant activities of two polysaccharides from the gel and the skin ofAloebarbadensisMiller irrigated with sea water[J].Process Biochem,2007,42(6):961-970.
[24] CHOI E A,CHANG H C.Cholesterol-lowering effects of a putative probiotic strainLactobacillusplantarumEM isolated from kimchi[J].LWT-Food Sci Technol,2015,62:210-217.
[25] YU Z,ZHANG X,LI S,et al.Evaluation of probiotic properties ofLactobacillusplantarumstrains isolated from Chinese sauerkraut[J].World J Microbiol Biotechnol,2013,29(3):489-498.
[26] LI Z,LIU C,DA L,et al.Antioxidant activity of an exopolysaccharide isolated fromLactobacillusplantarumC88[J].Int J Biol Macromol,2013,54(1):270-275.
[27] WANG K,WEI L,XIN R,et al.Structural characterization and bioactivity of released exopolysaccharides fromLactobacillusplantarum,70810[J].Int J Biol Macromol,2014,67(6):71-78.
[28] JI W,XIAO Z,YANG Y,et al.Characterization and bioactivities of an exopolysaccharide produced byLactobacillusplantarumYW32[J].Int J Biol Macromol,2015,74:119-126.
(责任编辑 荀志金)
Gastrointestinal survival and beneficial properties in vitro of Lactobacillus plantarum strains
XIONG Qiang,WANG Kai,WANG Yanbin
(College of Food Science and Light Industry,Nanjing Tech University,Nanjing 211800,China)
Lactobacillusplantarum; extracellular polysaccharide;antioxidant activity
10.3969/j.issn.1672-3678.2016.06.009
2016-05-16
江苏省重点研发项目(BE2015305)
熊 强(1970—),男,江苏南京人,副教授,研究方向:微生物与发酵工程,E-mail:xiongqiang@njtech.edu.cn
TS252.1
A
1672-3678(2016)06-0046-08
