实时荧光PCR法检测肉制品中鸡、鸭源性成分
2016-12-28岳苑
岳 苑
(宁夏回族自治区食品检测中心,宁夏银川750001)
实时荧光PCR法检测肉制品中鸡、鸭源性成分
岳 苑
(宁夏回族自治区食品检测中心,宁夏银川750001)
根据鸡、鸭线粒体DNA(mtDNA)序列设计了鸡、鸭特异性引物及Taqman探针,建立了肉制品中鸡、鸭源性成分的实时荧光聚合酶链式(real-time PCR)检测方法。结果发现:利用此方法,两种动物源性的最低检出限值(质量分数)分别为0.01%和0.001%。实时荧光PCR法能够作为肉制品中检测鸡、鸭源性成分的有效方法。
实时荧光PCR;鸡源性;鸭源性;肉制品
宁夏因为得天独厚的地理位置,为种养殖业提供了独一无二的优质气候、饲料及水源,使得宁夏的牛羊肉具有肉质细腻、营养丰富和口感鲜美的特点,已成为宁夏的特色优势产品。随着中阿论坛会址永久落户宁夏,为宁夏的牛羊肉制品享誉全国、走向世界创造了无与伦比的条件,牛羊肉产业已逐渐成为宁夏着力培育、发展的六大战略性支柱产业之一。
近几年,一些商贩为谋求高额利润,将劣质鸭肉掺入牛羊肉制品中销售,扰乱了牛羊肉制品销售市场的秩序,损害了宁夏牛羊肉品牌的声誉,同时也带来了食品安全隐患问题。但由于没有针对性强的检验方法标准,因此无法解决这一问题,导致其掺假现象不能得到有效遏制。
目前,以PCR技术为基础的种属检测技术已是食品中肉类成分鉴别的主流技术[1]。国外学者报道了猪、牛、羊、鸡、火鸡、野鸭、鹅、马和驴源性成分的常规PCR[2-5]和荧光定量PCR[6-12]的检测方法。国内已有关于猪[12]、牛[13]、羊[13-15]、兔[16]、马[15-16]、驴[16]和鱼[17]动物源性成分分析的报道,但用实时荧光PCR技术检测鸡、鸭源性成分的方法还不多见。本试验根据GenBank中鸡和鸭线粒体DNA设计特异性引物和Taqman探针,以期建立肉制品中鸡、鸭源性成分的荧光PCR检测方法,为杜绝食品行业中的肉制品掺假行为提供快速、准确的方法。
1 材料与方法
1.1 肉制品
猪肉、牛肉、羊肉、鱼肉、鸡肉、鸭肉、鹅肉、驴肉、马肉、狗肉等动物生肉为银川市售产品。
1.2 试剂和仪器
动物源性基因组DNA提取试剂盒和Premix Ex TaqTM,TaKaRa公司;实时荧光定量PCR仪,Eppendorf公司;核酸分析仪,Thermo公司;高速冷冻离心机,Hitachi公司。
1.3 模板制备
采用TaKaRa公司基因组DNA提取试剂盒,按照说明书提取各物种基因组DNA作为模板或阴性对照,无菌超纯水作为空白对照。称10 mg左右样品加入DNA提取试剂盒中,充分剪碎,70~100 ℃加热10 min。在4 ℃、12 000 r/min条件下离心10 min后,吸上清液100 μL于新的离心管中备用。
1.4 引物、探针设计与合成
选择鸡、鸭线粒体DNA设计鸡和鸭的特异性引物和TaqMan探针,扩增片段分别为111和90 bp,引物序列见表1。引物和探针均由TaKaRa公司合成。
1.5 实时荧光PCR检测
荧光PCR反应体系为25 μL,各组分含量分别为PCR Mix10.0 μL,10 μmol/L引物各0.5 μL,5 μmol/L探针1 μL,模板DNA(50~100 ng)1 μL,无菌超纯水将体系补充至25 μL,混匀后离心。鸡、鸭源性成分扩增条件为95 ℃预变性30 s,然后95 ℃变性5 s、60 ℃延伸30 s,进行40个循环。
1.6 特异性试验
取市场购买的猪肉、牛肉、羊肉和鱼肉等10种肉作为模板加入反应体系中进行扩增。

表1 PCR引物、TaqMan探针序列Table 1 Sequences of PCR primers and TaqMan probes
1.7 重复性与稳定性试验
用鸡肉和鸭肉提取的DNA为模板,按照前述的反应体系与反应条件分别进行PCR扩增,同一模板重复15次,研究所建立体系的稳定性。
1.8 灵敏度试验
将鸡肉、鸭肉和羊肉切成薄片分别置于90 ℃的烘箱中烘烤24 h,然后将各材料分别研磨成细粉。向羊肉粉中分别加入鸡肉粉和鸭肉粉,使其质量分数达到0.01%、0.1%和1%,充分混匀,模拟真实的羊肉掺假情况。提取以上DNA作为模版,进行PCR反应。确定检出限含量后重复8次试验来确定检出限是否稳定。
2 结果与讨论
2.1 鸡、鸭源性成分特异性试验
用设计的鸡、鸭源性引物和TaqMan探针分别对所提取的鸡、鸭DNA进行PCR扩增,部分结果如图1所示。由图1可知:提取的鸡、鸭DNA扩增后均能得到典型的扩增曲线,而猪、牛、羊和鱼等9种DNA样品未呈现S型扩增曲线,说明本方法设计的鸡、鸭源性引物和TaqMan探针具有良好的特异性。
2.2 PCR重复性试验结果
用提取的鸡肉、鸭肉DNA为模板进行实时荧光PCR反应,同一模板重复15次,考察鸡、鸭源性成分Ct值(每个反应管的荧光信号达到设定的阈值时所经历的循环数),结果见表2。由表2可知:鸡、鸭源性成分Ct值的平均值分别为16.54、16.16,标准偏差为0.19、0.25,变异系数为1.15%、1.55%,这说明本方法所建立的体系较为稳定。
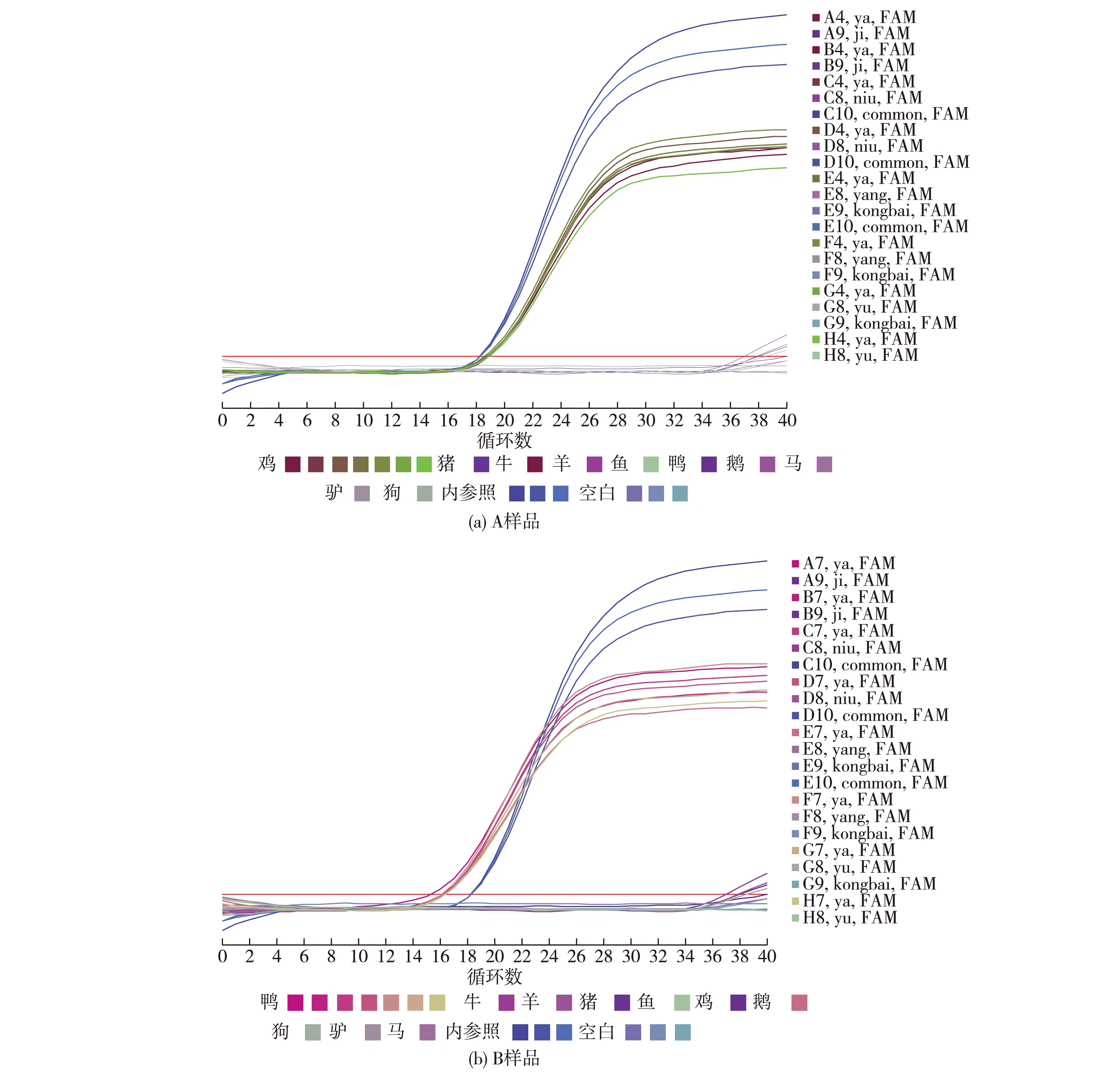
图1 鸡、鸭源性成分实时荧光PCR特异性试验Fig.1 Real-time PCR specificity test of chicken and duck ingredients表2 鸡、鸭源性成分实时荧光PCR方法重复试验结果Table 2 Real-time PCR repeat test results of chicken and duck ingredients

动物源性Ct123456789101112131415平均值(Ct)标准偏差变异系数/%鸡1686165816811659166163164116691661649162316221646166016631654019115鸭160316091596156516116151666161716171632164116121639163815871616025155
2.3 PCR反应灵敏度试验结果
向制备好的羊肉粉中分别混入不同含量的鸡肉粉和鸭肉粉,提取DNA作为模板进行PCR扩增,结果分别见图2和图3。由图2和图3可知:当鸡肉粉稀释至质量分数为0.01%、鸭肉粉稀释至质量分数为0.001%时,能够呈现S型扩增曲线,扩增结果Ct值均<35.0,平均值分别为30.74和34.43,说明本试验可以检测最低含量为0.01%的单一鸡源性成分和含量0.001%的单一鸭源性成分。在确定检出限含量后,重复试验8次,结果见表3。由表3可知,本方法检出限结果稳定。
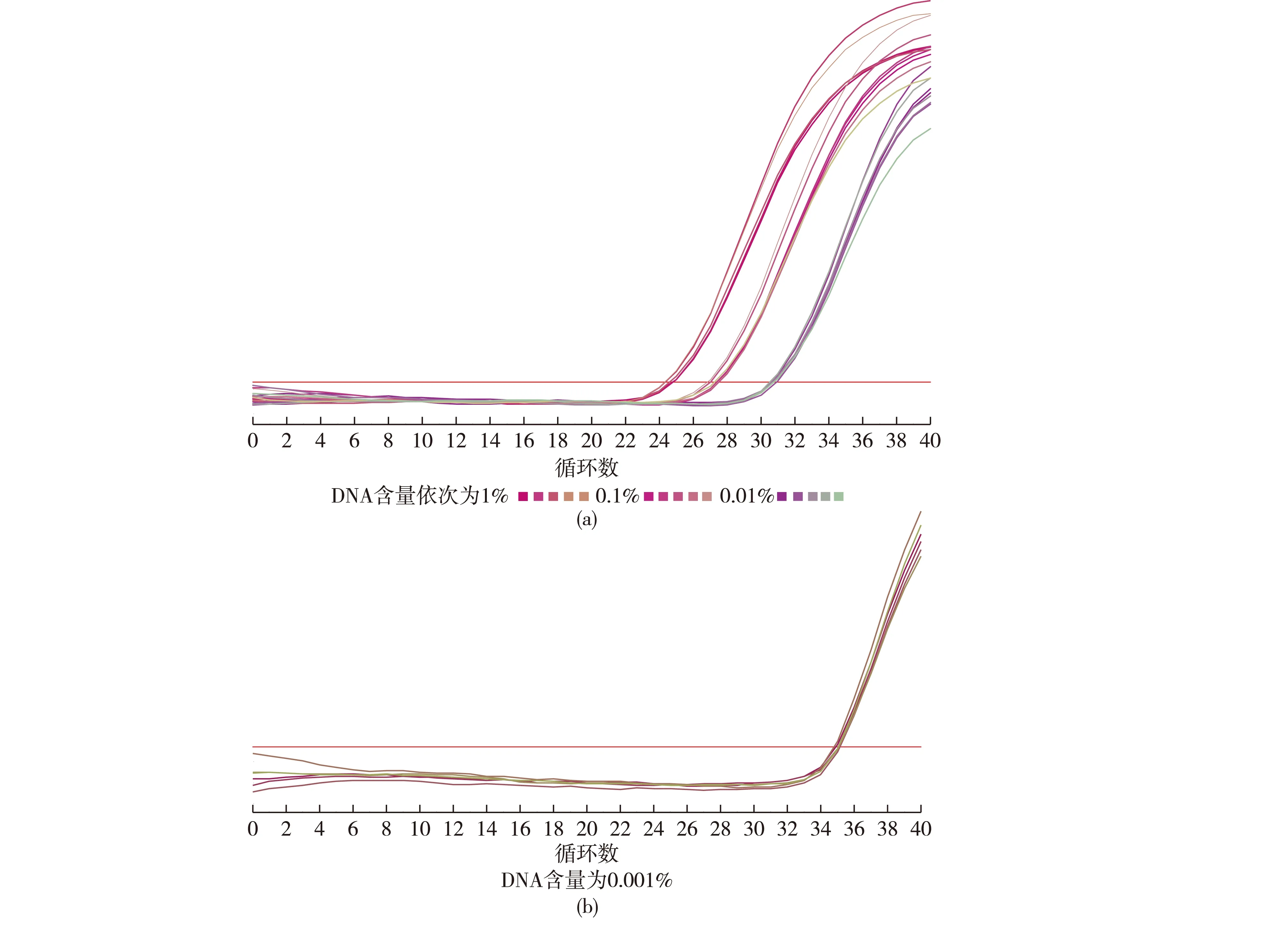
图2 鸡源性成分灵敏度试验Fig.2 Sensitivity test of chicken ingredient
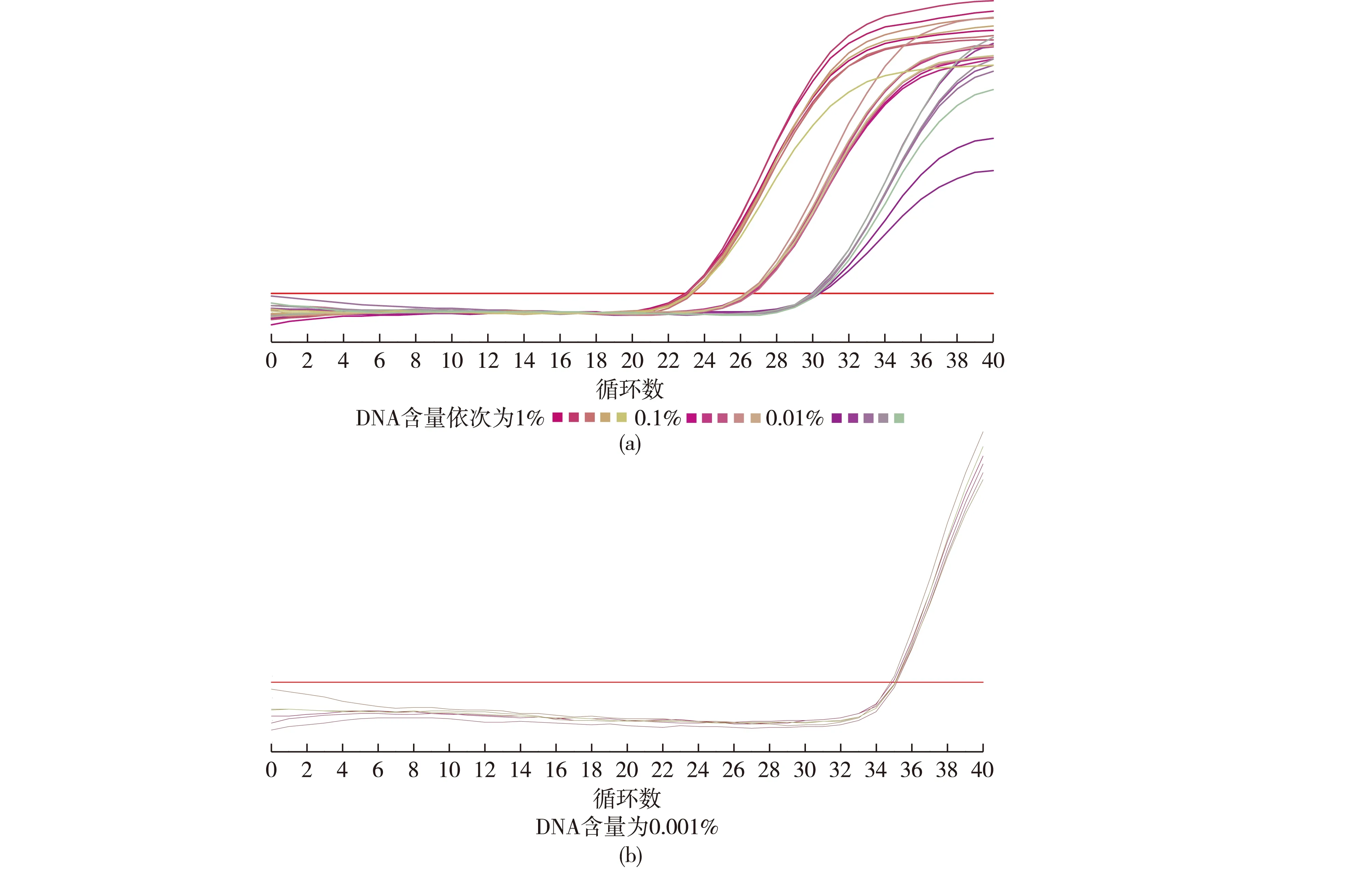
图3 鸭源性成分灵敏度试验结果Fig.3 Sensitivity test of duck ingredient表3 鸡、鸭源性成分灵敏度重复试验结果Table 3 Sensitivity test results of chicken and duck ingredients
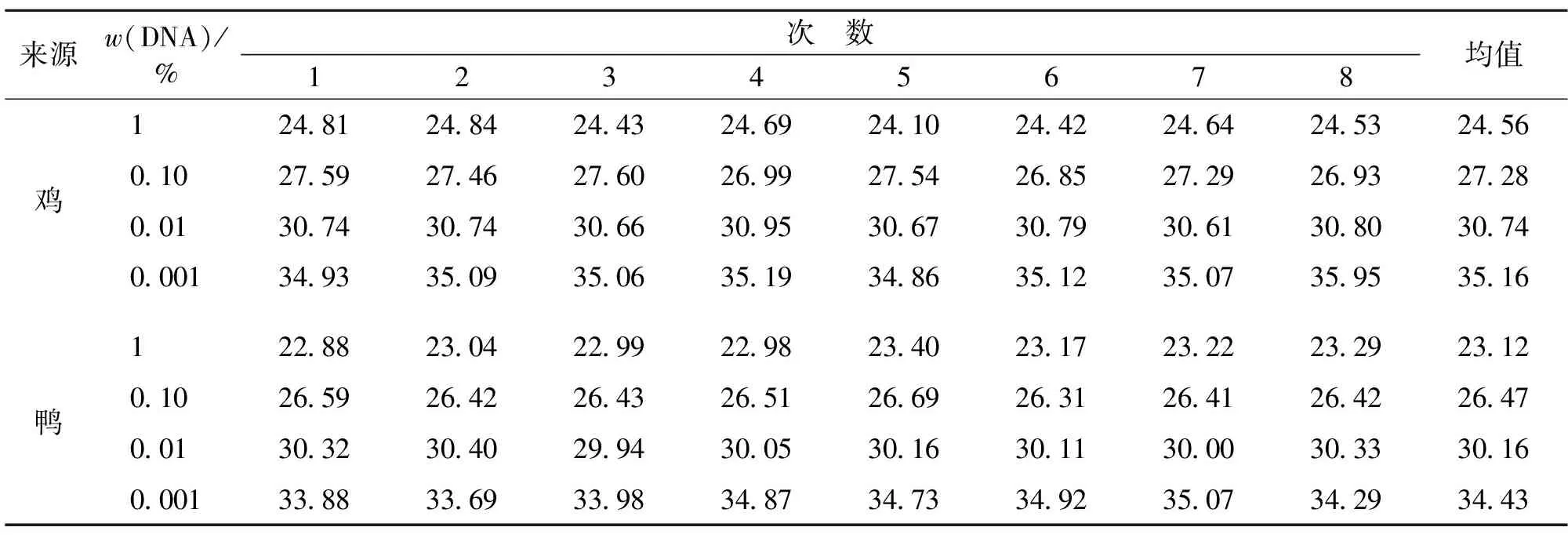
来源w(DNA)/%次 数12345678均值鸡1 2481248424432469241024422464245324560102759274627602699275426852729269327280013074307430663095306730793061308030740001349335093506351934863512350735953516鸭1 2288230422992298234023172322232923120102659264226432651266926312641264226470013032304029943005301630113000303330160001338833693398348734733492350734293443
3 结论
本试验通过寻找鸡、鸭线粒体DNA的保守区域,设计筛选特异性的引物和Taqman探针进行试验,对肉制品是否掺假作出判断。试验设计的引物和探针能够特异性的扩增出鸡、鸭源性成分,两种动物源性的最低检出限值(质量分数)分别为0.01%和0.001%。
总之,该方法的特异性好,灵敏度高,简便快速,结果准确,适用于肉制品中鸡、鸭源性成分检测,能够为肉制品的质量控制和质量监督提供技术依据和参考。
[1] 陈颖,吴亚君,徐宝梁,等.食品及饲料中马属动物源性成分的PCR检测研究[J].中国生物工程杂志,2004(5):78-83.
[3] DALMASSO A,FONTANELLA E,PIATTI P,et al.A multiplex PCR assay for the identfication of animal species in feedstuffs[J].Mol Cell Probes,2004,18(2):81-87.
[5] HAUNSHI S,BASUMATARY R,GIRISH P S,et al.Identification of chicken,duck,pigeon and pig meat by species-specific markers of mitochondrial origin[J].Meat Sci,2009,83(3):454-459.
[6] DOOLEY J J,PAINE K E,GARRETT S D,et al.Detection of meat species using TaqMan real-time PCR assays[j].Meat Sci,2004,68(3):431-438.
[7] JONKER K M,TILBURG J J H C,BOER G H H E D,et al.Species identification in meat products using real-time PCR[J].Food Addit Contam,2008,25(5):527-533.
[8] KESMEN Z,GULLUCE A,SAHIN F,et al.Identification of meat species by Taq Man-based real-time PCR assay[j].Meat Sci,2009,82(4):444-449.
[9] ZULALK,YETIMAN A E,SAHIN F,et al.Detection of chicken and turkey meat in meat mixtures by using real-time PCR assays[J].J Food Sci,2012,77(2):167-173.
[10] KÖPPEL R,ZIMMERLI F,BREITENMOSER A.Heptaplex real-time PCR for the identification and quantification of DNA from beef,pork,chicken,turkey,horse meat,sheep and goat[J].Eur Food Res Technol,2009,230(1):125-133.
[11] SAWYER J,WOOD C,SHANAHAN D,et al.Real-time PCR for quantitative meat species testing[J].Food Control,2003,14(8):579-583.
[12] 王萍,乔勇升,韩芷玲.猪源性成分检测中3种DNA提取方法比较[J].生物加工过程,2015,13(6):61-64.
[13] 陈茹,林志雄,刘琳琳.应用PCR等核酸技术检验动物饲料中牛羊组织成分[J].中国兽医科技,2001,31(9):3-8.
[14] 曹际娟,卢行安,秦成,等.实时荧光PCR技术检测肉骨粉中牛羊源性成分的方法[J].生物技术通讯,2002,13(2):158-160.
[15] 冯海永,韩建林.羊肉产品中若干动物源性成分的七重 PCR检测技术应用研究[J].中国畜牧兽医,2010,37(9):85-90.
[16] 杨宝华,宗卉.根据线粒体基因的特异性鉴别检测饲料中的动物源性成分[J].科学试验与研究,2000(5):1-3.
[17] 庞杰,王金玲,张莹,等.饲料中鱼源性成分定量检测的实时荧光PCR技术的建立[J].中国兽医学报,2010(5):680-692.
(责任编辑 荀志金)
Real-time PCRfor identification of chicken and duck ingredients in meat product
YUE Yuan
(Ningxia Hui Autonomous Region Food Inspection Center,Yinchuan 750001,China)
A real-time PCR assay to detect chicken and duck ingredients in meat product was described.According to chicken and duck mitochondrial DNA sequence,we have designed the species-specific PCR primer and Taqman probe. This method could detect the presence of DNA in food and feedstuffs containing less than 0.01 % (w/w) chicken and 0.001 % (w/w) duck ingredients. It could be an effective method to detect chicken and duck ingredients in meat products.
real-time PCR; chicken ingredient; duck ingredients; meat product
10.3969/j.issn.1672-3678.2016.06.008
2016-09-19
岳 苑(1982—),女,四川蓬溪人,工程师,研究方向:食品微生物检测,E-mail:yueyuan_0421@126.com
TS207.3
A
1672-3678(2016)06-0041-05
