ZEB-1与E-cad在口腔鳞癌中的表达及临床意义
2016-12-28李松军李善昌张宏宇姜炳华
李松军,李善昌,张宏宇,姜炳华,闫 磊
(佳木斯大学附属第二医院颌面外科,黑龙江 佳木斯 154002)
ZEB-1与E-cad在口腔鳞癌中的表达及临床意义
李松军,李善昌,张宏宇,姜炳华,闫 磊
(佳木斯大学附属第二医院颌面外科,黑龙江 佳木斯 154002)
目的:探讨E盒锌指结合蛋白1(Zinc finger E-box binding homeobox 1,ZEB-1)与E钙黏附蛋白(Epithelial-cadherin,E-cad)在口腔鳞状细胞癌(Oral Squamous Cell Carcinoma,OSCC)中的表达及临床意义。方法:采用免疫组化sp法检测ZEB-1与E-cad在50例OSCC中及20例癌旁黏膜组织中的表达情况。结果:ZEB-1在OSCC的阳性表达率约为62.0%(31∕50),在癌旁黏膜组织中阳性表达率为0(0∕20);E-cad在OSCC中的阳性表达率约为32%(16∕50),在癌旁黏膜组织中的阳性表达率为100%(20∕20)。相关性分析显示,ZEB-1与E-cad的表达之间存在负相关(χ2=7.2592,P<0.01);ZEB-1与E-cad在OSCC的表达率均与其分化程度、有无淋巴结转移、临床分期有关,与性别、年龄不相关。结论:①ZEB-1在OSCC中的表达显著高于在癌旁黏膜组织中的表达;相反E-cad在癌旁黏膜组织中的表达显著高于OSCC中的表达。②ZEB-1与E-cad在OSCC中的表达是相拮抗的。③ZEB-1与E-cad在OSCC中的表达与其侵袭转移有一定关联。
ZEB-1;E-cad;OSCC;免疫组化
口腔颌面部的恶性肿瘤中以鳞状细胞癌为最多见,一般占80%以上[1]。根据最近文献报道,OSCC,中晚期发现较早期发现预后差,5年生存率仅为50%~60%[2,3]。因此寻找到早期有效及判断预后的生物标志物是研究肿瘤的主要方向。本实验通过免疫组化sp法检测ZEB-1与E-cad在OSCC中的表达情况,探讨两者之间的相关性。
1 材料与方法
1.1 材料
1.1.1 石蜡标本:从佳木斯大学附属口腔医院、齐齐哈尔市第一医院、哈尔滨大学附属第二医院等医院病理科2010~2014年口腔鳞状细胞癌根治性手术切除部分标本中随机选取50例,其中男32例,女18例,年龄32~80岁;舌癌23例,牙龈癌11例,颊黏膜癌10例,腭癌3例,口底癌3例;病理分级,高分化16例,中低分化34例;根据口腔癌的TNM分类分期(UICC2002),Ⅰ~Ⅱ期30例,Ⅲ~Ⅳ期20例;有颈淋巴结转移者18例,无转移者32例。根据所收集病例患者均未经过化疗、放疗及其他任何抗癌治疗。所收集的石蜡标本均由病理学专业医师证实并且临床资料齐全。另外随机选取同期手术切除的癌旁黏膜组织20例。
1.1.2 主要试剂:兔抗人ZEB-1单克隆抗体(艾迪抗公司,英国),兔抗人E-cad单克隆抗体(北京中杉公司),通用型SP免疫组化检测试剂盒及DAB试剂盒(北京中杉公司)。
1.2 方法
1.2.1 免疫组化SP法:全部标本经4%甲醛固定,常规石蜡包埋。石蜡标本以4μm厚连续切片,以PBS代替一抗作阴性对照,兔抗人ZEB-1单克隆抗体以人乳腺癌组织为阳性对照,兔抗人E-cad单克隆抗体以人结肠癌组织为阳性对照。其他步骤严格按照说明书进行免疫组化实验。
1.2.2 结果判定:ZEB-1位于细胞核或∕和细胞质,阳性表达为棕色、棕黄色及黄色颗粒;E-cad位于细胞膜或细胞质,阳性表达为棕色、棕黄色及黄色颗粒。结合肿瘤细胞染色的百分比及染色强度进行评分[4,5]:阳性细胞数≤10%为0分,阳性细胞数11%~50%为1分,阳性细胞数51%~75%为2分,阳性细胞数>75%为3分。按染色强度评分:无黄色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。染色阳性细胞数与染色强度之和≥3分者为阳性表达,<3分者为阴性表达。
1.3 统计学方法
采用SPSS19.0软件进行统计学分析。
2 结果
2.1 ZEB-1在口腔鳞状细胞癌及癌旁黏膜组织中的表达
2.1.1 ZEB-1的表达位置及阳性表达率
ZEB-1阳性部位定位于细胞核或∕和细胞质,表达为棕色、棕黄色及黄色颗粒。ZEB-1在口腔鳞状细胞癌中的阳性表达率约为62.0%(31∕50),在癌旁黏膜组织中的阳性表达率约为0(0∕20)。见表1。

表1 ZEB-1在口腔鳞状细胞癌及癌旁黏膜组织中的表达
2.1.2 ZEB-1的表达与口腔鳞状细胞癌组织各临床病理特征的关系
在50例口腔鳞状细胞癌组织标本中,在性别上,男性组阳性表达率约为53.1%(17∕32),女性组阳性表达率约为77.8% (14∕18),组间比较,差异无统计学意义(P>0.05);在年龄上,≤60岁组阳性表达率约为67.9% (19∕28),>60岁组阳性表达率约为54.5%(12∕22),组间比较,差异无统计学意义(P>0.05);在组织学分级高分化者阳性表达率约为25.0%(4∕16),中、低分化者阳性率约为79.4%(27∕34),组间比较,差异有统计学意义(P<0.05);在TNM分期中,Ⅰ~Ⅱ期阳性表达率约为46.7%(14∕30,),Ⅲ~Ⅳ期阳性表达率约为85.0%(17∕20),组间比较,差异有统计学意义(P<0.05);在有无淋巴结转移上,有淋巴结转移组阳性表达率约为88.9%(16∕18),无淋巴结转移组阳性表达率约为46.9%(15∕32),组间比较,差异有统计学意义(P<0.05)。见表2。

表2 ZEB-1的表达与口腔鳞状细胞癌组织各临床病理特征的关系
2.2 E-cad在口腔鳞状细胞癌及癌旁黏膜组织中的表达情况
2.2.1 E-cad的表达位置及阳性表达率
E-cad阳性部位定位于细胞膜,表达为棕色、棕黄色及黄色颗粒。E-cad在口腔鳞状细胞癌中的阳性表达率约为32.0%(16∕50),在癌旁黏膜组织中的阳性表达率为100%(20∕20)。见表3。
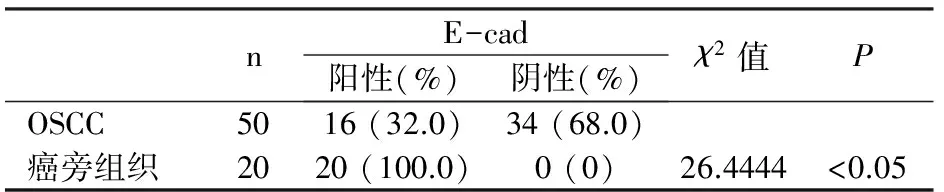
表3 E-cad在口腔鳞状细胞癌及癌旁黏膜组织中的表达情况
2.2.2 E-cad的表达与口腔鳞状细胞癌组织各临床病理特征的关系
在50例口腔鳞状细胞癌组织标本中,在性别上,男性组阳性表达率约为31.3%(10∕32),女性组阳性表达率约为33.3% (6∕18),组间比较,差异无统计学意义(P>0.05);在年龄上,≤60岁组阳性表达率约为22.7% (11∕28),>60岁组阳性表达率约为39.3%(5∕22),组间比较,差异无统计学意义(P>0.05);在组织学分级高分化者阳性表达率约为68.8%(11∕16),中、低分化者阳性率约为14.7%(5∕34),组间比较,差异有统计学意义(P<0.05);在TNM分期中,Ⅰ~Ⅱ期阳性表达率约为46.7%(14∕30,),Ⅲ~Ⅳ期阳性表达率约为10.0%(2∕20),组间比较,差异有统计学意义(P<0.05);在有无淋巴结转移上,有淋巴结转移组阳性表达率约为11.1%(2∕18),无淋巴结转移组阳性表达率约为43.8%(14∕32),组间比较,差异有统计学意义(P<0.05)。见表4。

表4 E-cad的表达与口腔鳞状细胞癌组织各临床病理特征的关系
2.3 ZEB-1与E-cad在口腔鳞状细胞癌中表达的相关性
在50例口腔鳞状细胞癌中ZEB-1的阳性表达率约为62.0%(31∕50),E-cad的阳性表达率约为32.0%(16∕50);在20例癌旁黏膜组织中ZEB-1的阳性表达率约为0(0∕20),E-cad的阳性表达率为100%(20∕20),相关性分析显示,ZEB-1与E-cad的表达之间存在负相关。见表5。

表5 ZEB-1与E-cad在口腔鳞状细胞癌中表达的相关性
3 讨论
上皮间质转化(Epithelial-mesenchmal transition,EMT)在恶性肿瘤的发生、侵袭转移过程中的作用越来越受到学者们的关注,为探索肿瘤发生、发展的具体机制丰富了更多的理论依据。EMT是肿瘤细胞发生转移侵袭的重要基础,是上皮细胞分解相互之间的细胞连接结构转化成单个的、无极性的、可以随意运动的、具有侵袭性的间质细胞的过程[6]。EMT通过上皮细胞标志物E-cad等表达下调,间质细胞标志物波形蛋白(vimentin)等表达上调,肿瘤细胞获得转移和侵袭能力。大量研究证实细胞黏附分子参与了肿瘤的转移和侵袭,其中E-cad作用尤为明显。邱明等[7]发现E-cad与口腔癌临床病理特征有重要的相关性。张东东等[8]也发现E-cad在正常膀胱组织中和膀胱癌组织中的表达具有差异性。最近文献报道ZEB-1与E-cad启动子结合,直接抑制其表达,促进EMT的发生,最终导致肿瘤细胞发生转移和侵袭[9]。本实验通过免疫组化sp法研究ZEB-1与E-cad在口腔鳞状细胞癌中的表达情况,发现ZEB-1高表达的同时E-cad低表达,且与其分化程度、有无淋巴结转移、临床分期有关,与性别年龄不相关。这说明在口腔鳞状细胞癌中有可能ZEB-1抑制了E-cad的表达,促进EMT的发生,最终导致其发生转移和侵袭。这也说明通过联合检测ZEB-1与E-cad为口腔鳞状细胞癌的早期发现提供更多依据,也能为口腔鳞状癌的靶向治疗提供新的方向及思路。
[1]张志愿主编.口腔颌面外科学[M].第7版.北京:人民卫生出版社,2013:324
[2]Petersen PE. The world oral health report 2003:Continuous improvement of oral health in the 21st century-the approach of WHO hlobal oral programme[J]. Community Dent Oral Epide miol,2003,31(1):3-23
[3]Neville BW,Day TA. Oral cancer and precancerous lesi[J].CA Cancer J Cl in,2002,52(4):195-215
[4]Karan D,Chen SJ, Johansson SL,et al.Dysregulated expression of MIC21/PDF in human prostate tumor cells[J]. Biochem Bio-phys Res Commun,2003,305(3):598-604
[5]Baltaci S,Orhan D,Gogns C,et al.Thrombospond in 21,Vas -cular endothelial growth factor expression and microvessel density in renal cell carnoma and their relationship with multifo cality[J].Eur Urol,2003,44(1):76-81
[6]Lee J M,Dedhar S,Kalluri R,et al.The epithelial-mesenchymal transition:new insights in signaling,development,and disease[J].Journal Cell Biology,2006,172(7):973-981
[7]邱明,毛庆华.口腔鳞癌E-cadherin表达与淋巴结转移的相关性分析[J].黑龙江医药科学,2006,29(2):38-39
[8]张东东,梁衍锋. E-cad在膀胱癌中的表达及意义[J].黑龙江医药科学,2010,33(6):10-11
[9]陈萧雅,余长云.上皮间质转化与肿瘤转移的研究进展[J].中国耳鼻咽喉颅底外科杂志,2015,21(4):346-350
The expression of ZEB-1 and E-cad on oral squamous cell carcinoma and its clinical significance
LISong-jun,LIShan-chang,ZHANGHong-yu,JIANGBing-hua,YANLei
(Oral and Maxillofacial Surgery,the Second Affiliated Hospital of Jiamusi University, Jiamusi 154002,China)
Objective: To investigate the expression of Zinc finger E-box Binding home obox 1(ZEB-1 )and Epithelial-cad he r in (E-cad )in Oral Squamous Cell Carcinoma (OSCC)and its clinical significance. Methods: SP immunohistochemiral method was used to detect the expression of ZEB-1 and E-cad in 50 specimens of OSCC and 20 epithelium tissues adjacent to carcinoma. Results: The positive rates of ZEB-1 expression in OSCC and epithelium tissues adjacent to carcinoma were 62.0%(31∕50)and 0(0∕20). The positive rates of E-cad expression in OSCC and epithelium tissues adjacent to carcinoma were 32%(16∕50)and 100%(20∕20).Spear man rank correlation analysis showed that they were negatively correlated (χ2=7.2592,P<0.01). The expression of ZEB-1 and E-cad in OSCC was not correlated with the patient's age and gender. However, they were closely related to differentiated degrees, lymph node metastasis and clinical stages. Conclusion: There was a high expression of ZEB-1 in OSCC and the expression of ZEB-1 in epithelium tissues adjacent to carcinoma was low. On the contrary, there was a low expression of E-cad in OSCC and the expression of E-cad in epithelium tissues adjacent to carcinoma was high. The expression of ZEB-1 and E-cad in OSCC was antagonism. The expression of ZEB-1 and E-cad in OSCC might be closely related with the invasion and lymphmetastasis.
ZEB-1; E-cad; OSCC;immunohistochemistry
黑龙江省教育厅科研项目,编号:12521553。
李松军(1987~)男,黑龙江佳木斯人,在读硕士研究生。
李善昌(1969~)男,黑龙江佳木斯人,硕士,教授,硕士研究生导师。E-mail:lishanchang@163.com。
R739.8
A
1008-0104(2016)06-0104-03
2016-03-08)
