丹参素对肾小管上皮细胞转分化的影响
2016-12-28任清松李瑞婷夏良锋门茂元杜伟达栾海艳
任清松,李瑞婷,夏良锋,门茂元,杜伟达,栾海艳
(佳木斯大学基础医学院,黑龙江 佳木斯 154007)
丹参素对肾小管上皮细胞转分化的影响
任清松,李瑞婷,夏良锋,门茂元,杜伟达,栾海艳
(佳木斯大学基础医学院,黑龙江 佳木斯 154007)
目的:研究丹参素对肾小管上皮细胞转分化的影响。方法:用含10% FBS的DMEM培养基贴壁培养肾小管上皮细胞,并将其分为A,B和C组。A 组被置于5.5mmol/L 低糖的DMEM 培养基中;B组和C 组则被置于25mmol/L高糖的DMEM 培养基中,与此同时C组加入0.2mg/mL丹参素进行药物干预48h。实验结束后,观察肾小管上皮细胞的形态变化;免疫组织荧光技术检测CK18、α-SMA 和Vimentin的蛋白表达。结果:①细胞形态变化:A组细胞呈多边形或圆形,胞核也呈现椭圆形或圆形;B组的绝大多数细胞已失去原有形态,呈成纤维细胞样的长梭形,且胞核也呈梭形变;C组的大部分细胞仍保持到原有的上皮细胞形态,仅少量呈成纤维细胞样的长梭形改变。②CK-18、α-SMA和Vimentin 蛋白的表达:与N组相比,B 组的CK-18蛋白表达显著下降(P<0.05),α-SMA 和Vimentin的蛋白表达明显升高(P<0.05);而与H 组相比,C组的CK-18蛋白表达则明显上升(P<0.05),α-SMA 和Vimentin的蛋白表达则明显下降(P<0.05),但与N 组相比,仍有明显差异(P<0.05),未达到正常水平。结论:丹参素能通过升高CK-18和降低α-SMA、Vimentin 的蛋白表达来抑制高糖环境对肾小管上皮细胞转分化的诱导作用。
丹参素;肾小管上皮细胞;转分化
糖尿病肾病(diabetic nephropathy, DN) 是最常见的糖尿病慢性并发症,是由长期高血糖所引起的慢性进展性肾脏疾病,也是糖尿病患者最常见的器官并发症之一,其肾功能的下降程度与肾小管及其间质纤维化的关系极其密切。尤其是近些年来,随着糖尿病肾病发生率的逐年上升,导致肾脏慢性疾病(Chronic renal disease,CRD) 的患病率也逐年提高,业已成为致使糖尿病患者死亡率升高的主要诱因之一,但其发病机制至目前为止仍未完全明了。故而明确糖尿病肾病的发生发展机制,对预防或延缓其发病有着十分重要的临床医学价值和社会意义。本研究项目拟采用使肾小管上皮细胞处于高糖环境,由高糖诱导使其发生转分化,然后给予中药丹参素(danshensu, DSS) 进行药物干预,观察其对高糖环境诱导的肾小管上皮细胞转分化的影响,以期为临床应用丹参素治疗糖尿病肾病提供充分的理论和实验依据,为临床治疗糖尿病肾病提供一个新的治疗途径和方法。
1 材料与方法
1.1 材料
1.1.1 实验细胞
人肾近曲小管上皮细胞(HK-2) 购于上海信裕生物科技有限公司。
1.1.2 主要试剂
丹参素(购于南京泽朗医药科技有限公司,药物纯度:98.0 %);DMEM 培养基(购于Hyclone, USA);胎牛血清(Fetal bovine serum, FBS, 购于Gibco, USA);α-SMA(购于上海亚培生物科技有限公司);CK-18、Vimentin(购于武汉博士德生物工程有限公司)。
1.2 方法
1.2.1 实验对象及分组
用含10 % 胎牛血清的DMEM培养基贴壁培养肾小管上皮细胞于37℃,5 % CO2,饱和湿度的培养箱内。待细胞生长达到融合状态(即铺满瓶壁80%~90%以上)时,采用0.05%胰蛋白酶溶液进行消化,按1:3~1:6密度接种传代,并取处于对数生长期细胞时用于后续实验研究。
实验共分3组:正常糖对照组(A组);高糖对照组(B组);丹参素组(C组)。
1.2.2 给药方案
正常糖对照组被置于5.5mmol/L低糖的DMEM培养基中培养;高糖对照组和丹参素组均被置于25mmol/L高糖的DMEM 培养基中培养;但丹参素组同时加入丹参素(0.2mg/mL) 进行药物干预48h。
1.2.3 检测指标
于倒置显微镜下观察肾小管上皮细胞的形态学改变情况;免疫组织荧光技术检测CK-18、α-SMA 和Vimentin 的蛋白表达情况。
1.3 统计学方法
采用SPSS13.0 统计软件处理分析,所有数据均以表示;组间比较采用单因素方差分析,组间两两比较采用q检验,以P<0.05为有统计学意义。
2 结果
2.1 肾小管上皮细胞的形态学变化
正常糖对照组:细胞呈多边形或圆形,胞核也呈现椭圆形或圆形;高糖对照组:绝大多数细胞已失去原有形态,呈现成纤维细胞样的长梭形,且胞核也呈梭形变;丹参素组:大部分细胞仍保持到原有的上皮细胞形态,仅少量细胞呈现成纤维细胞样的长梭形改变。
2.2 CK-18、α-SMA和Vimentin的表达
与正常糖对照组相比,高糖对照组细胞的CK-18蛋白表达显著降低(P<0.05);而与高糖对照组相比,丹参素组则明显上升(P<0.05),但与正常糖对照组相比,仍有明显差异(P<0.05)。见表1。
与正常糖对照组相比,高糖对照组的α-SMA、Vimentin蛋白表达明显升高(P<0.05);而与高糖对照组相比,丹参素组则明显降低(P<0.05),但与正常糖对照组相比,仍未达到正常水平(P<0.05)。见表1。
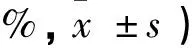
表1 CK-18、α-SMA和Vimentin在各组中的表达(阳性细胞比率,
A组vs B组,*P <0.05;A组vs C组,#P <0.05。
3 讨论
研究表明,无论从发病时间或机制来说,肾小管结构或功能的改变对糖尿病肾病的发生发展均具有十分重要的作用。肾小管间质病变的严重程度与糖尿病肾病的肾功能损害密切相关,是反映肾功能下降严重程度和判断预后最重要的指标。肾小管及其间质纤维化的发生机制主要是细胞外基质(extracelluar matrix, ECM) 的分泌与降解失衡,此外还有成纤维细胞的增生,以及肾小管的萎缩和消失[1],其中ECM的增多更是直接导致了肾纤维化的进行性发展。肌成纤维细胞是肾小管间质纤维化发生过程中产生ECM的主要细胞,但正常肾组织中几乎没有肌成纤维细胞,大量的研究表明肾小管上皮细胞在病理条件下则可发生转分化成为肌成纤维细胞,丧失了上皮细胞黏附特性,即表皮黏附分子—E-cadherin 的表达减少;而α-平滑肌肌动蛋白(α-SMA)、波形蛋白(vimentin) 等间充质细胞表型蛋白表达增多[2,3]。
丹参(Salvia miltiorrhiza Bge.) 是药理活性广泛、高效、低毒的化合物,能够拮抗动脉粥样硬化,改善由缺血缺氧所引起的细胞代谢障碍,改善微循环障碍,保护心肌细胞[4],保护神经细胞[5],增强机体免疫力,保护肝脏细胞及防治肝脏的纤维化[6]。此外,丹参在对肾结构和功能也有十分显著的影响,能清除肾组织中的氧自由基,进而保护肾血管内皮细胞;通过降低血黏稠度,抑制血小板聚集,来改善肾脏的血液微循环;增加SOD 的表达活性,降低空腹血糖和糖化血红蛋白的水平,抑制低密度脂蛋白(LDL)的氧化,内源性胆固醇(Ch)、Ⅳ型胶原和血浆内皮素的合成[7],最终改善糖尿病肾病的糖脂代谢紊乱[8]。丹参注射液还能下调大鼠肾皮质层黏连蛋白和Ⅳ型胶原的表达水平,改善由阿霉素所致的肾小球硬化;降低肾梗阻手术后梗阻侧大鼠肾脏α-SMA 和TGF-β1 的表达水平,并减少Ⅰ型胶原蛋白的沉积,延缓肾小管间质纤维化的发生发展。虽然丹参对糖尿病肾病和肾纤维化有一定的疗效,但作为一种组成成分复杂的传统中药,对其发挥防治作用的最佳活性成分和具体作用机制的研究并不十分清楚和透彻,这就造成了丹参的使用效率不高和药物副作用较大的弊端。因此,本研究着重选取了丹参主要的水溶性成分—丹参素作为我们的研究对象。我们的研究发现丹参素具有抑制高糖环境对肾小管上皮细胞转分化的诱导作用,减少肾小管上皮细胞转分化成为成纤维细胞的比率,维持肾小管上皮细胞的正常形态。与糖尿病模型组相比,丹参素组肾小管上皮细胞当中的CK-18 蛋白表达升高,而Vimentin、α-SMA 的蛋白表达降低,所以丹参素对高糖环境对肾小管上皮细胞转分化诱导的抑制作用可能是通过抑制上皮细胞的特异蛋白CK-18 表达的降低和Vimentin、α-SMA 的蛋白升高来实现的。这不但为丹参防治糖尿病肾病提供了更有力的理论依据,也提高了其利用效率,并降低其副作用,更好的发挥了祖国传统医学的作用。
[1]Hills CE, Squires PE. The role of TGF-β and epithelial-to mesenchymal transition in diabetic nephropathy[J].Cytokine Growth Factor Rev, 2011,22(3):131-139
[2]Wu Y,Ren K,Liang C,et al. Renoprotective effect of total glucosides of paeony (TGP) and its mechanism in experimental diabetes[J].J Pharmacol Sci,2009,109(1):78-87
[3]孙敏, 樊宏伟, 赖红容, 等. 中药对高糖作用下牛肾小球系膜细胞增殖的影响[J].中国中医药信息杂志, 2004,11(5):399-400
[4]Yin Y, Guan Y, Duan J, et al. Cardioprotective effect of Danshensu against myocardial ischemia/reperfusion injury and inhibits apoptosis of H9c2 cardiomyocytes via Akt and ERK1/2 phosphorylation[J]. Eur J Pharmacol, 2013,699(1-3):219-226
[5]Seetapun S1, Yaoling J, Wang Y, et al. Neuroprotective effect of Danshensu derivatives as anti-ischaemia agents on SH-SY5Y cells and rat brain[J].Biosci Rep, 2013,33(4):62
[6]李艳杰, 孙玉华. 丹参素药理作用研究进展[J]. 延边大学医学学报, 2006,29(1):73-75
[7]李中和, 张建明, 霍飞蛟. 丹参对糖尿病早期肾病患者血浆内皮素和IV型胶原的影响[J].中国综合临床, 2002,18(7):621-622
[8]宋怀方, 林令华. 复方丹参片对糖尿病人超氧化物歧化酶活力及血液流变学的影响[J].药学进展, 2000,24(3):170-172
佳木斯大学大学生创新创业训练计划项目,编号:2014xj03。
任清松(1991~)男,黑龙江佳木斯人,学士。
栾海艳(1979~)女,黑龙江佳木斯人,博士,讲师,硕士研究生导师。E-mail:luanhaiyan@jmsu.edu.cn。
R692.6
A
1008-0104(2016)06-0070-02
2016-06-19)
