细胞自噬促进脂肪干细胞向软骨细胞分化
2016-12-28陈全刚陈仁金袁红花
陈全刚,陈仁金,袁红花
(1.徐州医科大学实验动物中心,江苏 徐州 221000;2.徐州医科大学神经生物研究中心,江苏 徐州 221000)
细胞自噬促进脂肪干细胞向软骨细胞分化
陈全刚1,陈仁金1,袁红花2
(1.徐州医科大学实验动物中心,江苏 徐州 221000;2.徐州医科大学神经生物研究中心,江苏 徐州 221000)
目的:探讨细胞自噬对ADSCs分化的影响。方法:无菌条件下取大鼠大网膜,肾周脂肪囊,睾丸周围等处取脂肪组织并分离ADSCs,用软骨细胞诱导培养基进行培养,并通过抑制剂或干扰分子改变细胞自噬水平,检测ADSCs向软骨细胞分化的变化情况。结果:抑制自噬,细胞表达软骨细胞标识蛋白,SOX-9的量显著下调:诱导自噬,SOX-9的表达显著升高,结论:细胞自噬促进ADSCs向软骨细胞分化。
脂肪干细胞;细胞自噬;细胞分化
软骨缺损是临床常见的一种骨科疾病,由于软骨是一种无神经及血管营养的组织,其自身修复能力有限,导致临床治疗困难重重。构建组织工程软骨是一种有效的解决方式,然而,种子细胞的来源问题又一直制约着软骨组织工程的发展。脂肪干细胞(adipose-derived-stem cells,ADSCs)的发现为解决这一问题提供了新的方法。细胞自噬是一种高度保守的溶酶体依赖性降解途径。通过自噬,细胞可以清除受损或衰老的细胞器及过度聚集的蛋白,在维持细胞内环境的稳态中发挥重要作用。此外,越来越多的研究表明,细胞自噬还参与机体众多机能的调控,如细胞凋亡、天然免疫、获得性免疫、细胞分化等。迄今为止,细胞自噬对ADSCs的调控作用仍然未被证实。为此,本研究通过细胞自噬诱导剂雷帕霉素(Rapamycin)及抑制剂(3-MA),分别诱导和抑制细胞自噬水平,进一步通过荧光定量PCR (qRT-PCR) 和Western blot检测软骨细胞标识物SOX-9的表达情况,发现诱导ADSCs的细胞自噬,显著提高其向软骨细胞的分化能力。相反,细胞自噬被抑制后,其分化能力显著降低。此外,我们通过干扰分子抑制自噬相关基因ATG5的表达,对上述结果进行验证,进一步证实了细胞自噬对ADSCs向软骨细胞分化的调控作用。
1 材料与方法
1.1 实验动物及试剂
SD大鼠由徐州医科大学实验动物中心自繁自养。3-MA、Rapamycin购自美国Sigma公司。LC3及SOX-9抗体购自美国 Cell Signaling Technology (CST)公司。Trizol Regent、荧光定量试剂盒购自Invitrogen公司。FITC标记二抗购自中国碧云天公司。ATG5干扰分子(siATG5)由苏州吉马公司设计合成。
1.2 ADSCs的分离培养
取雄性SD大鼠,颈椎脱臼法处死,在无菌条件下取大鼠大网膜,肾周脂肪囊,睾丸周围等处取脂肪组织。脂肪组织经D-Hank’s液漂洗后剪碎,并置于0.1%的I型胶原酶中消化,随后经过滤后置于含10% FBS高糖DMEM中,37℃、5% CO2孵育箱中培养。72h后换液,去除未贴壁细胞,待细胞长满后0.25%胰酶消化传代。
1.3 Western blot
ADSCs接种6孔板,置于含软骨细胞诱导剂(50nmol/L抗坏血酸、6.25mg/L胰岛素、100nmol/L地塞米松、50μg/L TGF-β1)的DMEM培养基中培养,每3天更换培养液。细胞培养至第14天后,弃上清,细胞经裂解液裂解,收取总蛋白。等量的蛋白通过12%的SDS-PAGE胶进行跑胶分离,并转移至PVDF膜上。洗涤后,用5%脱脂奶粉封闭。并分别用SOX-9、LC-3及内参β-actin一抗孵育,室温孵育1h后,使用HRP标记的二抗进行孵育并显色。
1.4 qRT-PCR
ADSCs经诱导培养14d后,收取样品,按TRIzol Reagent说明书提取细胞总RNA。并通过逆转录酶将其反转录为cDNA。依据RT-PCR试剂盒说明书,进行实时荧光定量PCR扩增。SOX-9 mRNA表达水平与内参(GAPDH)作均一化处理。引物采用Primer 5进行设计,序列见表1。
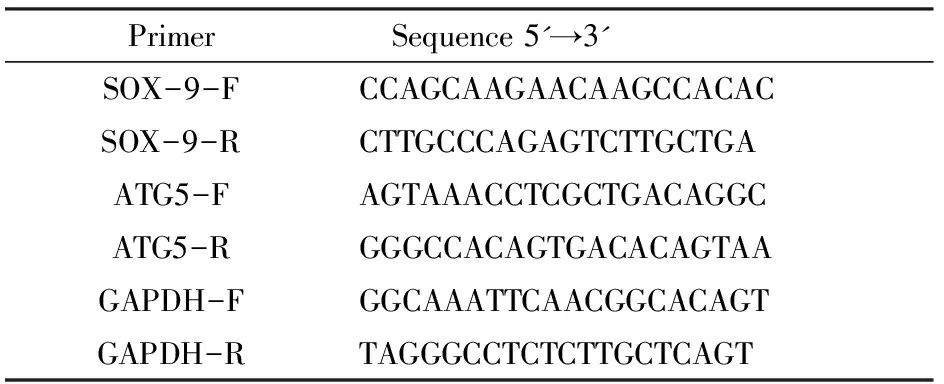
表1 引物序列采用primer与设计
2 结果
2.1 诱导自噬促进ADSCs的分化
为证实细胞自噬对ADSCs分化的调控作用,我们用含软骨细胞诱导剂的培养基培养ADSCs,同时设置雷帕霉素处理的实验组。细胞培养14d后,收取样品。细胞自噬被诱导后LC3蛋白会由LC3-I型转化为LC3-II型,这也是公认的细胞自噬被诱导的标志。为此,我们首先通过Western blot检测LC3-I和LC3-II蛋白的表达变化情况,结果发现雷帕霉素处理显著促进LC3-II的表达(图1A),证实雷帕霉素可以提高ADSCs的自噬水平。进一步,通过qRT-PCR和Western blot分别检测软骨标识蛋白SOX-9在mRNA和蛋白水平的表达变化情况。结果发现,雷帕霉素处理显著促进SOX-9的表达(图1B, 1C)。
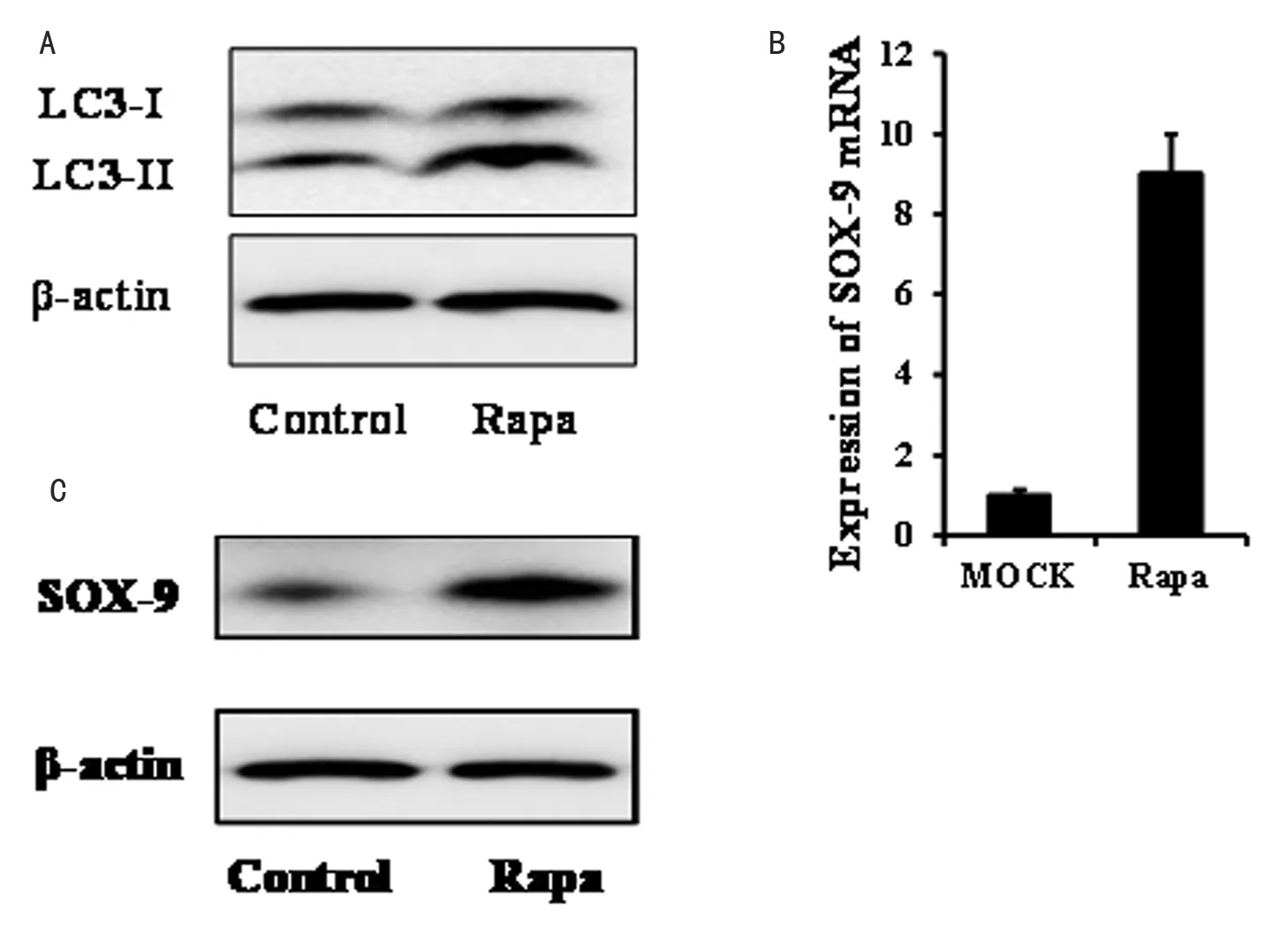
图1 A: Western blot检测LC3表达;B: qRT-PCR检测SOX-9表达; C: Western blot检SOX-9的表达
2.2 抑制细胞自噬抑制ADSCs向软骨细胞分化
随后,我们检测抑制细胞自噬对ADSCs分化的影响。同样,ADSCs在含软骨细胞诱导剂的培养基中培养,实验组用细胞自噬抑制剂3-MA处理,同时设未处理组对照。细胞培养14d后通过qRT-PCR及Western blot检测SOX-9的表达变化情况。结果表明,3-MA处理显著抑制SOX-9的表达(图2A, 2B)。
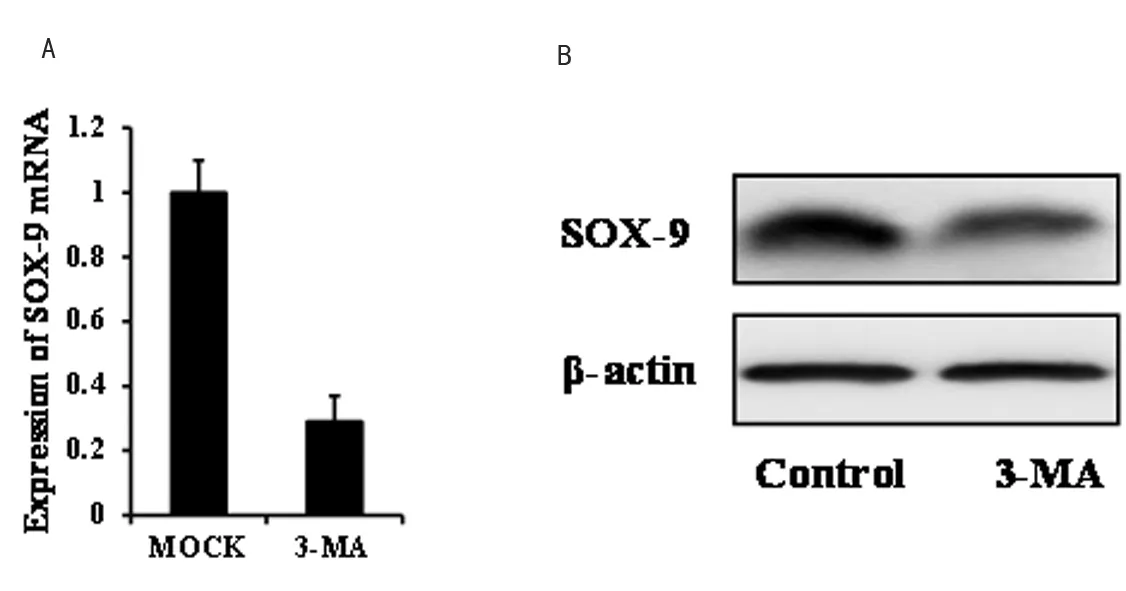
图2 A:qRT-PCR检测SOX-9的表达;B: Western blot检测SOX-9的表达
2.3 干扰自噬相关基因的表达抑制ADSCs向软骨细胞分化
为进一步对上述结果进行验证,我们通过干扰分子抑制自噬相关基因的表达,检测其对ADSCs分化的影响。首先我们通过qRT-PCR验证干扰分子的干扰效果。结果证实ATG5干扰分子可显著抑制ATG5的表达(图3A)。同时,SOX-9的表达也受到明显抑制(图3B, 3C)。表明抑制细胞自噬,可显著抑制ADSCs向软骨细胞的分化。
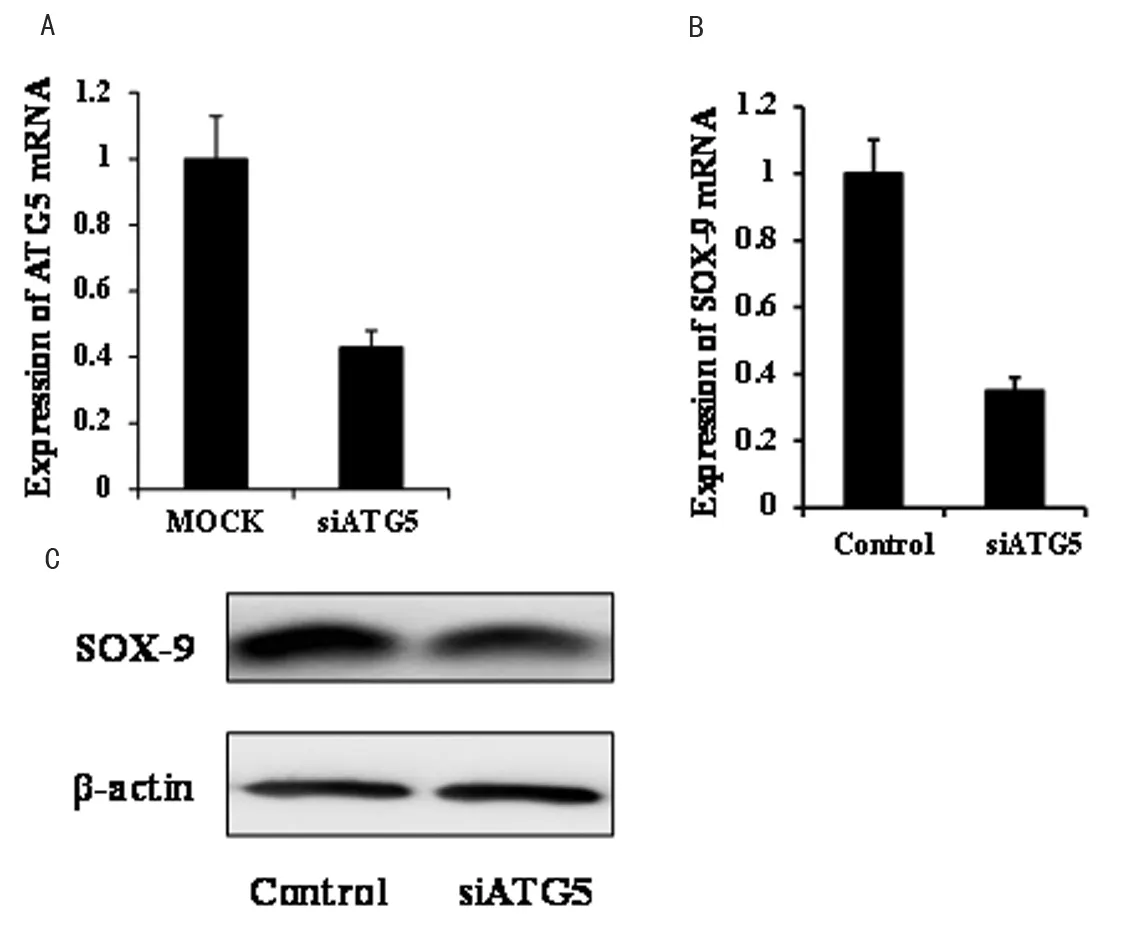
图3 A,B: q RT-PCR 检测ATG5及SOX-9的表达;C:Western blot检测SOX-9的表达
3 讨论
研究发现,软骨受损后自身修复能力有限,当受损部位直径大于4 mm时,则软骨组织不能自行修复[1]。通过“微骨折”、软骨移植等方法进行软骨缺损治疗取得一定效果,但同时面临着排斥反应、修复质量差等缺陷。通过组织工程学对软骨缺损进行治疗,是医学中的又一进步,通过组织工程制造的器官为创伤的修复提供了更丰富的来源,同时也是医学进入制造组织和器官的新时代。然而,在组织器官体外制造的过程中,种子细胞的来源又制约着其发展。如,在对软骨组织进行研究的过程中自体软骨细胞最早被用作种子细胞,但该细胞存在体外分化能力弱且培养传代中部分细胞会失去表形等缺点[2]。
脂肪干细胞是成体干细胞之一,2001年由Zuk等人从脂肪组织中分离得到,自身可不断更新增殖,同时具有干细胞特有的多向分化潜能。大量的研究证实了,ADSCs在特定条件下可分化为神经细胞、成骨细胞、内皮细胞及软骨细胞等[3~4]。细胞自噬是一种真核细胞高度保守的降解途径,细胞自噬可降解体内过剩聚集蛋白或衰老的细胞器,在维持细胞内环境的稳定发挥重要作用。随着研究的不断深入,细胞自噬的作用不断被揭示,如自噬通过调节干扰素的产生而影响天然免疫,通过调控MHC分子的表达调节获得性免疫等。此外,细胞自噬水平的改变还影响多种细胞的分化。如,通过基因敲除自噬相关基因,显著抑制了成骨细胞的分化生成;细胞自噬可以通过降解PDLIM1蛋白而调控精子细胞的分化生成[5];诱导自噬可以促进大鼠神经干细胞的增殖与分化等[6]。
ADSCs在软骨诱导培养基中培养可分化为软骨细胞。然而,迄今为止细胞自噬对脂肪干细胞分化的调控作用仍未见报道。为此,我们并对ADSCs进行软骨细胞分化的诱导培养,同时,通过化学试剂或干扰分子等手段改变细胞自噬水平。通过qRT-PCR和Western blot手段检测软骨细胞标示蛋白SOX-9的表达变化情况,探明了细胞自噬在ADSCs向软骨细胞分化过程中的正调控作用。为ADSCs做为种子细胞构建工程组织软骨提供了更丰富的理论基础。同时,也首次证实了在ADSCs中细胞自噬可以被诱导产生。
[1]Nettles DL, Elder SH, Gilbert JA. Potential use of chitosan as a cell scaffold material for cartilage tissue engineering[J]. Tissue Eng,2002,8(6):1009-1016
[2]Saadeh PB, Brent B, Mehrara BJ, et al. Human cartilage engineering: chondrocyte extraction, proliferation, and characterization for construct development[J]. Ann Plast Surg,1999,42(5):509-513
[3]Lendeckel S, J dicke A, Christophis P,et al.Autologous stem cells (adipose) and fibrin glue used to treat widespread traumatic calvarial defects: case report[J]. J Craniomaxillofac Surg,2004,32(6):370-373
[4]Brzoska M, Geiger H, Gauer S,et al. Epithelial differentiation of human adipose tissue-derived adult stem cells[J]. Biochem Biophys Res Commun,2005,330(1):142-150
[5]Shang Y, Wang H, Jia P, et al. Autophagy regulates spermatid differentiation via degradation of PDLIM1[J]. Autophagy,2016,16:60
[6]Chen Y, Zhao L, Tian X,et al. Autophagy induced by the withdrawal of mitogens promotes neurite extension in rat neural stem cells[J]. J Biochem Mol Toxicol,2013,27(7):351-356
Cell autophagy promoting the cells differentiation from adipose stem cells to cartilage
CHENQuan-gang1,CHENRen-jin1,YUANHong-hua2
(1.Laboratory Animal Unit, Xuzhou Medical University, Xuzhou 221004, China; 2. Neurobiological Research Center, Xuzhou Medical University, Xuzhou 221004,China)
Objective: To investigated the effect of autophagy on ADSCs differentiation. Methods: ADSCs were isolated from the adipose tissue around the testicles under aseptic conditions. Cellular autophagy were induced or inhibited by inhibitors or interference and cultured in chondrocyte induction medium. The differentiations of ADSCs were evaluated by western blot. Results: Inhibits the cellular autophagy, the expression of cartilage cell protein SOX-9 significantly reduced. However, when cellular autophagy was induced, the SOX-9 expression was increased. Conclusion: Autophagy promotes the differentiation of ADSCs into chondrocytes.
ADSCs;autophagy;cell differentiation
1.徐州医学院院长基金,编号:53631319;2.国家自然科学基金面上项目,编号:31172171。
陈全刚(1985~)男, 山东临沂人,博士,助理研究员。
袁红花(1968~)女,江苏徐州人,高级实验师。E-mail:jianling213@126.com。
R687
A
1008-0104(2016)06-0001-03
2016-06-23)
