恩替卡韦分散片人体药动学及生物等效性研究
2016-12-28董占军白万军宋浩静支旭然
马 杰,董占军,白万军,宋浩静,吴 茵,支旭然
(河北省人民医院药学部,河北 石家庄 050051)
·论 著·
恩替卡韦分散片人体药动学及生物等效性研究
马 杰,董占军*,白万军,宋浩静,吴 茵,支旭然
(河北省人民医院药学部,河北 石家庄 050051)
目的评价2种恩替卡韦制剂在健康人体的生物等效性。方法20例男性健康志愿受试者随机分成2组,分别交叉单剂量口服试验制剂(恩替卡韦分散片)或参比制剂(恩替卡韦片)0.5 mg,2周后交叉服药,采用高效液相色谱-串联质谱法测定血浆中药物浓度,以DAS 3.2.7软件计算药动学参数,进行生物等效性评价。结果2种制剂的峰浓度(Cmax)分别为(4.41±1.02) μg/L和(4.36±0.89) μg/L;达峰时间(tmax)为(0.66±0.19) h和(0.70±0.29) h;半衰期(t1/2)为(46.11±32.32) h和(61.28±93.69) h;曲线下面积(area under curve,AUC)0~72 h为(13.31±2.63) μg·h-1·L-1和(13.10±2.20) μg·h-1·L-1。结论2种恩替卡韦制剂生物等效,相对生物利用度为(103.3±14.0)%。
恩替卡韦;生物利用度;色谱质谱法
恩替卡韦的化学名为2-氨基-9-[(1S,3R,4S)-4-羟基-3-羟甲基-2-亚甲基环戊基]-1,9-二氢-6H-嘌呤-6-酮一水合物,是一种强效选择性鸟嘌呤核苷类似物。口服吸收进入肝细胞后,通过磷酸化作用形成单磷酸酯、二磷酸酯、三磷酸酯,尤其恩替卡韦三磷酸酯在肝细胞内抑制乙型肝炎病毒聚合酶的活性的形成,具有显著的病毒抑制作用。临床用于病毒复制活跃、血清丙氨酸转氨酶(alanine aminotransferase,ALT)持续升高或肝脏组织学显示有活动性病变的慢性乙型肝炎的治疗, 由于恩替卡韦高效抑制乙型肝炎病毒的复制,耐药性很低,几乎没有不良反应,近年来临床应用日趋广泛[1-6]。以中美上海施贵宝制药有限公司生产的恩替卡韦片作为参比制剂,评价大连中信药业股份有限公司提供的恩替卡韦分散片在健康人体内的药动学,旨在为临床合理应用恩替卡韦分散片提供参考依据。
1 材料与方法
1.1仪器与试验药物 AB Sciex Triple QuadTM5500 HPLC-MS/MS系统(美国AB Sciex公司);Analyst Instrument Control and Processing Software 1.6.1(美国AB Sciex公司);XW-80A型旋涡混合器(上海精科实业有限公司);Universal 16R低温高速离心机(德国Hettich公司)。甲醇(色谱纯,Germany Merk);甲酸(含量88%,Fisher Scientific);高氯酸(分析纯,天津市东方化工厂)。恩替卡韦对照品(纯度93.7%,批号101248-201202,中国食品药品检定研究院);地西泮对照品(内标纯度99.9%,批号171225-201304,中国食品药品检定研究院)。试验制剂:恩替卡韦分散片(每片0.5 mg,批号20150401,大连中信药业股份有限公司研制)。参比制剂:恩替卡韦片(每片0.5 mg,批号1501661,中美上海施贵宝制药有限公司生产)。
1.2实验方法
1.2.1研究对象 20例男性健康志愿受试者,年龄19~25岁,平均(21.95±2.57)岁,体质量(65.7±6.65) kg,身高(173.15±4.52) cm,经一般体检和心、肝、肾功能的检查均为正常者,受试前3个月未参加任何药物临床试验、1个月内至试验期间不服任何其他药物,受试期间禁忌烟酒。
所有健康志愿受试者均签署知情同意书,本试验获得河北省人民医院医学伦理委员会批准。
1.2.2试验方案 将20例健康男性志愿受试者随机分成2组各10例,禁食12 h后,分别单剂量口服试验制剂恩替卡韦分散片0.5 mg或参比制剂恩替卡韦片0.5 mg,分别于服药前及服药后7、14、21、30、45 min,1、1.5、2、3、5、8、12、24、36、48、72 h,自肘静脉取血4.0 mL,并立即转移至经肝素干燥处理的试管中,离心5 min(3 500 r /min ),将上层血浆移至冻存管(EP管)中,置(-80±3) ℃冰箱中保存待测。服药4 h后统一进低脂标准餐。2周清除期后2组药物互换交叉服用,用药期间和用药后,健康志愿受试者均未出现任何不良反应。
1.2.3溶液的制备 标准溶液(1.00 g/L):精密称取恩替卡韦适量,加甲醇并稀释使成1.00 g/L,摇匀,置冰箱中冷藏备用;精密称取地西泮适量,加甲醇溶解并稀释使成216.00 mg/L,内标溶液,摇匀,置冰箱中冷藏备用。
1.2.4色谱及质谱条件 色谱柱:XTerra MS C18(100 mm×2.1 mm,3.5 μm);流动相:0.1%甲酸水溶液(A相),0.1%甲酸甲醇溶液(B相),洗脱梯度为0.5 min(95%A相)→3 min(25%A相)→4 min(5%A相)→5 min(5%A相)→5.1 min(95%A相);流速:0.3 mL/min;柱温:室温;进样量:5 μL。离子源:ESI;离子极性:正离子(Positive);离子检测方式:多离子反应;离子源温度:650 ℃;离子源喷射电压:5 500 V;气帘气压力:35 psi;碰撞气压力:12 Pa;源内气体1(Gas 1,N2)压力:60 Pa;源内气体2(Gas 2,N2)压力:60 Pa;恩替卡韦离子对m/z278.1→ 152.0,DP:80 V,CE:23V;地西泮离子对m/z285.1→154.0,DP:130V,CE:25V。
1.2.5血浆样品处理方法 精密量取400 μL健康志愿受试者血浆样品,依次加入40 μL内标标准溶液(地西泮108.00 μg/L),10%高氯酸溶液160 μL,涡旋2 min,离心5 min(12 000 r/min),取上清液5 μL进样分析。
1.2.6专属性 按“1.2.5”项条件处理血浆样品,测得空白血浆、 空白血浆外加恩替卡韦标准溶液和内标及健康志愿受试者口服0.5 mg恩替卡韦分散片后0.23 h 的血浆样品的色谱图。恩替卡韦、地西泮(内标)的保留时间分别约为2.89、 4.81 min,空白血浆色谱图中在2.89、4.81 min处无杂质峰出现,因此内源性物质对该药测定无干扰。
1.3血浆标准曲线的绘制 精密量取空白血浆360 μL,加入系列恩替卡韦标准溶液,配置成血浆中恩替卡韦浓度为0.05、0.10、0.50、1.00、5.00、10.00、20.00 μg/L的血浆样品,按“1.2.5”项下样品处理方法操作,经高效液相色谱-串联质谱法测定,以恩替卡韦浓度C为横坐标,恩替卡韦与内标地西泮的峰面积比值Y为纵坐标,按加权最小二乘法进行回归,得恩替卡韦血浆样品标准曲线为Y=0.381C+0.004 23(r=0.996 2),线性范围0.05~20.00 μg/L,最低定量浓度(lowest limit of quantification,LLOQ)为0.05 μg/L。
1.4基质效应与残留考察 考察恩替卡韦0.1、1.0、15.0 μg/L 3 个浓度(含地西泮内标溶液108.00 μg/L)的基质样品溶液峰面积比率和同浓度的标准品溶液峰面积比率的比值。结果表明归一化的基质因子分别为94.92%、94.15%、104.43%,相对标准偏差(relative standard deviation,RSD)分别为12.15%、11.04%、6.49%,RSD值均<15%,符合2015版《中国药典》的规定要求[7]。
分别取最高浓度200.00 μg/L的恩替卡韦溶液40 μL、内标溶液(108.00 μg/L)40 μL进样分析,最高浓度分析完成后,立即进空白样品进行分析,连续测试5次,考察恩替卡韦检测的残留效应。结果残留值小于定量下限的20%,表明无残留影响。
1.5回收率与精密度考察 在空白人血浆中加入不同量的恩替卡韦配制成LLOQ、低、中、高(0.05、0.1、1.0、15.0 μg/L)4种不同浓度的标准血样(含内标浓度为为108 μg/L),按“1.2.5”项下方法处理后进样分析,每个浓度6份,连续测定3 d,并与标准曲线同时进行,求得回收率及日内、日间精密度,见表1。
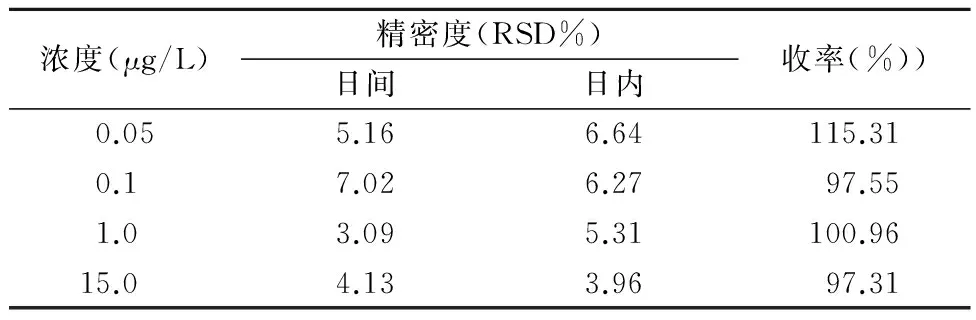
表1 精密度及回收率试验结果Table 1 Results of precision and recovery test (n=6)
1.6稳定性考察 考察了恩替卡韦0.1、1.0、15.0 μg/L 3种浓度血浆样品的冷冻稳定性、冻融稳定性、室温放置稳定性、进样器中室温放置稳定性。结果3种浓度冷冻稳定性RSD分别为4.23%、1.42%、2.33%,冻融稳定性RSD分别为6.42%、2.58%、3.19%,室温放置稳定性RSD分别为4.34%、3.13%、2.26%,进样器中室温放置稳定性RSD分别为2.78%、2.7%、6.36%。以上符合生物制品测定要求[7],表明在各条件下稳定性良好。
1.7质量控制 分别配置恩替卡韦血浆浓度为0.10、1.0、15.0 μg/L的血浆样品作为质控样品,按“1.2.5”项下方法处理后,均匀分布于8个分析批的受试者血浆样本中。每批质控样品及受试者血浆样本的血药浓度数据用随行标准曲线求得。根据该分析批中质控样品测定结果的准确度评价该批受试者血浆样本的测定结果是否可被接受。结果表明,本研究所有质控样品的测定结果其RSD均在15%(低浓度在20%)范围内。8批次低、中、高浓度质控样本测定结果的准确度均符合要求,表明所有受试者血浆样本测定结果可信。
1.8统计学方法 应用 SPSS 19.0统计软件处理数据,计量资料比较采用独立样本的t检验。P>0.05为差异无统计学意义。
2 结 果
2.1药-时曲线 20例健康男性受试者单次口服试验制剂恩替卡韦分散片和参比制剂恩替卡韦片后,所得不同时间的平均血药浓度-时间曲线,结果显示,试验制剂达峰时间和血药峰浓度略短于和大于参比制剂,见图1。
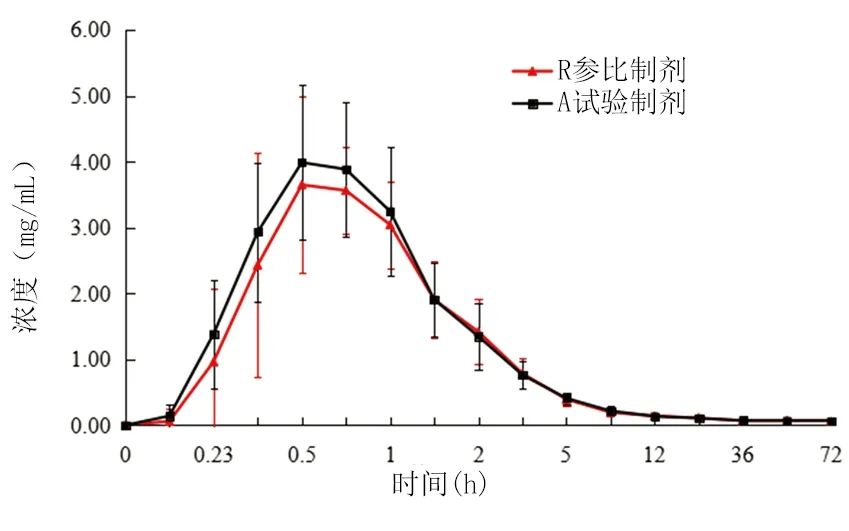
图1 20例受试者单剂量口服试验制剂和参比制剂后恩替卡韦的平均药-时曲线Figure 1 Mean plasma concentration-time curves of entecavir in 20 volunteers after oral dose of test and reference preparations
2.22组药代动力学参数比较 应用DAS3.2.7软件对每位健康志愿受试者的血药浓度-时间数据进行拟合,计算主要药代动力学参数,即血药峰浓度(maximum concentranion,Cmax)、达峰时间(Tmax)、半衰期(t1/2)、 0~72 h药-时下曲线面积(AUC0~72 h)、药物从零时间至所有原形药物全部消除时间的药-时曲线下总面积(AUC0~∞)。结果显示试验制剂组与参比制剂组在Cmax、Tmax、t1/2、AUC0~72 h、AUC0-∞差异均无统计学意义(P>0.05),见表2。
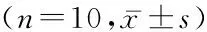
表2 20例受试者单剂量口服试验制剂与参比制剂后恩替卡韦的药动学参数Table 2 Pharmacokinetic parameters of entecavir in 20 volunteers after oral dose of test and reference preparations
90%可信区间分别为Cmax94.8%~111.2%,Tmax80.8%~125.0%,AUC0~72 h为97.9~107.2%。测得受试者单次口服试验制剂恩替卡韦分散片和参比制剂恩替卡韦片的平均相对生物利用度为(103.3±14.0)%,表明2制剂符合生物等效的假设。
3 讨 论
3.1研究方法依据 恩替卡韦人体生物等效性研究已有文献报道[8-10],但本研究是按照中国药典(2015版)“生物样品定量分析方法验证指导原则”的要求,建立了HPLC-MS/MS法测定人血浆中恩替卡韦血药浓度,同时依据中国药典(2015版)“药物制剂人体生物利用度和生物等效性试验指导原则”,以中美上海施贵宝制药有限公司生产的恩替卡韦片作为参比制剂,评价2种恩替卡韦制剂在健康人体的生物等效性,以期为临床合理应用恩替卡韦分散片提供参考依据。
3.2分析方法的建立 本研究建立了血浆中恩替卡韦的HPLC-MS/MS测定法,血浆中的杂质不干扰样本的测定,专属性好,标准曲线线性范围为0.05~20.00 μg/L,线性关系良好;LLOQ、低、中、高(0.05、0.1、1.0、15.0 μg/ L)4种不同浓度的批内和批间精密度均<15.0%;相对回收率在97.31%~115.31%之间;恩替卡韦血浆样品-80~25 ℃下反复冻融3次,-80 ℃下冻存2个月,室温放置4 h及高氯酸处理后的检测样品进样器放置8 h等条件下的稳定性良好,均符合生物样品分析要求;采取沉淀蛋白法处理的血浆样品,LLOQ为0.05 μg/ L,能满足本研究药动学数据的需要。
3.3取血时间的设计 研究文献取血点为0、10、20、30、45 min,1、1.5、2、3、5、8、12、24、36、48、72、96 h[8-14]。一个完整的血药浓度-时间曲线包括吸收相、分布相和消除相,一般在血药浓度-时间曲线达峰前至少有4个取血点,本研究经预试验tmax为30 min,故将30 min前的10 min、20 min 2个时间点改为7 min、14 min、21 min 3个时间点满足血药浓度-时间曲线峰前取血点分布要求;根据“药物制剂人体生物利用度和生物等效性试验指导原则”采样时间中:“无论药物的半衰期多长,采样周期不必长于72 h”[4],预试验结果96 h血药浓度已经是Cmax的1/20,因此取血时间设计为0、7、14、21、30、45 min,1、1.5、2、3、5、8、12、24、36、48、72 h,缩短了受试者抽血的时间,提高了受试者的依从性,满足了恩替卡韦人体生物等效性研究要求。
3.4达峰时间 试验制剂与参比制剂的tmax分别为(0.66±0.19) h和(0.70±0.29) h, 试验制剂与参比制剂的tmax差异无统计学意义(P>0.05),但试验制剂tmax比参比制剂的tmax略有提前,符合分散片遇水迅速崩解形成均匀混悬液的特点,与普通片剂相比,崩解时间短、吸收快,体现了分散片的特征。
[1] 李玉宇,郜玉峰,马双双,等.恩替卡韦治疗谷丙转氨酶低于2倍正常值上限的慢性乙型肝炎患者的疗效观察[J].安徽医药,2016,20(6):1189-1191.
[2] 申恩华,杜娟,王立红,等.血清HBsAg滴度反映恩替卡韦治疗乙型肝炎肝硬化合并原发性肝癌患者病毒应答的临床价值[J].中国医药导报,2016,13(17):86-88,92.
[3] Zheng MH,Shi KQ,Dai ZJ,et al. A 24 week,parallel-group,open-label,randomized clinical trial comparing the early antiviral efficacy of telbivudine and entecavir in the treatment of hepatitis B e antigen-positive chronic hepatitis B virus infection in adult Chinese patients[J]. Clin Ther,2010,32(4):649-658.
[4] Guo JJ,Li QL,Shi XF,et al. Dynamics of heaptitis B virus resistance to entecavir in a nucleoside/nucleotide-naive patient[J]. Antivir Res,2009,81(2):180-183.
[5] 李虹庆,赵具也,罗刚,等.恩替卡韦与拉米夫定抗病毒治疗重型乙型肝炎临床对照研究[J].中国药业,2016,25(6):35-36,37.
[6] 王海英,郭瑞臣.国产与进口恩替卡韦的比较研究[J].药学研究,2014,33(2):100-102.
[7] 国家药典委员会.中华人民共和国药典.2015年版(四部)[S]北京:中国医药科技出版社,2015:356-362,363-368.
[8] 丁莹,宋敏,史香龄,等.恩替卡韦分散片的健康人体相对生物利用度及生物等效性研究[J].中国新药杂志,2010,19(7):590-594.
[9] 郝光涛,梁宇光,曲恒燕,等.健康志愿者恩替卡韦分散片的生物等效性研究[J].中南药学,2010,8(9):669-672.
[10] Zhang D,FU Y,Gale JP,et al. A sensitive method for the determination of entevavir at picogram per milliliter level in human plasma by solid phase extraction and high-pHLC-MS/MS[J]. J Pharm Biomed Anal,2009,49(4):1027-1033.
[11] 林琳,马忠英,乔逸,等.2种恩替卡韦制剂的人体生物等效性研究[J].中国药房,2011,22(46):4358-4361.
[12] 郝光涛,李媛媛,何世学,等.HPLC-MS/MS联用技术定量测定人血浆中恩替卡韦[J].质朴学报,2010,31(4):252-256.
[13] 陈倩,杜光.几种恩替卡韦制剂的稳定性研究[J].中国药学杂志,2012,47(14):1129-1133.
[14] 宋敏,丁莹,杭太俊,等.马来酸恩替卡韦片的健康人体药动学[J].中国新药杂志,2013,22(9):1064-1067.
(本文编辑:许卓文)
Studies on human pharmacokinetics and bioequivalence of entecavir dispersible tablet
MA Jie, DONG Zhan-jun*, BAI Wan-jun, SONG Hao-jing, WU Yin, ZHI Xu-ran
(Department of Pharmacy, Hebei General Hospital, Shijiazhuang 050051, China)
ObjectiveTo evaluate the bioequivalence of 2 kinds of entecavir preparations in human bodies.MethodsThe randomized,crossed-over study was conducted in 20 healthy volunteers. After A single oral dose of entecavir hydrochloride test and reference preparations(containing 0.5 mg entecavir), the drug levels in plasma were determined by high performance liquid chromatography-tandem mass spectrometry. The pharmacokinetic parameters were calculated with DAS 3.2.7 software, then bioequivalence of the two preparations was evaluated.ResultsThe peak concentrations Cmax, tmax, t1/2and AUC0-72 hof the 2 formulations were (4.41±1.02) μg/L and (4.36±0.89) μg/L, (0.66±0.19) h and (0.70±0.29) h, (46.11±32.32) h and (61.28±93.69) h, (13.31±2.63) μg·h-1·L-1and (13.10±2.20) mg·h-1·L-1, respectively.ConclusionThe results show that the two formulations are bioequivalent. The relative bioavailability of entecavir is (103.3±14.0)%.
entecavir; bioavailability; HPIC-MS/MS
2016-10-12;
2016-12-05
马杰(1962-),女,山东青岛人,河北省人民医院主任药师,理学学士,从事临床药理学研究。
*通讯作者。E-mail:13313213656@126.com
R969.1;R978.7
A
1007-3205(2016)12-1441-04
10.3969/j.issn.1007-3205.2016.12.019
