楸树种子油中活性成分及其粕中黄酮类成分研究
2016-12-26徐洪宇朱丽蓉董娟娥黄晓华
徐洪宇 朱丽蓉 董娟娥 雷 鸣 黄晓华 尉 芹
(西北农林科技大学林学院1,杨凌 712100)(西北农林科技大学生命科学学院2,杨凌 712100)
楸树种子油中活性成分及其粕中黄酮类成分研究
徐洪宇1朱丽蓉2董娟娥2雷 鸣2黄晓华1尉 芹1
(西北农林科技大学林学院1,杨凌 712100)(西北农林科技大学生命科学学院2,杨凌 712100)
以楸树种子为研究对象,利用气相色谱-质谱(GC-MS)联用法测定楸树种子油中脂肪酸及植物甾醇组成,高效液相色谱(HPLC)法测定种子油中生育酚含量,同时采用高效液相色谱-质谱(HPLC-MS)联用法对脱脂种粕中黄酮类成分进行分析,并考察其抗氧化活性。结果表明,楸树种子油中共检测出11种脂肪酸,其中以亚油酸、a-亚麻酸和油酸为主,不饱和脂肪酸质量分数为87.37%;含有菜油甾醇(21.52%)、豆甾醇(4.43%)和β-谷甾醇(74.05%);含有132.58 mg/100 g的生育酚,其中γ-生育酚(88.84 mg/100g)比α-生育酚(43.74 mg/100g)含量高近2倍。种粕中含有4种黄酮类成分,其总黄酮含量为9.39 mg/g DW,具有一定的抗氧化活性。本研究为充分利用楸树种子资源,提高楸树的经济价值和开发高效植物源类抗氧化剂提供参考。
楸树种子 脂肪酸 植物甾醇 生育酚 黄酮类成分
心脑血管疾病是人类首位死因,其发生和发展与血脂代谢紊乱有关,而饮食,尤其是脂肪酸的摄入量及种类影响血脂代谢。研究表明,植物油中的α-亚麻酸和亚油酸可以预防冠状动脉心脏病、高血压和降低胆固醇等作用[1]。而植物甾醇也可以降低冠状动脉硬化、心脏病和癌症等疾病的发病率[2-3]。随着人们生活水平的提高和饮食结构的变化,饮食的科学化和营养化越来越受到人们的重视。
楸树(Catalpabungei)是紫葳科(Bignoniaceae)梓属(Catalpa)植物。研究报道,同为梓属植物的梓树种子油中脂肪酸对大鼠患结肠癌具有一定的抑制作用[4]。而关于楸树种子油中的活性成分,如脂肪酸、植物甾醇、生育酚,以及脱脂后种粕的成分及其活性鲜有报道。
本研究对楸树种子油中的脂肪酸、植物甾醇和生育酚进行分析,并进一步对其提取油后的种粕中黄酮类成分及其抗氧化活性进行研究,旨在为新型油料的开发,保健品或药品等的研制及楸树植物资源的可持续利用提供参考。
1 材料与仪器
1.1 材料与试剂
楸树种子于2013年10月下旬采集于西北农林科技大学树木园,在60 ℃下烘干,粉碎,过20目筛备用。
1,1-二苯-2-苦基肼(DPPH)、2,2-二氮-双(3-乙基苯并噻唑-6-磺酸)铵盐(ABTS)、芦丁(≥99%)、α-生育酚(≥96%)及γ-生育酚(≥96%):美国Sigma公司;2,6-二叔丁基对甲酚(BHT):国药集团化学试剂有限公司;氢氧化钾(AR),三氯乙酸(AR),铁氰化钾(AR),三氯化铁(AR),过硫酸钾(AR),甲醇(AR),石油醚(AR)等:天津市博迪化工有限公司。
1.2 仪器与设备
ISQ型气相色谱-质谱仪:美国赛默飞世尔公司;LTQ Orbitrap XL ETD型液相色谱-质谱仪:美国赛默飞世尔公司;Breeze 2系列高效液相色谱仪:美国沃特世公司;RE-52AA型旋转蒸发器:上海亚荣生化仪器厂;FW100型高速万能粉碎机:天津市泰斯特仪器有限公司。
2 试验方法
2.1 种子油提取
取10 g种子粉,用150 mL石油醚(沸程60~90 ℃)在65 ℃下索氏提取器提取,提取液在40 ℃旋转薄膜蒸发浓缩,种子油在30 ℃真空干燥箱内干燥至恒重,按下式计算种子含油率。无溶剂的种子油装入棕色密封容器中,置-80 ℃冰箱,分析种子油中的脂肪酸、植物甾醇和生育酚。
2.2 脂肪酸分析
参考Nehdi等[5]方法进行脂肪酸甲酯化。取待测种子油100 mg于试管中,加入2 mL正己烷和1 mL 0.5 mol/L的KOH-CH3OH溶液,70 ℃水浴20 min,加入1 mL 2 mol/L HCl-CH3OH溶液,70℃水浴30 min,5 000 r/min,上层溶液为脂肪酸甲酯,供GC-MS分析。
GC-MS分析,色谱柱:HP-INNOWax,60 m×0.25 mm(id)×0.25 μm毛细管柱;柱温(程序升温)初始80 ℃保持2.5 min,然后以15 ℃/min的升温速率升至210 ℃,再以5 ℃/min的升温速率升至240 ℃共运行15 min;进样口温度:250 ℃;检测器温度:330 ℃;分流比30:1;进样量:1 μL;氮气流速:1.0 mL/min。
质谱条件:离子源温度为230 ℃,传输线温度250 ℃,电子轰击能量为70 eV,扫描范围(质荷比,m/z)为40~460 amu。
2.3 植物甾醇分析
样品制备采用Chirinos等[6]报道方法。称取100 mg种子油置于试管中,加入1 mol/L KOH-CH3CH2OH溶液1 mL后加盖密封,在水浴70 ℃下反应60 min,加1 mL去离子水和5 mL正己烷,密封后剧烈振摇3 min,静置,将上层正己烷萃取液浓缩,取出2 μL,供GC-MS测定。
GC-MS分析,色谱柱:HP-5,30 m×0.25 mm(id)×0.25 μm毛细管柱;柱温(程序升温)初始180 ℃,以15 ℃/min的升温速率升至280 ℃,保持25 min;进样口温度:250 ℃;检测器温度:280 ℃;不分流进样;进样量:1 μL;氮气流速:1.0 mL/min。
质谱条件:离子源温度为230 ℃,传输线温度250 ℃,电子轰击能量为70 eV,扫描范围(质荷比,m/z)为40~550 amu。
2.4 生育酚分析
生育酚含量采用HPLC分析。色谱柱:C18(4.6 mm×250 mm,5 μm);流动相:甲醇-水(80∶20),混匀、脱气;紫外检测器(2489型)检测波长:298 nm;进样量5 μL;流速:1.0 mL/min;柱温:30 ℃。
2.5 脱脂种粕中黄酮类化合物提取及分析
取脱脂种粕粉5 g,加100 mL甲醇溶液,70 ℃水浴下回流提取3次,每次1 h。合并提取液,40 ℃下旋转薄膜蒸发浓缩,真空干燥,-80 ℃下保存待用。
2.5.1 总黄酮含量检测
采用陈凌等[7]的方法,略做修改。吸取1.0 mL甲醇提取液(10.0 mg/mL)置于10 mL试管中,加入4.0 mL甲醇及0.3 mL 5% NaNO2;6 min后,加入0.3 mL 10%Al(NO3)3;6 min后,再加入4 mL 1.0moL/L NaOH,甲醇0.4 mL,放置15 min,以甲醇溶液为空白,于510 nm处测吸光值。以芦丁溶液(0.50~4.00 mg/mL)作为标品,以每g种粕干重中含有的芦丁毫克数计,单位为mg/g DW。
2.5.2 HPLC-ESI-MS分析黄酮类物质
脱脂种粕中黄酮类物质的组成采用HPLC-MS分析,色谱柱:C18(7.8 mm×150 mm,10 μm),流动相0.1%甲酸水(A)~0.1%甲酸乙腈(B),梯度洗脱:0~3 min,5%(B);3~5 min,5%~10%(B);5~10 min,10%~20%(B);10~15 min,20%~50%(B);15~20 min,50%~90%(B);20~22 min,90%~95%(B);22~23 min,95%~5%(B);23~25 min,5%(B),柱温40 ℃,流速0.3 mL/min,进样量10 μL。
质谱条件:电喷雾离子源(ESI),负离子模式下采集,质量数扫描范围m/z:200~1 500,喷雾电压为4.5 kV,毛细管温度为275 ℃,鞘气流量和辅助气流量分别为30 L/min和5 L/min,毛细管电压4 V,使用XCALIBUR软件对数据进行处理。
2.6 抗氧化活性分析
2.6.1 DPPH自由基清除率分析
采用Brandwilliams等[8]的方法,略作修改。取1 mL 1.0 mg/mL种粕提取液,加入3 mL 0.2 moL/L的DPPH自由基甲醇溶液,混匀后加入4.0 mL甲醇溶液,室温下避光静置反应30 min后,在波长517 nm下测定吸光值,以甲醇溶液代替种粕提取液作为空白,按下式计算样品对DPPH自由基的清除率。
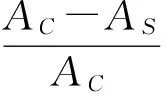
式中:AC为空白样品的吸光值,AS为不同浓度样品的吸光值。
2.6.2 ABTS+·清除率测定
采用Re等[9]的方法,并作适当修改。配制ABTS+·储备液:用2.45 mmol/L的过硫酸钾溶液溶解ABTS,配成7 mmol/L ABTS储备液,在室温、避光条件下静置12~16 h。配制ABTS+·测定液:将ABTS+·储备液以磷酸盐缓冲液(10 mmol/L,pH 7.4)稀释,使其吸光度在734 nm波长处达到0.700±0.020。取4 mL ABTS+·测定液,加入1.0 mg/mL种粕提取液(40 μL),振荡30 s,静置6 min,测定反应后734 nm波长处的吸光值,以甲醇溶液代替种粕提取液作为空白,按下式计算样品对ABTS+·的清除率:
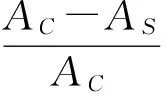
式中:AC为空白样品的吸光值,AS为不同浓度样品的吸光值。
2.6.3 还原力测定
采用Tung等[10]的方法。取1.0 mg/mL种粕提取液0.5 mL,加入0.5 mL 0.2 mol/L磷酸盐缓冲液(pH 6.6)和0.5 mL 1 mg/mL铁氰化钾溶液,50 ℃水浴中放置20 min。加入0.5 mL 10 mg/mL三氯乙酸溶液,混均后在3 000 r/min离心20 min。取上清液1.0 mL加入1.0 mL蒸馏水和0.2 mL 0.1 mg/mL三氯化铁,反应10 min后测定700 nm波长处吸光值,以甲醇溶液代替种粕提取液作为空白。
2.7 统计分析
采用SPSS16.0软件进行ANVOA统计分析,每个样品测定重复3次,结果以平均值±标准差表示。
3 结果与分析
3.1 楸树种子油及活性成分分析
采用有机溶剂提取楸树种子油,其含油率高达25.9%。种子油经甲酯化后,采用GC-MS分析,得到所含脂肪酸甲酯的总离子流图,见图1。各色谱峰相应的质谱图经人工解析及谱库检索定性,并采用色谱峰面积归一化法确定其各脂肪酸成分的相对百分含量,结果见表1。由表1可知,种子油中主要脂肪酸为亚油酸、α-亚麻酸、油酸等,共有11种组分。其中亚油酸含量最高(47.29%),其次为α-亚麻酸

图1 GC-MS分析种子油中脂肪酸组成
(22.29%)和油酸(14.52%)。饱和脂肪酸(SAFA)、单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)的相对质量分数分别为12.63%、16.02%和71.35%。可见,楸树种子中脂肪酸种类较多,且不饱和脂肪酸含量较高,总不饱和脂肪酸高达87.37%以上。同时,楸树种子油中n-6和n-3多不饱和脂肪酸的比值为2.19。
对楸树种子油中3种植物甾醇(β-谷甾醇、菜油甾醇和豆甾醇)利用GC-MS检测发现(表2),β-谷甾醇在3种植物甾醇中所占比例最高(74.05%),菜油甾醇含量次之(21.52%),豆甾醇所占比例含量最低(4.43%)。
HPLC分析种子油中α-生育酚和γ-生育酚的含量发现(表3),100 g种子油中含有α-生育酚43.74 mg及γ-生育酚88.84 mg,γ-生育酚含量比α-生育酚含量高出2倍。

表1 楸树种子油中脂肪酸组成

表2 楸树种子油中植物甾醇和生育酚含量
3.2 种粕中总黄酮含量及抗氧化活性
植物中的黄酮类化合物是一类天然的抗氧化剂,对自由基具有良好的清除能力。对楸树脱脂种粕中总黄酮含量及其抗氧化活性分析发现(表3),楸树脱脂种粕中总黄酮含量为9.39 mg/g,高于已报道的药西瓜(CitrulluscolocynthisSchrad)脱脂种渣中总黄酮含量(2.41 mg/g)[5]和西瓜(CitrullusvulgarisSchrad)脱脂种渣中总黄酮含量(0.55 mg/g)[11]。可见,楸树脱脂种粕中黄酮类化合物含量丰富,可作为提取黄酮类化合物的来源。
将种粕提取物浓度配制为1.0 mg/mL,并以同浓度的BHT为阳性对照,测定其还原力、DPPH自由基清除率及ABTS自由基清除率。由表3可知,种粕提取物具有一定的抗氧化活性,但其活性较BHT低。主要原因是提取物为未经纯化的混合物,黄酮类物质在提取物中所占的比例较小。

表3 脱脂种粕中总黄酮含量及抗氧化活性
3.3 种粕中黄酮类化合物组成分析
利用HPLC-ESI-MS分析楸树种粕中黄酮类成分,在线获取样品中各化合物离子的质荷比,结合保留时间,二级质谱信息及相关文献,对主要黄酮类成分进行分析和鉴定(表4)。峰3在13.98 min时的一级质谱图给出[M-H]-(m/z301.28)可知该物质的相对分子质量为302,对应的二级质谱图中主要的碎片离子m/z285.96为失去·CH3得到,母离子m/z301.28通过RDA裂解生成m/z150.93,符合黄酮类的裂解规律,结合文献可知为槲皮素[12]。而峰2(13.20 min)的碎片离子中均含有m/z301.28、179.06、150.93等碎片峰,则峰2中有槲皮素结构。峰2的准分子离子峰[M-H]-为m/z463.24,对应的碎片离子m/z301.01为失去1个质量数为162(葡萄糖Glc)的中性碎片后生成的离子[M-H-162]-,峰2为槲皮素-3-O-葡萄糖苷。15.44 min的峰4的准分子离子峰[M-H]-为m/z285.28,碎片离子m/z257.03、151.05结合文献可知峰7为山奈酚[13]。保留时间为13.09 min的峰1准分子离子峰[M-H]-为m/z447.22,碎片离子m/z285.05为失去1个质量数为162(葡萄糖Glc)的中性碎片后生成的离子[M-H-162]-,以及碎片离子m/z257.03,峰1为山萘酚-3-O-葡萄糖苷。

表4 黄酮类成分的HPLC-ESI-MS分析
4 讨论与结论
楸树为高大落叶乔木,是我国传统栽培的优质用材和名贵园林观赏树种,据资料显示,全国每年有大量的楸树种籽产量,若不加以利用,会造成资源浪费。本研究发现,楸树种子的含油率(25.9%)高于大豆(16.5%~17.5%)[14]、棉花种子(15%~24%)、葡萄籽(6%~20%)和橄榄(20%~25%)[15],是含油率相对较高的资源,但楸树种子油有无毒性,其色、香、味如何,以及能否作为食用油,仍需进一步研究证实。
亚油酸和α-亚麻酸是人体自身不能合成的必需脂肪酸,分别为n-6和n-3长链多不饱和脂肪酸。膳食脂肪酸结构组成不当是当前心血管疾病发病率越来越高的重要原因之一,尤其是n-6与n-3的比例对人体脂代谢和免疫功能有较大影响。研究表明,n-6/n-3>10时,乳腺癌发生率为27.43%,而当n-6/n-3<3时,乳腺癌发生率则下降到22.83%[16]。WHO和FAO推荐n-6/n-3比值应为(5~10)∶1[17]。而事实上在多数工业国家,人们的膳食结构中,n-6/n-3这一比值达到15∶1[18]。楸树种子油中n-6/n-3值为2.19,与油菜(2.22)接近,而远小于橄榄油(7.69)、大豆油(6.66)和核桃油(5.0)[19]。楸树种子油含有较高的不饱和脂肪酸,同时具有与油菜接近的n-6/n-3值,又不含容易引起血管壁增厚及心肌脂肪沉积等对人体有害的芥酸,理论上应更加适合食用或用于食品加工。
β-谷甾醇、菜油甾醇和豆甾醇是植物甾醇的主要成分。植物甾醇在人体内不能自身合成,而只能从食物中摄取。楸树种子油中β-谷甾醇含量高于菜油甾醇和豆甾醇,这一结果与已报道的柑橘[20]和印加果[21]中β-谷甾醇含量最高一致。生育酚俗称维生素E,为脂溶性维生素。根据甲基的数目和位置的不同分为α-、β-、γ-和δ-共4种形式。4种结构生育酚具有各自独特的生理活性,其中α-生育酚的生理活性最强,γ-生育酚的抗氧化能力最强[22]。楸树种子油中γ-生育酚含量高于α-生育酚,这与已报道的小麦胚芽油[23]和柑橘[20]中α-生育酚含量高于γ-生育酚含量不同,可见不同植物中生育酚的含量有较大差异。种子油中不饱和脂肪酸极易氧化,从而影响油脂食用品质,同时,氧化后的产物对人体产生的毒性及影响远大于它的保健作用,而楸树种子油中含有β-谷甾醇和丰富的γ-生育酚等抗氧化成分,能够显著抑制油脂氧化、保护油脂风味和延长油脂储藏时间。
综上所述,楸树种子具有较高的出油率,其油中含有丰富的对人体有益的活性成分,并含有较低的n-6/n-3比值,其脱脂种粕中含有4种黄酮及苷类化合物,并具有一定的抗氧化活性。楸树种子具有独特的生理活性和较好的保健功效,可作为可持续利用的一种优质食用油及功能油脂的原料,具有一定的开发潜力。
[1]Simopoulos A P. Evolutionary aspects of diet: The omega-6/omega-3 ratio and the brain [J]. Molecular Neurobiology, 2011, 44(2): 203-215
[2]Awad A B, Chinnam M, Fink C S, et al. Beta-sitosterol activates fas signaling in human breast cancer cells [J]. Phytomedicine, 2007, 14(11): 747-754
[3]Takeshita M, Katsuragi Y, Kusuhara M, et al. Phytosterols dissolved in diacylglycerol oil reinforce the cholesterol-lowering effect of low-dose pravastatin treatment [J]. Nutrition Metabolism and Cardiovascular Diseases, 2008, 18(7):483-491
[4]Suzuki R, Yasui Y, Kohno H, et al. Catalpa seed oil rich in 9t,11t,13c-conjugated linolenic acid suppresses the development of colonic aberrant crypt foci induced by azoxymethane in rats [J]. Oncology Reports, 2006, 16(5): 989-996
[5]Nehdi I A, Sbihi H, Tan C P, et al. Evaluation and characterisation of citrullus colocynthis (l.) schrad seed oil: Comparison with helianthus annuus (sunflower) seed oil [J]. Food Chemistry, 2013, 136(2): 348-353
[6]Chirinos R, Zuloeta G, Pedreschi R, et al. Sacha inchi (plukenetia volubilis): A seed source of polyunsaturated fatty acids, tocopherols, phytosterols, phenolic compounds and antioxidant capacity [J]. Food Chemistry, 2013, 141(3): 1732-1739
[7]陈凌, 张俐勤, 张建群, 等. 马齿苋乙醇提取物对3种植物油的抗氧化活性比较[J]. 中国粮油学报, 2014, 29(4): 68-71
[8]Brandwilliams W, Cuvelier M E, Berset C. Use of a free-radical method to evaluate antioxidant activity [J]. Food Science and Technology-Lebensmittel-Wissenschaft & Technologie, 1995, 28(1): 25-30
[9]Re R, Pellegrini N, Proteggente A, et al. Antioxidant activity applying an improved abts radical cation decolorization assay [J]. Free Radical Biology and Medicine, 1999, 26(9-10): 1231-1237
[10]Tung Y T, Wu J H, Huang C Y, et al. Antioxidant activities and phytochemical characteristics of extracts from acacia confusa bark [J]. Bioresource Technology, 2009, 100(1): 509-514
[11]Ademiluyi A O, Oboh G. Changes in phenolic content and antioxidant property of melon seed (citrullus vulgaris schred) fermented to produce “ogiri”: A local condiment [J]. Rivista Italiana Delle Sostanze Grasse, 2011, 88(4): 265-272
[12]Barnes J S, Schug K A. Oxidative degradation of quercetin with hydrogen peroxide using continuous-flow kinetic electrospray-ion trap-time-of-flight mass spectrometry [J]. Journal of Agricultural and Food Chemistry, 2014, 62(19): 4322-4331
[13]Zhang W D, Wang X J, Zhou S Y, et al. Determination of free and glucuronidated kaempferol in rat plasma by lc-ms/ms: Application to pharmacokinetic study [J]. Journal of Chromatography B-Analytical Technologies in the Biomedical and Life Sciences, 2010, 878(23): 2137-2140
[14]Yoshida H, Hirakawa Y, Murakami C, et al. Variation in the content of tocopherols and distribution of fatty acids within soya bean seeds (glycine max l.) [J]. Journal of Food Composition and Analysis, 2003, 16(4): 429-440
[15]Matthaus B, Ozcan M M. Quantitation of fatty acids, sterols, and tocopherols in turpentine (pistacia terebinthus chia) growing wild in turkey [J]. Journal of Agricultural and Food Chemistry, 2006, 54(20): 7667-7671
[16]Goodstine S L, Zheng T Z, Holford T R, et al. Dietary (n-3)/(n-6) fatty acid ratio: Possible relationship to premenopausal but not postmenopausal breast cancer risk in us women [J]. Journal of Nutrition, 2003, 133(5):1409-1414
[17]Sugano M, Hirahara F. Polyunsaturated fatty acids in the food chain in japan [J]. American Journal of Clinical Nutrition, 2000, 71(1): 189S-196S
[18]Simopoulos A P. The importance of the ratio of omega-6/omega-3 essential fatty acids [J]. Biomedicine & Pharmacotherapy, 2002, 56(8): 365-379
[19]Belitz H D, Grosch W. Food Chemistry (2nd ed.) [M]. Berlin, Germany:Springer-Verlag, 1999
[20]Gornas P, Siger A, Seglina D. Physicochemical characteristics of the cold-pressed japanese quince seed oil: New promising unconventional bio-oil from by-products for the pharmaceutical and cosmetic industry [J]. Industrial Crops and Products, 2013, 48: 178-182
[21]Chirinos R, Zuloeta G, Pedreschi R, et al. Sacha inchi (plukenetia volubilis): A seed source of polyunsaturated fatty acids, tocopherols, phytosterols, phenolic compounds and antioxidant capacity [J]. Food Chemistry, 2013, 141(3): 1732-1739
[22]Fazio A, Plastina P, Meijerink J, et al. Comparative analyses of seeds of wild fruits of rubus and sambucus species from southern italy: Fatty acid composition of the oil, total phenolic content, antioxidant and anti-inflammatory properties of the methanolic extracts [J]. Food Chemistry, 2013, 140(4): 817-824
[23]Frank J, Chin X W D, Schrader C, et al. Do tocotrienols have potential as neuroprotective dietary factors? [J]. Ageing Research Reviews, 2012, 11(1): 163-180.
Research on the Active Ingredients of Seed Oil of Catalpa Bungei and Flavonoid Constituent of Seed Meal
Xu Hongyu1Zhu Lirong2Dong Juan’e2Lei Ming3Huang Xiaohua1Wei Qin1
(College of Forestry, Northwest A&F University, Yangling 712100)(College of Life Sciences, Northwest A&F University, Yangling 712100)
The research measured the composition of the fatty acid and phytosterol, the contents of tocopherol for seeds ofCatalpabungeiusing the gas chromatography-mass spectrometry (GC-MS), high performance liquid chromatography (HPLC) method respectively. At the same time, the paper also analyzed the flavones ingredients of defatted meal by the high performance liquid chromatography-mass spectrometry (HPLC-MS) method and investigated its antioxidant activity. The results indicated that there were eleven kinds of fatty acids which exist in the seed oil ofCatalpabungei. And most of these were linoleic acid, a-linoleic acid and oleic acid and the unsaturated fatty acid was 87.93 percent to all of fatty acids. The ratio of alcohols ingredient was 21.52, 4.43 and 74.05 percent for campesterol, stigmasterol and β-sitosterol, respectively. The weight of tocopherol was 132.58 mg/100 g and the γ-tocopherol(88.84 mg/100 g) was almost as twice as α-tocopherol (43.74 mg/100 g). The meal contained four kinds of flavone ingredients and total flavonoids contents were 9.39 mg/g DW, which had certain antioxidant activity. This paper aims to establish theoretical foundation for using the seed resource ofCatalpabungei. Completely, it helped to increase the economic values ofCatalpabungeiand to exploit for efficient antioxidant originated from plants.
seeds ofCatalpabungei, fatty acid, plant sterols, tocopherol, flavone ingredients
Q949.93
A
1003-0174(2016)02-0064-06
国家林业公益性行业科研专项(201204603)
2014-06-28
徐洪宇,女,1985年出生,博士,植物资源化学
董娟娥,女,1968年出生,教授,植物次生代谢与调控天然产物提取分离与开发利用工
尉芹,女,1958年出生,教授,林产化工和植物资源开发利用
