原料体系对高水分组织蛋白纤维化结构的影响
2016-12-26解铁民李哲滨张英蕾张莉莉李家磊卢淑雯
洪 滨 解铁民 高 扬 李哲滨 张英蕾 张莉莉 李家磊 卢淑雯
(黑龙江省农业科学院食品加工研究所,哈尔滨 150086)
原料体系对高水分组织蛋白纤维化结构的影响
洪 滨 解铁民 高 扬 李哲滨 张英蕾 张莉莉 李家磊 卢淑雯
(黑龙江省农业科学院食品加工研究所,哈尔滨 150086)
以大豆分离蛋白和小麦蛋白作为混合原料,在大豆分离蛋白质量分数为0%~75%,含水量为60%~70%,挤压温度为120~160 ℃条件下,采用三因素五水平试验设计方法,挤压加工高水分组织化蛋白。根据不同溶液体系中的蛋白质溶解度,确定溶解化学键类型,分析各种化学键交联对组织蛋白分子结构的影响。结果表明,以大豆分离蛋白和小麦蛋白为原料挤压生产高水分组织蛋白的过程中,二硫键是维持蛋白聚合物结构的主要化学键。水分含量与二硫键形成正相关,但与疏水键形成负相关;而温度在140~150 ℃之间组织蛋白产品形成大量化学键,组织化程度高;原料体系中分离蛋白含量增加有利于组织蛋白结构中各化学键的形成,可改善蛋白产品形成良好的组织化状态。
高水分组织蛋白 分子间作用力 化学键 组织化
高水分挤压蛋白是以大豆分离蛋白、谷朊粉、低温脱脂豆粕等为主要原料,采用单(双)螺杆挤压技术进行高温短时加工,生产出含水量在50%以上的蛋白制品,呈现类似肉的纤维结构。采用高湿挤压加工技术生产的高水分大豆蛋白制品,富含氨基酸、低胆固醇含量、有“肉感”纤维等优点,是理想的大豆食品,成为大豆深加工的重点发展方向。为了发挥挤压加工工艺优势,学者们已从工艺优化[1]、设备设计[2]和挤压产品品质评价[3]等方面进行了系统研究工作,目前的重点集中在挤压过程中蛋白内部发生的化学反应上,揭示挤压加工过程中高水分组织蛋白纤维化结构形成机理,从本质上控制大豆挤压高湿产品的质量。
研究发现高水分挤压大豆蛋白形成的高分子聚合物溶解度低,氢键、疏水键和二硫键的存在及它们的共同作用是稳定聚合物组织化结构的主要作用[4];在花生蛋白高水分挤压加工过程中,蛋白质疏水作用和氢键存在对其组织化结构的形成起主要作用,其次是二硫键[5];以大豆分离蛋白为原料的高水分挤压研究结果表明,疏水作用与二硫键交互作用、氢键与二硫键交互作用对维持产品结构有较大的影响[6]。在低水分挤压蛋白方面,通过研究大豆蛋白热塑挤压组织化结构的形成规律,推断肽键可能是导致大豆蛋白产生组织化结构形成的主要原因[7];也有学者认为蛋白产品中含有的硫化物形成的二硫键对其组织化结构的形成起主要作用[8]。以大豆浓缩蛋白(SPC)为原料挤压加工组织化蛋白,分析表明挤压组织化改性过程中发生二硫键交联反应、静电作用和疏水作用,这些力作用形成了组织化蛋白的空间构象[9]。在以小麦粉为原料进行挤压,二硫键是形成蛋白聚合物的主要化学键,模头温度为120~160 ℃时,二硫键形成,且在160 ℃数量最多[10]。
由于挤压加工条件不同、原料中蛋白质种类差异及含水量变化,挤压蛋白内化学键对其组织化结构形成的作用机理迥然不同。本研究以大豆分离蛋白和小麦蛋白混合料作为原料,挤压加工高水分组织蛋白,研究混合原料中2种蛋白不同配比量和挤压温度对挤压蛋白状态影响规律,揭示化学键对挤压蛋白结构形成作用机理,内容上突破了多以单一原料为对象,不能合理解释混合原料对化学键形成规律的局限性。研究结果为优化高水分蛋白挤压加工工艺提供参考。
1 材料与方法
1.1 材料
大豆分离蛋白:蛋白质质量分数83.72%,含水量7.17%,灰分7.00%,脂肪1.00%,购自哈高科大豆食品有限责任公司。
小麦蛋白:蛋白质质量分数72.33%,含水量8.90%,脂肪1.25%,灰分1.50%,购自陕西聚梁食品有限公司。
1.2 方法
1.2.1 挤压设备
挤压设备为同向双螺杆挤压机(ClextralEV25,法国),螺杆直径(D)为25 mm,长径比24∶1,有6节套筒,可单独控制每节的温度,挤压机配有1个直径4 mm的模孔。从出口端到喂料端螺杆配置(见图1)依次为0.5D/5.5D(螺距/螺杆长)单线螺杆,0.25D/0.25D变线元件,1D/1D(90°)搅拌元件,0.5D/0.5D反向螺杆,0.5D/1.5D双线螺杆,0.75D/10.5D双线螺杆,1D/1D双线螺杆,1.25D/3.75D双线螺杆。带有冷却水的模头,可使模头温度控制在60 ℃, 出口宽7 cm、高4 mm。

注:A=0.25D/0.25D;B=1D/1D(90°);C=0.5D/0.5D;D=0.5D/1.5D;E=1D/1D。
图1 挤压机螺杆配置图
1.2.2 样品准备与数据采集
启动挤压机,调节到试验设计表中确定的挤压条件,调节液体喂料量以满足产品不同的含水量,待每个参数下机器稳定20 min后,开始记录挤压机扭矩、变速箱压力、模头温度等数据。设定自动采集数据时间间隔为每秒1次,取稳定后30 s的数据,计算其平均值。对各条件下样品,取0.5~1.0 kg,用真空包装机封装后,放入冰箱内保藏(4 ℃),用于后续化学键交联分析。
1.2.3 蛋白溶解度及化学键交联的分析
浸提溶液制备:① 0.035 mol/L pH 7.6,磷酸盐缓冲液(P);② pH 7.6,P+1.5%(m/V)SDS(S);③ pH 7.6,P+0.1 mol/L 2-ME(M);④ pH 7.6,P+8 mol/L尿素(U);⑤ pH 7.6,P+1.5% SDS+0.1 mol/L 2-ME;⑥ pH 7.6,P+8 mol/L尿素+1.5% SDS;⑦ pH 7.6,P+8 mol/L 尿素+0.1 mol/L 2-ME;⑧ pH 7.6,P+8 mol/L 尿素+0.1 mol/L 2-ME+1.5% SDS。
蛋白质浸提:依据文献[5-6,11]的方法进行。取0.50 g原料和冻干挤出样品蛋白质粉末(浸提前测定水分含量),分别加入10 mL上述不同的浸提溶液中,室温下在水平振荡摇床上浸提2 h,然后4 500 r/min离心10 min,取上清液。向沉淀物中再次加入10 mL溶液,重复上述浸提和离心程序,合并2次上清液于50 mL容量瓶中,用蒸馏水定容。原料和挤出样品中总的蛋白质含量采用凯氏定氮法测定,上清液中可溶性蛋白含量,采用Lowery法测得(测定波长750 nm)。试验重复3次,结果用平均值。蛋白质溶解度(g/g)=溶出蛋白含量/样品中总蛋白含量。
依据Hager[8]提出的方法,如表1所示,根据不同溶液体系中的蛋白质溶解度,确定溶解化学键类型及各种化学键交联。

表1 不同溶液体系中的溶解化学键类型
1.3 试验设计
以大豆分离蛋白和小麦蛋白2种原料作为混合料,改变混合料中2种原料比例,构成不同的混合料中分离蛋白的含量(见表2)。
试验设计采用三因素五水平正交设计(水平编码见表2),3个因素为分离蛋白含量、含水量和套筒温度。试验数据用统计分析软件SPSS18进行数据处理,采取线性模型逐步回归和向后回归方法建立最优模型,剔除P<0.05水平的不显著项。
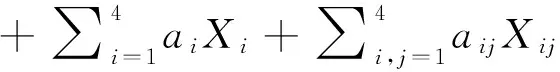
式中:Y(蛋白溶解度)是响应值,X1=分离蛋白含量,X2=含水量,X3=套筒温度。

表2 试验水平编码表
2 结果与分析
2.1 蛋白溶解度
2.1.1 不同溶解体系下的蛋白溶解度
SDS、尿素和巯基乙醇试剂分别破坏蛋白质分子之间的疏水键、氢键和二硫键[7-8,12-13],23组挤压样品分别置入不同化学键破坏试剂中,其溶解度结果见表3。各组样品在磷酸缓冲液(P)中的溶解度都很低,表明原料在经高温、高压、高剪切挤压处理后发生显著变性,形成了大分子量聚合物。从表3中可以看出各组样品在P+M、P+S+M、P+U+M、P+U+M+S中的溶解度显著高于其他试剂中的溶解度,这表明以大豆分离蛋白和小麦蛋白为原料生产的组织蛋白中,二硫键对维持其结构的贡献最大,主要取决于二硫键是蛋白聚合物中主要的共价键[13],能够保证挤压蛋白结构稳定性[14-15]。从S和U试剂中较低的溶解度可以看出,氢键和疏水键对组织化蛋白结构的作用相对较小,但各样品在U+S+M混合试剂中的溶解度最大,说明疏水作用、氢键和二硫键的交互作用对维持挤压产品结构的贡献最大。

表3 各试剂中蛋白质的溶解度
注:表中各数值均为蛋白溶解度,单位为%。
2.1.2 含水量对蛋白化学交联的影响
不同含水量挤压组织化产品中各种化学键作用结合的蛋白质溶解度见图2,结果表明各试剂中蛋白质的溶解度随着含水量的增加而增加。含水量对二硫键影响最大,在60%的水分条件下形成的二硫键含量最低,M试剂中的溶解度仅为29.59%,从表4中也可以看出含水量对二硫键的影响差异显著(P<0.01),可以推断含水量在60%以下时,二硫键的形成数量会减少。在低水分条件下,S试剂中的溶解度升高,表明含水量降低引起蛋白内部的疏水键数量增加,含水量下降一定程度,疏水键有可能取代二硫键,成为维持蛋白结构主要的化学键。
图2结果表明,M+S、M+U、M+U+S中溶解度没有显著变化(P>0.01),表明含水量会显著影响氢键、二硫键、疏水键的形成,但对二硫键、疏水与二硫键之间的交互作用影响较小。由此可知,含水量有助于蛋白质的伸展变性,而对共价键、非共价键及其二者交互作用的影响存在差异。
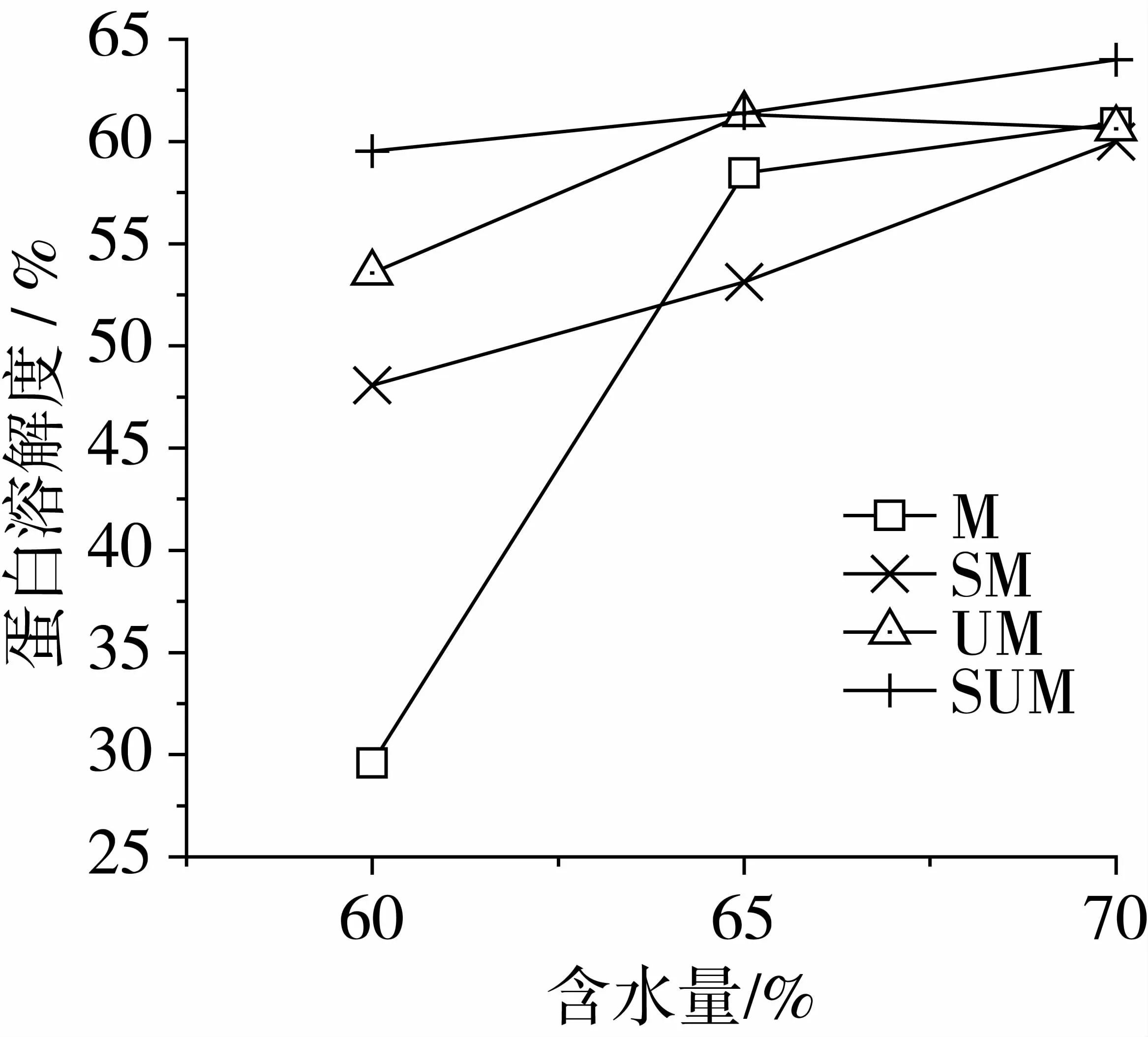
图2 挤压组织蛋白的溶解度随着含水量的变化
2.1.3 温度对蛋白化学交联的影响
图3是不同挤压温度挤压组织化产品中各种化学键作用结合的蛋白质溶解度。从图3可以看出,套筒温度在120~130 ℃之间,挤压蛋白产品在各试剂中的溶解度无显著差别,表明此段温度对挤压组织蛋白产品中各化学键的形成没有显著影响;套筒温度在130~160 ℃之间,4种试剂引起的挤压组织蛋白溶解度差异显著,表明组织蛋白内部形成大量化学键,但在150 ℃温度下挤压得出的产品形成更多化学键[16],挤压蛋白的组织化程度优于其他温度水平[17]。

图3 挤压组织蛋白的溶解度随着温度的变化
2.1.4 原料中分离蛋白添加量对蛋白化学交联的影响
图4是在各种化学键作用下挤压组织蛋白的溶解度随着原料中分离蛋白含量的变化。从图中可以得到,随着混合原料中分离蛋白含量的增加,在不同试剂作用下的挤压组织蛋白质的溶解度明显上升,表明增加大豆分离蛋白添加量可以促进组织蛋白产品中产生多种化学键,且大豆分离蛋白比小麦蛋白更有利于形成高水分组织化蛋白组织化结构,这样在原料中可以增加大豆分离蛋白的含量改善蛋白产品组织化状态。由表4还可以看出,大豆分离蛋白含量与二硫键、疏水作用、氢键组合(SUM)和疏水作用、二硫键组合(SM)正相关程度最大,其次是二硫键作用,最低是二硫键与氢键组合(UM)。
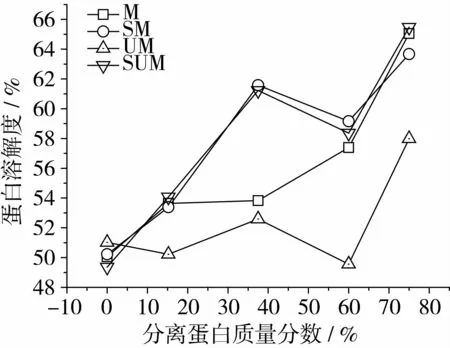
图4 挤压组织蛋白的溶解度随着原料中分离蛋白含量的变化
2.2 化学键交联的分析
从表4中化学键的回归系数显著性可以看出,二硫键只与含水量成正相关,疏水作用只与含水量成负相关,氢键与此体系下的3个因素差异都不显著。在2种分子作用力相互作用方面,疏水作用与二硫键的共同作用与含水量成正相关;二硫键和氢键的共同作用与含水量和含水量与温度的交互作用成负相关;分离蛋白浓度、含水量、温度对二硫键与氢键的共同作用具有显著影响,相关系数0.803。

表4 化学键的回归系数
注:X1:分离蛋白含量,X2:含水量,X3:温度。ns:没有显著性差异。显著性差异*P<0.05,**P<0.01,***P<0.001。
挤压组织蛋白中分子间的作用力(疏水作用+二硫键+氢键)与分离蛋白浓度、含水量、温度、分离蛋白和含水量的交互作用、分离蛋白和温度的交互作用成正相关,与分离蛋白平方项和温度平方项成负相关。模型的相关系数为0.867,因此通过这3个因素可以很好地描述在此原料体系下分子间作用力的影响情况,方程拟合较好。
3 结论
二硫键是维持蛋白聚合物结构的主要化学键,二硫键溶解液中的蛋白溶解率最高,几乎都在50%以上。原料中大豆分离蛋白的质量分数在60%~70%之间时,蛋白溶解度更高,接近于65%,可以推断,增加原料中大豆分离蛋白的含量可以促进组织蛋白结构中各化学键的形成。物料含水量对分子内部化学键的影响非常明显,含水量降低会限制二硫键的形成,但可以促进疏水键的形成。套筒温度在140~150 ℃之间组织蛋白产品形成的化学键最多,组织化程度最好。
[1]Cheftel J C,Kitagawa M,Queguiner C. New Protein Texturization Process by Extrusion Cooking at High Moisture Levels[J]. Food Reviews Tnt,1992,8(2):235-275
[2]Lin S,Hsieh F,Huff H E.Texture and Chemical Characteristics of Soy Protein Meat Analog Extruded at High Moisture[J]. Journal of Food Science,2002(65):264-269
[3]Noguchi A.Extrusion Cooking of High Moisture Protein Foods[J].American Association of Cereal Chemists,1989,343-372
[4]Lin S,Huff H E,Hsieh F.Texture and Chemical Characteristics of Soy Protein Meat Analog Extruded at High Moisture[J].Journal of Food Science,2000,65(2):264-269
[5]魏益民,张汆,康立宁.花生蛋白高水分挤压组织化过程中的化学键变化[J].中国农业科学,2007,40(11):2575-2581
[6]陈锋亮.植物蛋白挤压组织化过程中水分的作用[C].2010,68-79
[7]Burgess L D,Stanley D.W.A Possible Mechanism for Thermal Texturization of Soybean Protein[J].Canadian Institute of Food Science and Technology Journal,1976,9(4):228-23
[8]Hager D. F.Effects of Extrusion upon Soy Concentrate Solubility[J].Journal of Agricultural and Food Chemistry,1984,32(2):293-296
[9]陈莹,俞俊棠,沈蓓英,等.蛋白质的挤压组织化改性—大豆蛋白在挤压过程中的物理、化学变化[J].华东理工大学学报,1994,20(6):758-76
[10]Li M.Relationship of the Extrusion Temperature and the Solubility and Disulfide Bond Distribution of Wheat Proteins[J].Journal of Agriculture Food Chemistry,1997,45:2711-2717
[11]魏益民,康立宁,张波,等.高水分大豆蛋白组织化生产工艺和机理分析[J]. 农业工程学报,2006,22(10):193-197
[12]Jeunink, J,Cheftel J C.Chemical and Physiochemical Changes in Field Bean and Soy Proteins Texturized by Extrusion[J].Food Science,1979,44:1322-1325,1328
[13]Neumann P E,Jasberg B K,Wall J S.Unique Textured Products Obtained by Coextrusion of Corn Gluten Meal and Soy Flour[J].Cereal Chemistry,1984,61:439-445
[14]Li M,Lee T-C.Effect of Extrusion Temperature on Solubility and Molecular Weight Distribution of Wheat Flour Proteins[J].Agriculture Food Chemistry,1996,44:763-768
[15]Rhee K C,Kuo C K,Lusas E W. Texturization. In: Cherry,JP,editor. Protein Functionality in Foods[J]. Washington, D.C.: American Chemistry Social,1981:51-88
[16]Lin S,Hsieh F,Huff H E.Texture and Chemical Characteristics of Soy Protein Meat Analog Extruded at High Moisture[J].Journal of Food Science,2000,65(2):264-269
[17]魏益民,赵多勇,康立宁,等.操作参数对组织化大豆蛋白产品特性的影响[J].中国粮油学报,2009,24(6):20-25.
The Effect of Raw Material System on Fibrous Structure for High Moisture Textured Protein
Hong Bin Xie Tiemin Gao Yang Li Zhebin Zhang Yinglei Zhang Lili Li Jialei Lu Shuwen
(Food Processing Institute, Heilongjiang Academy of Agricultural Sciences, Haerbin 150086)
To determine the effect of raw material system on fibrous structure for high moisture textured protein, soy isolate protein (SPI) and wheat protein selected as mixed material, a combination experimental method with three factors and five levels was employed to extrude and process high moisture tissue protein in the conditions of the SPI ratio of 0%~75%, moisture content of 60%~70% and extruded temperature of 120~160 ℃. According to the solubility of protein in the solution system, types of chemical bonds were determined to analyze the effect of chemical bonds linkage on the molecular structure of tissue protein. The results showed that disulfide bond plays the key role to maintain the polymeric structure of protein in the extrude processing of high moisture tissue protein from the mixture of SPI and wheat protein. Moisture content in raw material had a positive correlation with the formation of disulfide bond and the negative correlation with the formation of hydrophobic bond. Extruded temperature in 140~150 ℃ resulted in a large number of chemical bonds to improve the tissue degree within tissue protein. The addition of SPI in raw material favored in the formation of chemical bonds within tissue protein to improve protein product and form satisfactory texturization state.
high moisture meat analogue,intermolecular bond,chemical bonding,degree of texture.
S52
A
1003-0174(2016)02-0023-05
黑龙江省青年基金(QC2020118),黑龙江省自然基金重点项目(20080101)
2014-07-04
洪滨,男,1984年出生,助理研究员,硕士,农产品加工
卢淑雯,女,1968年出生,研究员,博士,农产品加工
