花生蛋白亚基结构与性质研究进展
2016-12-26石爱民刘红芝
刘 丽 石爱民 刘红芝 胡 晖 王 强
(中国农业科学院农产品加工研究所 农业部农产品加工综合性重点实验室,北京 100193)
花生蛋白亚基结构与性质研究进展
刘 丽 石爱民 刘红芝 胡 晖 王 强
(中国农业科学院农产品加工研究所 农业部农产品加工综合性重点实验室,北京 100193)
花生蛋白是一种营养与功能兼具的优良植物蛋白,具有广阔应用前景,花生蛋白结构与功能性质研究是一直以来的研究热点。主要总结了花生蛋白亚基组成与分类、结构与性质,对花生蛋白亚基分离纯化、结构特点、构效关系等方面研究进展进行了详细论述,同时指出目前该研究领域中存在的问题,并对未来的研究重点进行展望,为高品质花生蛋白产品的进一步开发利用提供参考。
花生蛋白 亚基 结构 性质
花生蛋白是一种营养与功能兼具的优良植物蛋白,富含多种人体必需氨基酸,如精氨酸、谷氨、天门冬氨酸[1],能促进脑细胞发育和增强记忆力。与其他植物蛋白相比,花生蛋白的消化率很高,消化系数可达90%,易被人体吸收利用,食用后不会产生食用大豆蛋白常出现的腹胀、嗝气现象,因此花生蛋白的生物学效价比大豆高得多,被认为是一种极具开发潜力的乳糖不耐症消费者的蛋白基料和牛乳等动物奶类的代替品。而花生蛋白组成复杂,不同组分具有相似但不完全一致的氨基酸组成和序列,并且来自于不同品种的花生蛋白主要组分的含量比例、亚基组成或氨基酸构成也有所差别,因此不同花生蛋白在食品体系中物化功能特性的表现不同[2-3]。在目前我国动物性蛋白资源严重不足而难以满足人们需要的情况下,开展对花生蛋白结构与功能性质的研究,开发和利用花生蛋白资源,对于改善人们的膳食结构具有极其重要的意义。
从更小结构单元亚基角度研究蛋白结构与功能性质关系是目前研究热点,如在大豆蛋白亚基方面,日本京都大学Utsumi团队从90年代开展大豆蛋白及其组成亚基的氨基酸序列、重组表达、结构表征到蛋白理化与功能性质、品质改良等,研究较为系统[4-9]。美国Nilsen团队则主要从基因角度研究大豆蛋白组成亚基氨基酸序列、基因性质等[10-12]。国内学者研究了大豆蛋白、主要组分及组成亚基的分离纯化、结构表征、热聚集行为和界面、乳化性质等[13-14]。
而目前对花生蛋白的基础研究主要集中在花生过敏原结构鉴定[15]、结构变化[16]等,也有对花生浓缩蛋白[17]、花生分离蛋白[18]、花生蛋白组分及其不同比例[19-20]与功能性质的关系,未深入到花生蛋白更小的组成单元亚基的角度上,研究花生蛋白特定亚基与性质构效关系,有助于从基因工程的角度来调控加工品质,成为花生蛋白加工的新趋势。
1 花生蛋白组成
种子贮藏蛋白按溶解性分为盐溶性蛋白、水溶性蛋白、酸或碱溶性蛋白、醇溶性谷蛋白[4]。花生贮藏蛋白中约10%为水溶性蛋白,其余90%为盐溶蛋白,主要由花生球蛋白、伴花生球蛋白Ⅱ和伴花生球蛋白Ⅰ组成,而按沉降系数又分为14S(花生球蛋白)、7.8S(伴花生球蛋白Ⅰ)、2S(伴花生球蛋白Ⅱ)[3]。
2 花生蛋白亚基组成与结构
2.1 亚基组成
花生蛋白亚基组成复杂,研究者对于花生球蛋白的研究结论不太一致。杨晓泉等[21]采用双向聚丙烯酰胺电泳分析花生球蛋白由5个亚基组成,分别为2个酸性亚基(40.5 ku、pI 5.5,37.5 ku、pI 5.0)和3个碱性亚基(19.5 ku、pI 6.3,pI 7.0, pI 8.2)。采用高效液相色谱法对花生球蛋白亚基的数目、种类,以及花生球蛋白的种类(花生球蛋白Ⅰ、花生球蛋白Ⅱ)进行分析,确定花生球蛋白和花生球蛋白Ⅱ均含有12个亚基,而花生球蛋白Ⅰ含有6个亚基,并且在除去SDS后,花生球蛋白Ⅰ的亚基可以重新聚合[22]。采用SDS-PAGE对170份花生品种蛋白组成进行分析,得出花生球蛋白主要包括4个条带(如图1 中区域 2和区域 3),分子质量为40.5、37.5、35.5、23.5 ku,伴花生球蛋白I主要包括3个条带(如图1 中区域 4),分子质量为15.5、17、18ku,伴花生球蛋白Ⅱ主要包括1个条带(如图1 中区域 1),分子质量为61 ku,并通过分析花生蛋白亚基相对含量变异性得出35.5ku亚基变异系数高达55%[23-24]。
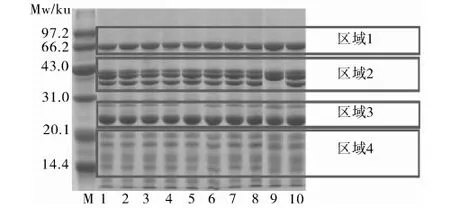
注:区域1~区域4分别代表伴球蛋白Ⅱ,球蛋白酸性亚基,球蛋白碱性亚基,伴球蛋白Ⅰ。
图1 花生蛋白亚基组成
2.2 亚基氨基酸组成
因为氨基酸的差异可能影响亚基在某些理化和功能特性,因此分析氨基酸组成与类型有助于解释理化和功能性质差异。Yamada T等[25]研究得出花生球蛋白亚基S1,S2,S3有大量的精氨酸和谷氨酸,除了S2中未发现甲硫氨酸残基以及缬氨酸含量较S1高以外,其他氨基酸组成相似,而将纯化花生球蛋白亚基混合后进行透析,得出混合后蛋白是以六聚体形式存在,也有相同的亚基组成,这些六聚体与天然球蛋白相比有更强的耐热性,其自组装成六聚体后有更稳定的四级结构。
3 花生蛋白亚基纯化
很多蛋白质需要多亚基协同来完成复杂的生物功能,分离纯化特定蛋白质的亚基是研究其结构与功能的前提,对于在亚基水平上深入研究花生蛋白功能机理,提高花生蛋白应用范围具有十分重要的意义。
3.1 色谱法
在众多的蛋白质分离方法中,色谱应用最多、也最为广泛,在绝大部分蛋白质的纯化过程中都作为精制的手段。色谱技术甚至能够分离物化性质差别很小的化合物。当混合物中各组成部分的化学或物理性质十分接近,而其他分离技术很难或根本无法将其分离时,色谱技术愈加显示出其优越性。
3.1.1 离子交换层析法
离子交换色谱(ion exchange chromatography,IEC)以离子交换树脂作为固定相,树脂上具有固定离子基团及可交换的离子基团,当流动相带着组分电离生成的离子通过固定相时,组分离子与树脂上可交换的离子基团进行可逆变换。在各类色谱技术中,离子交换色谱的使用频率最高。
Koppelman S.J.等[26]采用离子交换层析法分离纯化Arah 3亚基,收集到5个组分,得出Arah3由分子质量为14~45 ku的一系列多肽(亚基)组成。离子交换色谱法在大豆蛋白亚基分离纯化上应用较多,如在还原条件下利用阴离子交换层析,分离纯化得到的大豆球蛋白碱性亚基及酸性亚基共4种,产率最高可达23.93%,纯度最高为92.00%[27],而通过离子交换层析和金属螯合亲和层析相结合的方法,可得纯化β-伴大豆球蛋白α’亚基纯度为85.62%,α亚基纯度为96.71%,β亚基纯度为96.08%[14]。也有研究者用DEAE-纤维素柱层析、Sephadex G-75 凝胶过滤、FPLC-Superdex 75 HR 10/30 柱层析等纯化方法,得到了电泳纯的藻红蓝蛋白α-亚基,光化学活性达93%[28]。
3.1.2 高效液相色谱法
采用反相高效液相色谱成功分离纯化花生球蛋白各亚基,其中花生球蛋白和花生球蛋白II均含有相同亚基组成,而花生球蛋白I含有6个亚基[22]。Dong K等[29]采用反相高效液相色谱法从面包和小麦中纯化出小麦蛋白高分子谷蛋白亚基,可依次洗脱出高分子质量谷蛋白亚基,顺序为1Ax>1Bx>1Dx>1By>1Dy。该方法优点为分辨率高,可重复性强,缺点为制备量少,因此一般适合于亚基组成鉴定。
3.2 等电聚焦法
等电聚焦法可用于分离纯化等电点有一定差异的蛋白亚基。Yamada T等[22]采用在蔗糖梯度溶液(含有6 mol尿素和0.2 mol巯基乙醇)中进行等电聚焦的方法分离出6种花生球蛋白亚基,这些亚基(S1到S6)等电点分别为5.8、6.0、6.3、7.1、7.4、8.3,在球蛋白中的所占比例为2.5∶2.2∶2.6∶1.6∶1.1∶1.0。黄峙等[30]采用液相等电聚焦分离纯化藻蓝亚基,经2次聚焦得到高纯度的活性α和β亚基。郑树贵等[31]利用β-巯基乙醇切断大豆球蛋白酸性亚基和碱性亚基之间二硫键的基础上,根据2类亚基等电点的差异分离纯化大豆球蛋白亚基,利用这一方法分离得到的酸性亚基和碱性亚基纯度分别为92.69%和80.76%,酸性亚基和碱性亚基的净产率分别达31.40%和41.64%。该方法是一种简单有效、价格低廉的酸性和碱性亚基分离方法。
3.3 硫酸铵沉淀法
硫酸铵沉淀法是利用蛋白质盐析效应对花生蛋白组分进行分离的一种方法。通过使用饱和度为0%~40%的硫酸铵使花生球蛋白从溶液中析出,在硫酸铵饱和度为60~80%时,可以使伴花生球蛋白析出[32]。日本Utsumi团队采用该从亚基缺失大豆品种中纯化出仅含有1种亚基的球蛋白A3B4以及A5A4B3亚基,纯度大于90%[9]。
4 亚基对花生蛋白性质的影响研究进展
贮藏蛋白是氨基酸和肽类的主要来源。从很大程度上,蛋白能影响种子的营养和功能性。蛋白亚基结构和含量会影响蛋白的凝胶性、乳化性、溶解性等加工性质,明确不同条件下亚基结构和性质变化有助于更好地探究蛋白结构与功能关系研究。
4.1 花生蛋白亚基与原料特性关系研究
不同基因型花生蛋白质的亚基构成不同,目前多集中在从品种改良角度研究花生蛋白亚基构成与分布。通过对珍珠豆型花生福花5号荚果期花生各主要器官蛋白质亚基组分分布特点及相关性分析,福花5号的根、叶、仁的蛋白质中,除仁80 ku和仁的33 ku亚基与其他亚基无相关外,其他亚基间均有相关[33]。
4.2 花生蛋白亚基与加工品质关系研究
4.2.1 亚基组成对蛋白功能性质的影响
不同亚基组成的蛋白其功能性质差异显著,如花生球蛋白的热稳定性要好于伴花生球蛋白,且其变性协同性也好于伴花生球蛋白。通过选择不同亚基组成品种比较蛋白功能性质差异,并采用统计学方法分析花生品质与蛋白溶解性、凝胶性关系,得出23.5 ku亚基与花生蛋白凝胶性呈显著关系,37.5 ku亚基、23.5 ku亚基、15.5 ku亚基与花生蛋白溶解性呈显著关系[24]。在大豆蛋白亚基研究中也有类似的结论,大豆蛋白α’和β亚基与质构特性的硬度、黏聚性呈极显著负相关,而α亚基与硬度呈极显著负相关[14],通过比较不同亚基组成的7S蛋白凝胶性,得出凝胶硬度排序为缺失α’>7S>缺失α,缺失α’大豆蛋白与7S相比更适宜制作豆腐[34]。与伴大豆球蛋白αα’亚基相比,β亚基有更高的热稳定性,其制备的黏结剂也显示出更强的阻水性[37]。张吉民等[38]报道了烫漂处理花生后,缺失与不缺失36 ku的花生其种皮分离的程度差异显著。
4.2.2 蛋白亚基结构变化与性质关系
不同处理手段会导致花生蛋白亚基不同程度的解离和聚集,从而表现出不同功能性质。赵谋明等[39]报道花生分离蛋白亚基在常温pH 2.5的条件下处理10 min后开始酸解,且随着时间的延长高分子质量的亚基逐渐减少;在离子强度0~0.1 mmol/L时酸解程度较大,当离子强度大于0.2 mmol/L 时,酸解作用被抑制。同样,酸处理可促使大豆11S 亚基发生解离,在 pH 2.0和 pH 3.0 的条件下,大豆分离蛋白分子间正静电排斥力较强,大豆分离蛋白中亚基发生解离;在 pH 1.0 的条件下,大豆分离蛋白之间的静电排斥力较弱,蛋白与蛋白之间发生了聚集,形成了聚集体,亚基未发生解离[40]。
超高压处理对伴花生球蛋白Ⅱ结构有显著性影响,在200 MPa时,伴花生球蛋白Ⅱ相对含量由原来的16.0%降为2.6%,条带基本缺失[41],伴球蛋白凝胶硬度也急剧降低。对花生球蛋白进行超高压处理后,发现依靠微弱的非共价相互作用而形成的花生球蛋白多聚体离解成低聚体或单体,溶液变得均匀,互相摩擦阻力减小,导致蛋白质溶液剪切稀化现象[19]。
TG酶处理花生球蛋白和伴球蛋白后,花生球蛋白的酸性亚基容易发生交联反应,而碱性亚基不容易受到TG酶交联的影响,而伴花生球蛋白比花生球蛋白更易在TG酶的催化下发生分子间或分子内交联反应,认为是花生球蛋白稳定、紧凑的空间构象,使催化时TG酶较难与花生球蛋白的内部分子相接触,从而限制了亚基分子间的交联反应[42]。在Alcalse酶作用下,蛋白亚基敏感程度顺序为酸性亚基(39 ku和 42 ku)>花生伴球蛋白(66 ku)>花生球蛋白的碱性亚基(22 ku)[43]。
5 问题及展望
5.1 存在的问题
单个蛋白亚基或亚基对与花生蛋白凝胶性和溶解性存在着统计上的相关性,但用这种相关性结果预测花生蛋白品质还存在很大的局限性。
5.1.1 花生蛋白组成亚基结构与理化、功能性质研究不完善。花生蛋白亚基的种类较多,而且组合也较为复杂,花生球蛋白组成亚基分离纯化已有初步研究,还不够系统,未进行结构以及后续性质的系统研究,另外,对于花生蛋白中另一个主要成分伴球蛋白及亚基的研究还未涉及。
5.1.2 花生蛋白中不同亚基组成和含量、蛋白空间构象均会对功能性产生影响,但是花生蛋白组成亚基结构和性质还不系统,还未从更小结构单元亚基角度上研究蛋白聚集行为和凝胶化过程。
5.1.3 加工中花生蛋白亚基结构变化以及其他成分相互作用机制有待研究,如生产加工过程中蛋白亚基与多糖、油脂间的相互作用。
5.2 展望
食品原料结构的改变会影响食品的物性、品质和风味,食品加工中经常通过改变物料的结构而研发新的工艺和产品。为了更好地探索不同花生蛋白组分与加工品质的密切程度,以便准确地把握和调控花生蛋白功能性质,有必要在以下几方面深入开展研究。
5.2.1 建立花生蛋白亚基分离纯化方法,系统研究各亚基氨基酸组成与类型,丰富花生蛋白结构基础数据。
5.2.2 采用现代仪器分析手段,对加工处理中花生蛋白亚基结构变化进行表征,明确花生蛋白亚基构效关系。
5.2.3 结合实际生产加工过程,明确在肉制品等加工真实体系中花生蛋白与油脂、多糖的相互作用及性质变化。
[1]Batal A,Dale N, Cafe M. Nutrient composition of peanut meal[J]. J. Appl. Poult. Res., 2005, (14):254-257
[2]王丽,王强,刘红芝,等. 花生加工特性与品质评价研究进展[J]. 中国粮油学报, 2011,26(10):122-128
Wang L, Wang Q, Liu H Z,et al. Research process on peanut processing characteristics and quality evaluation[J]. Journal of the Chinese Cereal and Oils Association, 2011,26(10):122-128
[3]王强.花生加工品质学[M]. 北京:中国农业出版社,2013
Wang Q. Peanut processing quality[M].Beijing: Chinese Agriculture Press, 2013
[4]Mary R G, Tandang S, Evelyn M T, et al. Molecular design of seed storage proteins for enhanced food physicochemical properties[J]. Annu. Rev. Food Sci. Technol, 2011(2):59-73
[5]Prak K, Nakatani K, Katsube-Tanaka T, et al. Structure-function relationships of soybean proglycinins at subunit levels[J]. Journal of Agricultural and Food Chemistry, 2005, 53(9): 3650-3657
[6]Maruyama Y, Maruyama N, Mikami B,et al. Structure of the core region of the soybean β-conglycinin α′ subunit[J].Acta Crystallographica Section D-biological Crystallography, 2004 (60):289-297
[7]Adachi M, Kanamori J, Masuda T, et al. Crystal structure of soybean 11S globulin: glycinin A3B4 homohexamer[J]. Proceedings of the National Academy of Sciences, 2003, 100(12): 7395-7400
[8]Maruyama N, Prak K, Motoyama S, et al. Structure-physicochemical function relationships of soybean glycinin at subunit levels assessed by using mutant lines[J]. Journal of Agricultural and Food Chemistry,2004, 52(26): 8197-8201
[9]Utsumi S, Maruyama N, Satoh R, et al. Structure-function relationships of soybean proteins revealed by using recombinant systems[J]. Enzyme and Microbial Technology, 2002, 30(3): 284-288
[10]Rapp W D, Nielsen N C. Characterization of soybean vegetative storage proteins and genes[J]. Theoretical and Applied Genetics, 1990,79(6):785-92
[11]Scallon B, Nielsen N C. Identification and characterization of DNA clones encoding group-II glycininsubunits[J]. Theoretical and Applied Genetics, 1985, 70(5):510-519
[12]Staswick P E, Nielsen N C. The amino acid sequence of the A2B1a subunit of glycinin[J].Journal of Biological Chemistry, 1984,259(21):13424-13430
[13]Wang J M, Yang X Q , Yin S W , et al. Growth kinetics of amyloid-like fibrils derived from individual subunits of soy β-conglycinin[J]. Journal of Agricultural and Food Chemistry, 2011, 59(20):11270-11277
[14]Yuan D B, Wei M, Yang X Q. An Improved Isolation Method of Soy b-Conglycinin Subunits and Their Characterization[J] . J Am Oil Chem Soc, 2010(87):997-1004
[15]Petersen A, Kull S, Rennert S, et al. Peanut defensins: Novel allergens isolated from lipophilic peanut extract[J]. Journal of Allergy and Clinical Immunology, 2015, 136(5):195-1301
[16]Blanc F, Vissers Y M, Adel-Patient K, et al. Boiling peanut Ara h 1 results in the formation of aggregates with reduced allergenicity[J]. Molecular nutrition & food research, 2011, 55(12): 1887-1894
[17]Wu H W, Wang Q, Ma T Z. Comparative studies on the functional properties of various protein concentrate preparations of peanut protein[J]. Food Research International, 2009(42): 343-348
[18]He X H, Liu H Z, Liu L , et al. Effects of high pressure on the physicochemical and functional properties of peanut protein isolates[J]. Food Hydrocolloids, 2014(36):123-129
[19]黎鹏. 动态超高压微射流技术对花生球蛋白功能性质的影响及其机理研究[D].南昌:南昌大学, 2008
Li P, Influence of high pressure microfluidization on the functional properties of arachin and its mechanism study[D]. Nanchang: Nanchang University, 2008
[20]Feng X L, Liu H Z, Liu L, et al. Effects of transglutaminase crosslinking on physicochemical properties of arachin-rich and conarachin-rich[J]. Food Research International, 2014, 62:84-90
[21]杨晓泉, 陈中, 赵谋明. 花生蛋白的分离及部分性质研究[J]. 中国粮油学报, 2001, 16(5): 25-28
Yang X Q, Chen Z, Zhao M M.Separation And Characterization of Peanut Proteins[J]. Journal of the Chinese Cereal and Oils Association,2001, 16(5): 25-28
[22]Bhushan R, Agarwal R. Reversed-phase high-performance liquid chromatographic, gel electrophoretic and size exclusion chromatographic studies of subunit structure of arachin and its molecular species[J].Biomed. Chromatogr. 2006, 20: 561-568
[23]杜寅,王强,刘红芝,等.不同品种花生蛋白主要组分及其亚基相对含量分析[J],食品科学,2013(9) : 42-46
Du Y, Wang Q, Liu H Z, et al.Major Protein Fractions and Subunit Contents in Peanut from Different Cultivars[J], Food Science, 2013(9) : 42-46
[24]Wang L, Liu H, Liu L, et al. Protein Contents in Different Peanut Varieties and Their Relationship to Gel Property[J]. International Journal of Food Properties, 2014, 17:7, 1560-1576
[25]Yamada T, Albara S, Morita Y.Isolation and some properties of Arachinsubunits[J]. Agri. Biol.Chem,1979,43(12):2563-2568
[26]郑树贵,曹松屹,孙泽威,等. 天然大豆球蛋白亚基的分离纯化[J]. 中国油料作物学报,2009(1):75-80
Zheng S G, Cao S Y, Sun Z W, et al.Isolation and purification of native glycinin subunits[J], Chinese Journal of Oil crop Sciences, 2009(1):75-80
[27]张震宇, 周明, 赵开弘, 等. 层理鞭枝藻红蓝蛋白α亚基的分离纯化和结晶[J]. 生物物理学报, 2000, 16(4):667-672
Zhang Z Y, Zhou M, Zhao K H, et al. Purification and crystallization of phycoerythrocyaninα-subunit from mastigocladuslaminosus[J], Acta Biophysica Sinica, 2000, 16(4):667-672
[28]Dong K, Hao C Y, Wang A L, et al. Characterization of HMW glutenin subunits in bread and tetraploidWheats by reversed-phase high-performance liquid chromatography[J]. Cereal Research Communications, 2009; 37(1): 65
[29]Koppelman S J, Knol E F, Vlooswijk R A A, et al. Peanut allergen Ara h 3: Isolation from peanuts and biochemical characterization[J]. Allergy, 2003(58):1144-1151
[30]黄峙,杨芳,郑文杰,等. 用液相等电聚焦电泳纯化藻蓝蛋白亚基[J]. 高等学校化学学报,2006(6):1051-1054
Huang Z, Yang F, Zheng W J, et al.Purification and Preparation of Active Subunits of C-phycocyaninby a Protocol of Liquid-phase IsoeletricFoc using[J]. Chemical journal of Chinese Universities, 2006(6):1051-1054
[31]郑树贵, 董维国, 孙泽威,等.等电点沉淀法分离大豆球蛋白酸性亚基和碱性亚基[J]. 大豆科学,2009(28):136-139
Zheng S G, Dong W G, Sun Z W, et al.Isolation of Acidic Subunits and Basic Subunits from G lycinin using IsoelectricPoint Precipitation[J]. Soybean Science, 2009(28):136-139
[32]Owusu-Apenten R K. Food Protein Analysis: Quantitative Effects on Processing[M]. New York: Marcel Dekker, Inc., 2002
[33]唐兆秀,徐日荣,蓝新隆. 南方珍珠豆型花生籽仁蛋白质积累及亚基肽组分分析[J]. 中国农学通报,2012(36):96-101
Tang Z X, Xu RR, Lan X L. Protein accumulation in the seed of southern spanish-type peanutand the analysis of subunit polypeptide component[J]. Chinese Agricultural Science Bulletin, 2012(36):96-101
[34]周宇锋,宋莲军,乔明武,高晓延. 大豆蛋白亚基与豆腐的质构特性的相关性[J]. 中国粮油学报,2014(4):22-25
Zhou Y F, Song L J,Qiao M Wet al. Correlation of soybean protein subunits and tofu texture characteristics[J]. Journal of the Chinese Cereal and Oils Association,2014(4):22-25
[35]MohamadRamlan B M S, Maruyama N, Takahashi K, et al. Gelling properties of soybean β-conglycinin having different subunit compositions[J]. Bioscience, Biotechnology, and Biochemistry, 2004, 68(5): 1091-1096
[36]Poysa V, Woodrow L, Yu K. Effect of soy protein subunit composition on tofu quality[J]. Food Research International, 2006, 39(3): 309-317
[37]Mo X Q, Wang D H, Sun S X Z. Physicochemical Properties of β andαα’Subunits Isolated from Soybean β-Conglycinin[J]. J. Agric. Food Chem. 2011, 59:1217-1222
[38]张吉民. 36K道尔顿花生球蛋白亚基与花生烫漂程度的关系[J]. 花生科技,1987,4:33-35
Zhang J M.Relation of a 36 000-dalton arachin subunit to blanchability in peanuts[J]. Peanut Technology,1987,4:33-35
[39]赵谋明,辛佩贤,赵强忠,等. 酸性条件下花生分离蛋白亚基结构的变化规律[J].现代食品科技, 2014, 30(12):37-42
Zhao MM, XinP X, Zhao Q Z, et al. Structural variations in the subunits of peanut protein isolates underAcidic conditions[J]. Modern Food Science and Technology, 2014, 30, 12:37-42
[40]源博恩. 亚基解离与重聚集对大豆蛋白结构和功能特性的影响[D].广州:华南理工大学,2012
Yuan E B. Effect of subunits dissociation and aggregation on structure and functional properties of soy protein[D]. Guangzhou:South China University of Technology, 2012
[41]何轩辉. 超高压对花生分离蛋白凝胶特性的影响及其机理研究[D].北京:中国农业科学院,2013
He X H. Study on the effects of ultra-high pressure on the gelation properties of peanut protein isolates and its mechanism[D]. Beijing: Chinese Academy of Agricultural Sciences, 2013
[42]封小龙. 花生蛋白组分制备、改性及应用研究[D].北京:中国农业科学院,2014
Feng X L.Study on the preparation, modification and application of the peanut protein fractions[D].Beijing: Chinese Academy of Agricultural Sciences, 2014
[43]赵冠里. 酶解与多糖接枝改性花生蛋白及其构效机理研究[D].广州:华南理工大学,2011
Zhao G L. Enzymatic or glycosylation modification of peanut proteins and its related structure function mechanism[D].Guangzhou:South China University of Technology, 2011.
Research Progress on Peanut Protein Subunits Structure and Properties
Liu Li Shi Aimin Liu Hongzhi Hu Hui Wang Qiang
(Institute of food Science and Technology, Chinese Academy of Agricultural Sciences, Key Laboratory of Agro-Products Processing, Ministry of Agriculture, Beijing 100193)
Peanut protein was a good vegetable protein with nutrition and functions, and have an extensive application prospect. Study on structure, function and properties of peanut protein has been always a research hotspot. In this paper, the peanut protein subunits and classification, structure and properties were summarizes, mainly the separation and purification of peanut protein subunits, structural features, functional properties, structure-activity relationships were provided in details. Finally the existing problems were pointed out and the development prospects were explored, in order to provide the theoretical foundation for the further study and development of peanut protein.
peanut protein, subunits, structure, property
TS201
A
1003-0174(2016)10-0151-06
国家科技支撑计划(2012BAD29B03),国家科技创新工程(CAAS-ASTIP-201X-IAPPST)
2015-03-19
刘丽,女,1985年出生,博士,粮食、油脂与植物蛋白工程
王强,男,1965年出生,研究员,粮食、油脂与植物蛋白工程
