高油大豆与低油大豆油脂体组成及其稳定性的研究
2016-12-26梁新婷江连洲侯俊财王胜男
梁新婷 江连洲 侯俊财 王胜男
(东北农业大学食品学院,哈尔滨 150030)
高油大豆与低油大豆油脂体组成及其稳定性的研究
梁新婷 江连洲 侯俊财 王胜男
(东北农业大学食品学院,哈尔滨 150030)
为研究高油大豆和低油大豆油脂体组成及乳化稳定性和氧化稳定性差异,本试验分析了高油大豆和低油大豆油脂体基本组成、脂肪酸组成、磷脂组成、生育酚组成,同时比较了高油大豆油脂体与低油大豆油脂体乳化性及乳化稳定性、过氧化值及TBARS值。研究表明,高油大豆油脂体蛋白质含量显著低于低油大豆油脂体(P<0.05),而高油大豆油脂体的脂肪含量显著高于低油大豆油脂体(P<0.05);高油大豆油脂体的棕榈酸和亚油酸含量显著低于低油大豆油脂体(P<0.05),而十七碳酸、油酸、二十碳一烯酸和α-亚麻酸含量显著高于低油大豆油脂体(P<0.05),高油大豆油脂体的总不饱和脂肪酸质量分数(83.08±0.05)%显著高于低油大豆油脂体(81.86±0.12)%(P<0.05);高油和低油大豆油脂体中脑磷脂、卵磷脂和溶血磷脂酰胆碱含量无显著差异(P>0.05);高油大豆油脂体中DL-α-生育酚和γ-生育酚含量显著高于低油大豆油脂体(P<0.05);高油大豆油脂体和低油大豆油脂体的乳化性无显著差异(P>0.05),而高油大豆油脂体的乳化稳定性显著高于低油大豆油脂体(P<0.05);14 d热处理条件下,高油大豆油脂体的过氧化值和TBARS值均高于低油大豆油脂体。上述研究表明,高油大豆和低油大豆的油脂体之间的组成和稳定性都存在差异。
大豆油脂体 组成 热处理 稳定性
大豆是世界上栽培最为广泛的作物之一。也是人们膳食蛋白质的重要来源,同时大豆油消费又是世界植物油之首[1-3]。随着人们对大豆及其制品营养价值和保健功能越来越重视,极大促进大豆加工领域科学研究与产品开发的快速发展[4-5]。
大豆种子中存在一种贮藏三酰甘油(TAGs)的亚细胞微粒,被称作油脂体(oil body),大豆油脂体直径通常在0.5~2.5 μm,其内部为储存脂类(TAGs)形成的基质,外层是由磷脂分子层及其表面附着的多种油脂体膜蛋白如油质蛋白(Oleosin)等构成[6]。油脂体最早期是由Frey-Wyssling等[7]发现,油脂体被称为植物细胞中的“圆球体”。近年来,大豆油脂体受到越来越多的关注。Tzen等[8]对包括大豆在内的多种油料作物种子之间的油脂体组成及结构比较发现,油脂体中TAGs、磷脂与结构蛋白含量之间具有一定相关性,Kapchie等[9]研究表明不同的提取方法对大豆油脂体组成及结构也存在一定的影响,Cao等[10]分析了大豆油脂体中的的7种结构蛋白,并研究了碱性条件对结构蛋白稳定性的影响。
然而,关于高油大豆与低油大豆油脂体间组成和稳定性研究鲜有报道,因此,本研究以我国北方典型的高油和低油大豆品种,采用同种方法制备油脂体,研究二者间的油脂体组成、乳化稳定性和氧化稳定性,进一步澄清不同来源的大豆油脂体的功能性,为大豆油脂体的开发应用提供参考。
1 材料与方法
1.1 材料与试剂
高油大豆:东农47[蛋白质质量分数为(37.55±0.06)%,脂肪(20.90±0.29)%,水分(6.07±0.05)%];低油大豆:东农42[蛋白质质量分数为(39.40±0.30)%,脂肪(18.83±0.79)%,水分(7.33±0.32)%],数据为实测值,购于东北农业大学大豆研究所,4 ℃下贮存;其他化学试剂均为分析纯。
1.2 仪器与设备
GL-21M高速冷冻离心机:湖南湘仪离心机仪器有限公司;高效液相色谱仪LC-20A:日本岛津有限公司;气相色谱仪GC-7890A:美国安捷伦科技有限公司;高效液相色谱仪LC-2998:美国Waters公司。
1.3 方法
1.3.1 大豆油脂体的提取
油脂体的提取方法参照Tzen等[11]的方法,并加以改进。将大豆种子用蒸馏水浸泡12~14 h。将浸泡之后颗粒饱满的种子研磨后得到匀浆物,过滤。收集滤液浮选介质(含0.4 mol/L蔗糖和10 mmol/L磷酸钠的缓冲液,pH为7.5)层叠在上层,10 000 g离心20 min。收集上层洗涤溶液(含有0.1%吐温20、0.2 mol/L蔗糖和5 mmol/L磷酸钠的缓冲液,pH 7.5)中,10 mmol/L的磷酸钠缓冲液(pH为7.5)层叠在顶部,如上离心。收集上层的油脂体悬浮,浮选介质(含0.25 mol/L蔗糖、2 mol/L NaCl和10 mmol/L磷酸钠的缓冲液,pH为7.5)层叠在顶部,如上离心;收集上层的油脂体悬浮于9 mol/L尿素中,震荡10 min,10 mmol/L的磷酸钠缓冲液(pH 7.5)层叠在顶部,将离心管离心。收集上层的油脂体悬浮在研磨介质(含0.6 mol/L蔗糖和10 mmol/L磷酸钠的缓冲液,pH为7.5),离心,该步骤重复1次,收集油脂体,均质。
1.3.2 微观结构观察
1.3.2.1 大豆种子透射电镜观察
取高油和低油大豆种子分别投入到2.5%戊二醛溶液 (0.1 mol/L磷酸缓冲液配制,pH 6.8)中制作超薄切片,固定6~8 h,磷酸缓冲液冲洗后,用2%锇酸溶液固定2 h,双蒸馏水冲洗。丙酮梯度脱水,Epon 812环氧树脂包埋。超薄切片经铀、铅双重染色后在透射电镜下观察。
1.3.2.2 高油和低油大豆油脂体激光共聚焦显微镜观察
采用激光共聚焦显微镜 LEICA TCS sp2,使用488 nm的波长激光发射器,样品经去离子水稀释后取适量小心地置于载玻片上,使用尼罗蓝染色后显微镜下观察。图像分析使用 LEICA TCS sp2分析软件。
1.3.3 脂肪酸含量测定
大豆油脂体脂肪酸的测定参照Nash等[12]的方法。用乙醚提取大豆油脂体中的油脂,取20 mg油脂样品于酯化烧瓶中,进行甲酯化操作,水浴40 ℃加热20 min,加入3 mL 正己烷溶液振荡萃取,加入1 g无水硫酸钠,取上层液体过膜,直接注入气相色谱仪。进样量为1 μL。
1.3.4 磷脂含量测定
磷脂含量测定参照Lee等[13]的方法。取0.5 g大豆油脂体样品,称重并倒入80 mL离心管中,35 mL 氯仿/甲醇(1∶1,V/V)加入到离心管中,4 000 g离心10 min。收集上清液,该过程重复2次。向合并的上清液中加入25 mL 0.5%的氯化钠水溶液中,用漩涡混合仪混合2 min,导致两相分离,用无水硫酸钠对含有总脂质的下层有机相干燥,过滤,转移至接收瓶中,用旋转蒸发仪45 ℃水浴真空蒸干,得到脂质。用2 mL三氯甲烷复溶,过膜,直接注入高效液相色谱仪。
1.3.5 生育酚含量测定
大豆油脂体生育酚的测定参照Rossi等[14]的方法。用乙醚提取大豆油脂体中的油脂,准确称重20~40 mg油脂,用2 mL正己烷复溶,直到油滴消失成为均匀的溶液,过膜,直接注入高效液相色谱仪。HPLC流动相是含0.3%异丙醇的正己烷溶液,流动速率是1.7 mL/min,波长290 nm。
1.3.6 SDS-PAGE
参照Nikiforidis等[15]的方法。根据大豆油脂体中蛋白质的含量,准确称量一定量大豆油脂体,用0.062 5 mol/L Tris缓冲溶液(2%SDS,10%甘油,0.1%溴苯酚蓝,5%-巯基乙醇)处理,煮沸2 min,经过2次冻融循环,通过离心分离得到包含蛋白(3~4 mg/mL)的下层清液,应用电泳凝胶用考马斯亮蓝G250染色。
1.3.7 过氧化值和TBARS值
油脂体悬浮液的制备:过氧化值和TBARS值测定参照Kapchie等[16]的方法。将新鲜制备的油脂体用0.1 mol/L Tris-HCl溶液稀释。油脂体悬浮液加热处理。定期取样品进行过氧化值和TBARS值测定。
过氧化值测定:预先氧化的大豆油(由AOCS 1998测得过氧化值),用来建立吸光度的标准曲线过氧化氢。油脂体悬浮液被称重到10 mL的容量瓶中,加入5 mL氯仿/甲醇(2∶1,V/V),定容、密封,60 μL硫氰酸铵(30%)加入到容量瓶,再加入60 μL 氯化亚铁溶液(0.5 g 硫酸亚铁溶解在50 mL无氧水中,再溶解水合氯化钡0.4 g,加入2 mL 10 mol/L的HCl),反应10 min后,测定吸光度,同时做空白对照。
TBARS值测定:将15%(m/V)三氯乙酸(TCA)和0.375%(m/V)硫代巴比妥酸(TBA)溶解在0.25 mol/L的盐酸水溶液中,制成TCA/TBA溶液。3 mL 2%丁基化羟基甲苯(BHT)的无水乙醇溶液加入到100 mL的TCA/TBA溶液中。800 μL的油样品和8 mL TCA/TBA溶液中加入试管中。加热15 min。冷却后离心。上层清液测定吸光度,用丙二醛标准品做标准曲线,同时做空白对照。
1.3.8 乳化性测定
油脂体乳化性的测定参照Pearce等[17]的方法。1 mL大豆油与4 mL 1 mg/mL 的样品稀释液混合,10 000 r/min均质1 min,然后静置10 min,取静置0 min和10 min时的玻璃容器底部的乳化液50 μL,加入到5 mL 0.1%的SDS溶液中,充分混匀后使用UV-6100紫外分光光度计于波长500 nm下测量其吸光值。
乳化性(EAI)和乳化稳定性(ESI)计算公式:


式中:A500nm为波长500 nm处的吸光值;C为蛋白质质量浓度(g/mL);φ为油相所占体积分数(φ=1/5);A10为静置10 min时乳状液的吸光值;A0为静置0 min时乳状液的吸光值;n为稀释倍数为100。
1.4 统计分析
所有试验均重复3次,采用Statistix 8.0软件分析数据,用Tukey HSD进行平均数之间显著性差异分析,P<0.05表示差异显著,采用EXCEL软件作图。
2 结果与讨论
2.1 高油和低油大豆种子透射电镜观察
高油和低油大豆种子透射电镜的超微结构见图1。由图1可见,较大体积的为蛋白质体,小油脂体排列在蛋白质体周围,可以发现细胞内其他部分多为大油脂体。油体形状多数为圆形或椭圆形,少数呈不规则状。在高油大豆种子中,油脂体分布紧密,且铺满整个细胞,其中大油脂体数目较少。在低油大豆品种中,油脂体在细胞内分布疏松,油脂体间隙较大。另外,在高油大豆品种单个细胞内,油脂体数量明显高于低油大豆品种。

注:Pb为蛋白质体;Ol为大油脂体;Os为小油脂体(2 000 nm)。
图1 高油和低油大豆种子超微结构
2.2 高油和低油大豆油脂体激光共聚焦电子显微镜观察
图2为高油和低油大豆油脂体激光共聚焦电子显微镜图像,富含脂肪质的部分被尼罗蓝染料染色后,建立荧光强度,图中绿色球形亮点部分即为所观察到的大豆油脂体,与Nantiyakul等[18]观察的水稻油脂体CLSM图像类似,说明不同作物种子的油脂体经过稀释染色后,微观结构上具有一定的相似性。样品经过稀释至合适浓度后观察,高油和低油2种大豆油脂体间的区别不明显。
图2 高油和低油大豆油脂体激光共聚焦电子
显微镜图像(20 μm)
2.3 高油和低油大豆油脂体基本组成分析
高油和低油大豆油脂体基本组成成分见表1。由表1可知,高油大豆油脂体的蛋白质含量显著低于低油大豆油脂体(P<0.05)。高油大豆油脂体的脂肪含量显著高于低油大豆油脂体(P<0.05),高油大豆油脂体和低油大豆油脂体的水分、灰分含量无显著差异(P>0.05)。在高油大豆和低油大豆中,脂肪和蛋白质的比例分别为0.56∶1和0.48∶1,在高油和低油大豆油脂体中脂肪和蛋白质的比例分别为20.86∶1和10.46∶1,这说明大多数的蛋白质在提取过程中已经被移除,且该高油和低油大豆油脂体的比例均高于Iwanaga等[19]的4.6∶1的结果,这可能是由大豆品种的不同以及提取方法的差异导致的,Iwanaga等采用的为代码5601T高油大豆,提取方法参照Loer等[20],均与本试验不同。高油大豆油脂体中脂肪和蛋白质比例高于低油大豆油脂体,一方面可能是由于在高油大豆中脂肪和蛋白质比例高于低油大豆,直接影响了油脂体中的脂肪和蛋白质的比例,另一方面可能是在提取过程中,低油大豆蛋白质含量较高,经过同样的提取步骤,油脂体中残留的外在蛋白较多,导致脂肪和蛋白质比例较高。

表1 高油和低油大豆油脂体基本组成成分/%
注:同列平均值右上角字母不同表示差异显著(P<0.05),字母相同表示差异不显著(P>0.05),下同。
高油和低油大豆油脂体脂肪酸组成见表2,由表2可知,在高油和低油大豆油脂体中,含量最高的脂肪酸均为亚油酸,质量分数分别为50.22%和52.21%,其次均为油酸,质量分数分别为23.94%和21.87%,该结果与Kapchie等[9]的结果相接近。高油大豆油脂体的棕榈酸和亚油酸含量显著低于低油大豆油脂体(P<0.05),高油大豆油脂体的十七碳酸、油酸、二十碳一烯酸和α-亚麻酸含量显著高于低油大豆油脂体(P<0.05),高油大豆油脂体与低油大豆油脂体的硬脂酸、花生酸和二十二碳酸含量无显著差异(P>0.05)。高油大豆油脂体的总不饱和脂肪酸质量分数(83.08±0.05)%显著高于低油大豆油脂体(81.86±0.12)%(P<0.05)。高油和低油大豆油脂体中各种脂肪酸组成的差异可能是由高油大豆和低油大豆品种间的差异导致的[21]。

表2 高油和低油大豆油脂体脂肪酸组成/%
高油和低油大豆油脂体磷脂含量见图3,本试验中高油和低油大豆油脂体中磷脂总质量分数分别为0.47%和0.49%,在Tzen等[21]的研究结果0.5%~2%的磷脂含量范围内,高油和低油大豆油脂体中含量最高的磷脂均为卵磷脂,高油和低油大豆油脂体中的脑磷脂、卵磷脂和溶血磷脂酰胆碱含量无显著差异(P>0.05),磷脂酰肌醇含量未检出。
高油和低油大豆油脂体中生育酚含量见图4,高油和低油大豆油脂体中生育酚总量分别为46.99、37.36 mg/100 g TAGs,高油和低油大豆油脂体中主要的生育酚均为 γ-生育酚和δ-生育酚。Kapchie等[16]的研究表明,γ-生育酚所占比例高达73.50%,δ-生育酚仅为1.89%,而在本试验中,高油大豆油脂体中 γ-生育酚和 δ-生育酚所占比例分别为45.37%和52.26%,低油大豆油脂体中 γ-生育酚和 δ-生育酚所占比例分别为44.03%和54.08%,这可能与油脂体提取的方法有关,Kapchie等[16]采用的方法与本试验有所不同。高油大豆油脂体中DL-α-生育酚和 γ-生育酚含量显著高于低油大豆油脂体(P<0.05),而 δ-生育酚含量无显著差异(P>0.05),这可能与大豆品种有关[21]。
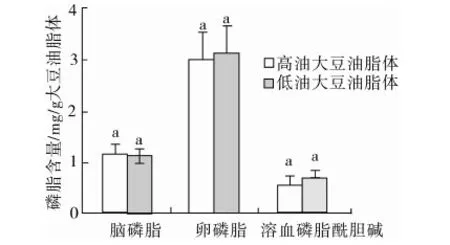
图3 高油和低油大豆油脂体磷脂含量

图4 高油和低油大豆油脂体中生育酚含量
2.4 大豆油脂体SDS-PAGE分析
高油和低油大豆SDS-PAGE电泳图见图5a,由图5可知,高油和低油大豆SDS-PAGE图谱显示分子质量~25 ku的频段,可能属于大豆蛋白质中的2 S。低油大豆的条带强度明显强于高油大豆,这可能是由于低油大豆中蛋白质含量较高导致的。高油和低油大豆油脂体SDS-PAGE电泳图见图5b,由图5可知,高油和低油大豆油脂体SDS-PAGE电泳4个主要频段对应的分子质量约为17、18、24、34 ku,依据Tzen等[8]和Nikiforidis等[15]的研究结果,大豆油脂体中油质蛋白的分子质量为15~26 ku,因此,本试验图谱中约为17、18、24 ku可能均属于大豆油脂体中的油质蛋白的部分,其余条带可能属于大豆油脂体提取过程中残留的外在蛋白(β-伴大豆球蛋白、大豆球蛋白等)[22-23],它们不能被认为真的是吸附于油脂体的表面蛋白,因为它们并没有渗透到吸附的表面膜内,而且通过各种水相介质可以将它们洗除,它们的存在可以作为包括主要的磷脂-蛋白质混合层在内的,第2个非吸附的表面层,有助于改善大豆油脂体在贮藏期间抗聚结的稳定性[24-26]。图5低油大豆油脂体的条带强度明显高于高油大豆油脂体的条带强度,可能是由低油大豆油脂体中较高的蛋白质含量造成的。

图5 SDS-PAGE电泳图
2.5 高油和低油大豆油脂体乳化性及乳化稳定性比较
高油和低油大豆油脂体乳化性见图6,高油和低油大豆油脂体的乳化性分别为(70.32±1.23) m2/g和(68.50±2.32) m2/g,高油大豆油脂体和低油大豆油脂体的乳化性无显著差异(P>0.05),高油和低油大豆油脂体乳化稳定性见图7,高油和低油大豆油脂体的乳化稳定性分别为(31.04±1.55)%和(19.76±4.39)%,高油大豆油脂体的乳化稳定性显著高于低油大豆油脂体(P<0.05)。Pearce等[17]的研究表明,对于一种蛋白质的乳化能力很可能与浓乳液在高剪切下的稳定性有关,而与在分散液中通过有限数量的蛋白质就能稳定的油脂的数量无关。因此高油和低油大豆油脂体中脂肪的含量高低没有起到决定性的作用,大豆油脂体蛋白质的组成[10]以及乳液浊度很可能是高油大豆油脂体乳化稳定性较高的原因[17]。

图6 高油和低油大豆油脂体乳化性
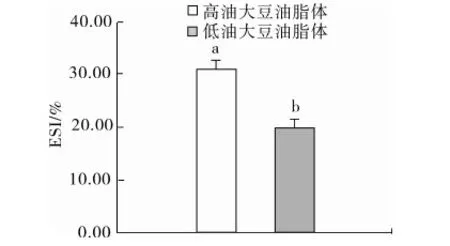
图7 高油和低油大豆油脂体乳化稳定性
2.6 高油和低油大豆油脂体过氧化值和TBARS
高油和低油大豆油脂体过氧化值见图8,由图8可知,高油大豆油脂体和低油大豆油脂体0 d的过氧化值均为0.07 mmol/kg,无显著差异(P>0.05)。高油和低油大豆油脂体过氧化值均在贮藏第2天有微小升高,在2~14 d逐渐降低,高油大豆油脂体的过氧化值始终高于低油大豆油脂体的过氧化值。高油和低油大豆油脂体丙二醛(MDA)含量见图9,本试验中以丙二醛(MDA)含量作为TBARS值的衡量指标。高油和低油大豆油脂体0 d 的丙二醛(MDA)含量均为1.03 μg/mL,高油和低油大豆油脂体在第2天都有微小升高,在其他时间点保持平稳,且在2~14 d内,高油大豆油脂体的丙二醛含量均低于低油大豆油脂体的丙二醛含量。由于氧化形成的氢过氧化物和二级氧化产物丙二醛的含量均处于较低的水平,说明高油和低油大豆油脂体即使在14 d加热贮藏的条件下也具有较好的氧化稳定性,可能是由于油脂体本身的特殊结构,外层稳定的油质蛋白层保护了易氧化的不稳定成分不受反应的氢过氧化物的影响,降低氧的渗透率,也可能是由于大豆油脂体中残留的蛋白、磷脂比油脂体优先氧化,同时存在于大豆油脂体中的天然抗氧化剂也可能是大豆油脂体高氧化稳定性的关键原因[16,27]。

图8 高油和低油大豆油脂体过氧化值

图9 高油和低油大豆油脂体TBARS值
3 结论
本研究发现,高油大豆油脂体脂肪含量显著高于低油油脂体(P<0.05),蛋白质含量显著低于大豆油脂体(P<0.05),在脂肪酸、磷脂、生育酚的组成上均存在一定的差异性。高油大豆油脂体比低油大豆油脂体具有更高的乳化稳定性。高油大豆油脂体和低油大豆油脂体都具有较好的氧化稳定性。研究结果可以为大豆油脂体应用于食品、药品等领域提供理论依据和技术参考,具有一定实际的意义。
[1]江连洲,胡少新.中国大豆加工产业发展现状与建议[J].中国农业科技导报,2007,9(6):22-27
Jiang L Z, Hu S X. Status and suggestions for the development of soybean processing industry in china[J]. Journal of Agricultural Science and Technology, 2007, 9(6):22-27
[2]邱丽娟,常汝镇,孙建英等.中国大豆品种资源的评价与利用前景[J].中国农业科技导报,2000,2(5):58-61
Qiu L J, Chang R Z, Sun J Y,et al. Perspects of evaluation and utilization of soybean germplamin China[J]. Journal of Agricultural Science and Technology, 2000,2(5):58-61
[3]李霞辉,王乐凯,廖辉,等.黑龙江省大豆与美国大豆质量比较[J].中国粮油学报,2003,18(4):26-29
Li X H, Wang L K, Liao H, et al.A quality comparison between soybean produced form Heilongjiang Province and from USA[J]. Journal of the Chinese Cereals and Oils Association, 2003,18(4):26-29
[4]乔娟.中国大豆国际竞争力研究[D].北京:中国农业科学院,2004
Qiao J. The international competitiveness of soybean in China[D]. Beijing: The Chinese Academy of Agricultural Sciences, 2004
[5]邱丽娟,李英慧,关荣霞,等.大豆核心种质和微核心种质的构建、验证与研究进展[J].作物学报,2009,35(4):571-579
Qiu L J, Li Y H, Guan R X, et al. Establishment,representative testing and research progress of soybean core collection and mini core collection[J]. Acta Agronomica Sinica, 2009,35(4):571-579
[6]Katavic V, Agrawal G K, Hajduch M, et al. Protein and lipid composition analysis of oil bodies from two Brassica napus cultivars[J].Proteomics, 2006, 6(16): 4586-4598
[7]Frey-Wyssling A, Grieshaber E, Mühlethaler K. Origin of spherosomes in plant cells[J]. Journal of Ultrastructure Research, 1963, 8(5): 506-516
[8]Tzen J T, Huang A H. Surface structure and properties of plant seed oil bodies[J]. The Journal of Cell Biology, 1992, 117(2): 327-335
[9]Kapchie V N, Wei D, Hauck C, et al.Enzyme-assisted aqueous extraction of oleosomes from soybeans (Glycinemax)[J]. Journal of Agricultural and Food Chemistry, 2008, 56(5): 1766-1771
[10]Cao Y, Zhao L, Ying Y, et al.The characterization of soybean oil body integral oleosin isoforms and the effects of alkaline pH on them[J]. Food Chemistry, 2015,177:288-294
[11]Tzen J T C, Peng C C, Cheng D J, et al.A new method for seed oil body purification and examination of oil body integrity following germination[J]. Journal of Biochemistry, 1997, 121(4): 762-768
[12]Nash A M, Frankel E N. Limited extraction of soybeans with hexane[J]. Journal of the American Oil Chemists’Society, 1986, 63(2): 244-246
[13]Lee S J, Choi J Y, Park S, et al. Determination of phospholipids in soybean (Glycinemax(L.)Merr) cultivars by liquid chromatography-tandem mass spectrometry[J]. Journal of Food Composition and Analysis, 2010, 23(4): 314-318
[14]Rossi M, Gianazza M, Alamprese C, et al. The effect of bleaching and physical refining on color and minor components of palm oil[J]. Journal of the American Oil Chemists' Society, 2001, 78(10): 1051-1055
[15]Nikiforidis C V, Kiosseoglou V. Aqueous extraction of oil bodies from maize germ (Zeamays) and characterization of the resulting natural oil-in-water emulsion[J]. Journal of Agricultural and Food Chemistry, 2009, 57(12): 5591-5596
[16]Kapchie V N, Yao L, Hauck C C, et al. Oxidative stability of soybean oil in oleosomes as affected by pH and iron[J]. Food Chemistry, 2013, 141(3): 2286-2293
[17]Pearce K N, Kinsella J E. Emulsifying properties of proteins: evaluation of a turbidimetric technique[J]. Journal of Agricultural and Food Chemistry, 1978, 26(3): 716-723
[18]Nantiyakul N, Furse S, Fisk I D, et al. Isolation and characterization of oil bodies from Oryza sativa bran and studies of their physical properties[J]. Journal of Cereal Science, 2013, 57(1): 141-145
[19]Iwanaga D, Gray D A, Fisk I D, et al. Extraction and characterization of oil bodies from soy beans: a natural source of pre-emulsified soybean oil[J]. Journal of Agricultural and Food Chemistry, 2007, 55(21): 8711-8716
[20]Loer D S, Herman E M. Cotranslational integration of soybean (Glycinemax) oil body membrane protein oleosin into microsomal membranes[J]. Plant Physiology, 1993, 101(3): 993-998
[21]Tzen J T C, Cao Y Z, Laurent P, et al.Lipids, proteins, and structure of seed oil bodies from diverse species[J]. Plant Physiology, 1993, 101(1): 267-276
[22]Wu N N, Huang X, Yang X Q, et al.In vitro assessment of the bioaccessibility of fatty acids and tocopherol from soybean oil body emulsions stabilized with ι-carrageenan[J]. Journal of Agricultural and Food Chemistry, 2012, 60(6): 1567-1575
[23]Nikiforidis C V, Biliaderis C G, Kiosseoglou V. Rheological characteristics and physicochemical stability of dressing-type emulsions made of oil bodies-egg yolk blends[J]. Food Chemistry, 2012, 134(1): 64-73
[24]Nikiforidis C V, Kiosseoglou V. Physicochemical stability of maize germ oil body emulsions as influenced by oil body surface-xanthan gum interactions[J]. Journal of Agricultural and Food Chemistry, 2009, 58(1): 527-532
[25]Frandsen G I, Mundy J, Tzen J T C. Oil bodies and their associated proteins, oleosin and caleosin[J]. Physiologia Plantarum, 2001, 112(3): 301-307
[26]Purkrtova Z, Jolivet P, Miquel M,et al. Structure and function of seed lipid body-associated proteins[J]. Comptes Rendus Biologies , 2008, 331(10) : 746-754
[27]Fisk I D, White D A, Lad M, et al. Oxidative stability of sunflower oil bodies[J]. European Journal of Lipid Science and Technology, 2008, 110(10): 962-968.
The Composition and Stability of Oil Bodies from High Oil Soybean and Low Oil Soybean
Liang Xinting Jiang Lianzhou Hou Juncai Wang Shengnan
(Food College of Northeast Agricultural University, Haerbin 150030)
In order to study on the composition,the emulsification stability and oxidation stability of oil body from high oil soybean (OBHOS) and oil body from low oil soybean (OBLOS), this study analyzed the composition, fatty acid profiles, the concentration of phospholipids, and tocopherol of OBHOS and OBLOS, and evaluated emulsification and emulsion stability, the value of PV and TBARS of OBHOS and BOLOS at the same time. The study showed that the protein content of OBHOS was significantly lower than that of OBLOS (P<0.05), however the fat content of OBHOS was significantly higher than that of OBLOS (P<0.05); The palmitic acid and linoleic acid contents of OBHOS were significantly lower than that of OBLOS (P<0.05). The concentrations of C17∶0, C18∶1n9c, C20∶1n9, and C18∶3n3 of OBHOS were significantly higher than those in OBLOS (P<0.05). The total unsaturated fatty acid content of OBHOS(83.08±0.05)%was higher than that of OBLOS (81.86±0.12)%. There were no difference in PE, PC, L-PC contents between OBHOS and OBLOS (P>0.05). The concentrations of DL-α-tocopherol and γ-tocopherol in OBHOS were significantly higher than those in OBLOS (P<0.05). There were no significant difference in emulsification between OBHOS and OBLOS; while the emulsification stability of OBHOS was significantly higher than that of OBLOS (P<0.05). The PV and TBARS value of OBHOS were higher than those of OBLOS with heating treatment for 14 days. The study indicated that there were difference in composition and stability between OBHOS and OBLOS.
soybean oil body,composition,heating treatment,stability
TS221
A
1003-0174(2016)10-0011-07
国家自然科学基金(31371784),黑龙江省博士后科研启动金(LBH-Q13015)
2015-01-28
梁新婷,女,1993年出生,硕士,食品工程
侯俊财,男,1975年出生,教授,粮食、油脂与植物蛋白工程
