葡萄糖糖基化大豆分离蛋白的凝胶抗冻性研究
2016-12-26杜昱蒙陈振家施小迪徐婧婷郭顺堂
杜昱蒙 陈振家 施小迪 徐婧婷 郭顺堂
(中国农业大学食品学院 100083)
葡萄糖糖基化大豆分离蛋白的凝胶抗冻性研究
杜昱蒙 陈振家 施小迪 徐婧婷 郭顺堂
(中国农业大学食品学院 100083)
为解决大豆蛋白在冷冻食品中因冷冻变性导致功能性下降的问题,本研究对大豆分离蛋白进行了葡萄糖糖基化改性,并分析了改性大豆分离蛋白凝胶的抗冻性变化。结果表明,葡萄糖改性可以提高大豆分离蛋白凝胶的抗冻性,糖基化改性反应条件为蛋白∶葡萄糖=2∶1、反应pH 7、蛋白含量为40 mg/g。糖基化改性蛋白制备的凝胶在冻藏过程中的蛋白溶解性、亚基及凝胶水分分布等结果显示,改性大豆蛋白凝胶抗冻性的提高是由于糖基化蛋白中葡萄糖分子增强了对水分子的束缚作用从而减少蛋白质的脱水变性,同时,接枝在蛋白链上糖分子的空间位阻作用,阻止了蛋白分子间聚集和新键的形成,维持凝胶的均匀网状结构。
糖基化 大豆分离蛋白 抗冻性
大豆分离蛋白(soybean protein isolate,SPI)具有很好的凝胶形成性,因而常被用作食品配料来提高产品的保水性和弹性等质构性质,改善产品的品质。然而,蛋白凝胶在冷冻条件下会发生冷冻变性,产生收缩、析水、硬度增加等现象,蛋白质的凝胶特性大大降低。导致蛋白冷冻变性的机理主要有三种学说[1],一是结合水的脱离学说。蛋白在冻结过程中,尤其是缓慢冻结时,冰晶的形成会导致水分子的重新分布,解冻时游离的水分子不能返回到原来的位点(尤其是与蛋白质结合的水)而离开组织,即冻藏过程阻止了蛋白质的复水能力引起蛋白质的变性[2]。二是有关组织细胞中蛋白冻结变性学说,该学说认为冻结导致细胞液的离子浓度上升,pH发生变化而引起蛋白质的盐析变性。当细胞中水分被冻结时,在冻结相中金属盐和有机物的浓度相对增大,相应的pH和离子强度也发生很大的变化,从而导致蛋白质的变性[3]。三是水和水合水的相互作用引起蛋白质变性的水化作用学说。该学说认为冻结时冰晶的形成会破坏结合水与蛋白质分子的结合状态,导致蛋白质分子内部某些键的变化,包括旧键断裂和新键(包括氢键、离子键、疏水作用和二硫键)的形成,这些变化都会改变蛋白质的内部结构,从而导致蛋白质的变性。因此,可通过向蛋白或组织中添加具有阻止水结晶或促进与蛋白质结合的物质作为抗冻剂才能够改善蛋白质的抗冻性能。糖类是主要应用于海产品中的抗冻剂,工业上常用蔗糖和山梨醇混合物为抗冻剂。曲楠[4]等对罗非鱼糜的研究发现,随着冻藏时间的延长,添加10 %海藻糖对鱼糜蛋白盐溶性ATPase活性及巯基含量的下降趋势有抑制作用,同时也阻止了鱼糜的保水性、弹性和凝胶强度下降。
糖基化是制备功能性大豆分离蛋白常用的改性方法。大豆球蛋白(11S)与葡萄糖发生糖基化反应后,在一定时间内其产物溶解性随时间增加逐渐变大。其主要原因可能是糖类含有多个亲水羟基,糖基化的蛋白会由于引入羟基而使得其溶解性增加[5]。许彩虹[6]研究发现,葡聚糖以非共价键接入蛋白质肽链中,其空间位阻效应有利于提高蛋白热致凝胶性质,以共价键结合的葡聚糖的空间位阻效应有利于保护蛋白质而使其不易发生热变性而形成凝胶。但是,大豆蛋白经糖基化后是否能提高大豆蛋白的凝胶抗冻性却鲜有报道。
为此,本研究以葡萄糖为原料对大豆分离蛋白进行糖基化改性,分析了大豆蛋白凝胶经冷冻、冻藏、解冻后凝胶特性的变化,提出了凝胶抗冻性评价方法,同时对糖基化条件进行了优化,以期为工业化进行抗冻型大豆分离蛋白的生产提供参考。
1 材料和方法
1.1 试验材料
低温脱脂豆粕:安阳漫天雪食品制造公司,蛋白质(干基)> 50 %,大豆分离蛋白:实验室自制,干基粗蛋白质量分数为85%,赖氨酸,十二烷基硫酸钠,考马斯亮蓝G250:分析纯,北京化学试剂公司,磷酸,乙醇,N,N’-甲叉双丙烯酰胺:西格玛奥德里奇贸易有限公司,三氯乙酸,葡萄糖,邻苯二甲醛(OPA):国药化学试剂有限公司,牛血清白蛋白(BSA):北京天来生物医学科技有限公司,β-巯基乙醇(2-ME):西格玛奥德里奇贸易有限公司。
1.2 主要仪器及设备
LXJ-IIB低速离心机:上海安亭科学仪器厂;喷雾干燥塔:东京理化仪器株式会社;TSK-941L机械搅拌器:上海灿坤实业有限公司; CT 3质构仪:美国博勒飞仪器设备有限公司;电泳槽:日本BIO-CRAFT;Spectrum SP-2100UV紫外分光光度计:上海安亭仪器有限公司;358039型(10 mL)槌头式组织研磨器:美国惠顿波特公司; NM120-Angiyst低场核磁共振分析成像仪:上海纽迈电子科技有限公司。
1.3 糖基化大豆分离蛋白的制备
按照豆粕与水的质量为1∶15的比例混合,于50 ℃、pH 8.0条件下搅拌1.5 h。然后将豆粕水溶液进行浆渣分离,4 000 r/min离心20 min,弃去沉淀,将上清液调pH 4.5静置沉淀30 min,离心收集沉淀并加水复溶至指定pH值(pH 7, 8, 9)。将葡萄糖与大豆分离蛋白按一定比例(干基)混合成溶液(4∶1,2∶1, 4∶3, 1∶1, 1∶2),边搅拌边加热90~100 ℃,反应1.5 h;反应后迅速冷却至室温,终止反应,用HCl将溶液调至pH 4.5、静置30 min,1 000 r/min离心5 min,收集蛋白沉淀。沉淀经复溶至蛋白含量分别为20、40、60 mg/g,用NaOH将溶液调至pH 7.0,剪切均质后喷雾干燥得到糖基化蛋白粉。喷雾干燥塔的喷雾干燥参数:进风口温度为170~180 ℃,出风口温度为70~80 ℃。
1.4 凝胶的制备
将自制的糖基化蛋白粉配成干物质质量分数为12%(m/m)的溶液,搅拌1.5 h,确保完全溶解,无结块;搅拌后的溶液放入离心机中1 500 r/min离心5 min,去除气泡,将溶液灌入直径1 cm、长10 cm的注射器中,用保鲜膜封口;95 ℃水浴加热处理1 h,放入10 ℃以下冰水中冷却15 min,将样品-18 ℃冻藏10 d后取样品解冻5 h 再进行分析。未经过冷冻、冻藏、解冻处理的记为冻藏0 d。
1.5 自由氨基含量分析
参考了Brand C M J,2003[7]的方法。
试剂1∶40 mg OPA(邻苯二甲醛)溶解于1 mL甲醇中(该试剂现用现配,并避光保存);试剂2∶20%(m/m)的SDS 2.5 mL,0.1 mol/L的硼砂25 mL及100 μL β-巯基乙醇,最后用蒸馏水定容到50 mL,配成OPA试剂(棕色瓶避光保存)。测定时取200 μL样品液和4 mL OPA试剂于试管中,充分震荡,反应2 min后在340 nm下测其吸光值A340,以加入200 μL水代替样品液为空白,以赖氨酸做出标准曲线,计算样品中自由氨基的含量C。

式中:C0为糖基化反应前自由氨基含量/mmol/L;C1为糖基化反应后自由氨基含量/mmol/L。
1.6 凝胶持水性测定
将滤纸放入双层离心管内管的底部,切取1.5 g左右的凝胶放入内管,记录凝胶质量m及内管和凝胶总质量m1;4 000 r/min离心20 min,测内管及凝胶质量m2;
1.7 凝胶质构性质的测定
将凝胶切成直径1 cm、高度1 cm的小块,采用TPA质构分析,下压距离:4 mm,触发点负载:1.0 g,测试速度:0.50 mm/s,探头为TA41。
1.8 可溶性蛋白含量测定
称取1.5 g左右的凝胶,记录质量M,将凝胶充分研磨,溶于80 mL蒸馏水中,磁力搅拌30 min。以牛血清白蛋白(BAS)为标样,采用Bradford的方法测定可溶性蛋白质含量[8]。通过标准曲线查得样品中蛋白的含量X(μg/mL)。用样品中可溶蛋白与总蛋白的质量比(m/m)表示样品的可溶蛋白含量。
1.9 SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)
方法参考Blakesley等[9]的方法。
1.10 凝胶冻藏前后水分分布情况
分别取冻藏前后的凝胶约2 g放入核磁管中,将核磁共振管放入低场核磁共振分析成像仪内,通过信号收集和反演,最后以弛豫时间(T2)为横坐标,以弛豫时间对应的信号分量(Ai)为纵坐标作图,由于样品中水分的分布情况不同,因此在测试中表现的弛豫时间也不同。弛豫时间越小说明水分在凝胶中越不易流动。参数设置:磁场强度:0.5 T,共振频率:21 ~23 MHz,线圈直径:15 mm,磁场均匀度:2.5 × 10-6(12 mm×12 mm×12 mm),磁体温:32 ℃。
2 结果与分析
2.1 糖基化反应接枝度分析
糖基化反应也被称为羰氨反应,即葡萄糖的羰基末端和蛋白质的氨基末端之间的反应,因此,通过测量糖基化反应前后自由氨基含量的变化,也就是接枝度,可以反映糖基化反应的程度。
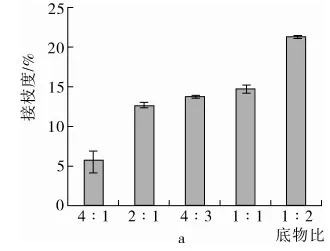
如图1a所示,不同底物比例(蛋白∶葡萄糖)对糖基化反应接枝度的影响,结果表明,随着葡萄糖添加量的增加,接枝度不断增加,蛋白∶糖=2∶1~1∶1时,接枝度变化不大,在13%左右;而蛋白∶糖=4∶1时,接枝度仅为5%左右;蛋白∶糖=1∶2时,接枝度达到21%。但糖基化反应pH对接枝度的影响不大,如图1b。
反应底物浓度对接枝度有较大影响,如图1c,当蛋白含量为20 mg/g时,反应底物浓度不足,糖基化接枝度较低;为60 mg/g时,由于蛋白浓度过高,在加热过程中出现了絮凝,影响了糖基化反应的进行,因此,蛋白含量为40 mg/g的接枝效果最好。
2.2 糖基化反应条件对大豆蛋白凝胶特性的影响
糖基化反应中,葡萄糖的添加量不同对糖基化反应的程度和凝胶形成的影响见表1。大豆分离蛋白凝胶冻藏前持水性均在90 %左右,而经冻藏后为70 %,凝胶持水性均明显下降。糖基化的蛋白凝胶经冻藏后持水性可以达到85 %以上。其中,蛋白∶葡萄糖=2∶1时,凝胶冻藏后的持水性降低较少。凝胶在冻藏过程中,水分不断形成冰晶,从蛋白的持水结构中脱离,从而导致蛋白分子间发生聚集,形成分子质量更大的蛋白链,造成凝胶硬度增加,无论是否经过糖基化反应,凝胶冻藏后硬度都有明显的上升,但经过糖基化改性处理的蛋白凝胶硬度较未改性的蛋白凝胶在冻藏后硬度增加较小。另外,葡萄糖添加比例并不对蛋白凝胶的硬度产生影响。
内聚性表示测试样品经过第1次压缩变形后所表现出来的对第2次压缩的相对抵抗能力,可以用来描述凝胶的可恢复性和凝胶内部的组织强度[10]。表1显示,凝胶冻藏后内聚性有所下降,说明冻藏过程中凝胶强度减弱,在经过第1次压缩后恢复性变差。主要是因为在冻藏过程中蛋白变性、聚集,凝胶原有的均匀网状结构被破坏。糖基化反应后,大豆分离蛋白内聚性与未经过处理的大豆分离蛋白间没有明显差异。说明糖基化反应并没有对蛋白凝胶强度造成较大影响。
表1还显示,糖基化改性的大豆蛋白凝胶经冻藏后,可溶性蛋白含量较未改性的大豆蛋白明显上升,也就是说参与凝胶形成的蛋白含量减少,形成了弱凝胶。这是由于糖分子占据了蛋白间的结合位点,导致蛋白聚集程度下降;另一方面糖分子结合到蛋白上会产生一定的空间位阻,也在一定程度上减少了蛋白的聚集。而这种效果并不受糖添加量的影响,而蛋白的糖基化位点的结合程度是影响的蛋白凝胶冻结特性的主要因素。这种弱凝胶的形成会使糖基化后凝胶的硬度下降,但凝胶内聚性显示糖基化反应并没有对凝胶的强度产生太大的影响。
表2显示了反应pH对凝胶冻藏前后特性的影响。反应pH对凝胶持水性和硬度影响不大;冻藏前,反应pH对凝胶的内聚性没有影响,而冻藏后,pH 8处理的凝胶内聚性最大,说明适当的碱性条件会降低糖基化改性蛋白冻藏过程中凝胶强度的下降程度。反应pH对可溶蛋白的影响较大,随着反应pH的升高,可溶性蛋白含量也有所上升,这可能和碱性条件下蛋白远离等电点,蛋白与水的亲和能力更强,减少了蛋白间的聚集有关。
注:反应pH: 7、蛋白质量分数:40 mg/g。

注:反应pH∶ 7、蛋白质量分数:40 mg/g。

注:底物比例:2∶1、反应pH∶7。图1 不同反应条件对蛋白接枝度的影响

样品(比例)持水性/%硬度/g内聚性可溶蛋白比例/%冻前冻后冻前冻后冻前冻后冻前冻后SPI90.44a±0.5073.93c±0.8023.13a±0.3432.7c±0.510.87ab±0.050.79de±0.0121.34a±0.8916.58e±1.004∶190.83a±0.8584.82de±0.366.87b±1.218.67d±0.830.83bc±0.020.77de±0.0336.66b±0.7628.95f±0.852∶190.78a±0.2387.65f±0.577.13b±0.319.60d±0.350.90a±0.040.82d±0.0334.46cd±0.8428.00f±1.304∶390.40a±0.4386.04e±1.147.33b±0.619.87d±0.310.86ab±0.030.81de±0.0536.90b±1.1427.83f±0.891∶190.77a±1.0484.29d±0.677.07b±0.2511.60d±0.870.84b±0.010.80de±0.0335.64bc±0.1322.59g±0.421∶290.77a±0.4385.76e±0.206.57b±0.218.40d±0.690.78c±0.040.75e±0.0433.60d±0.9726.16h±0.70

表2 反应pH对凝胶冻藏特性影响

表3 蛋白含量对凝胶冻藏特性影响
糖基化反应时的蛋白含量对凝胶冻藏后的持水性影响较大,蛋白含量过低会造成反应不充分,过高造成蛋白絮凝,而蛋白含量为40 mg/g时能获得较好的凝胶持水性(表3);同样,蛋白含量对凝胶的硬度和内聚性影响比较大,这和接枝度的变化情况是一致的,其中蛋白含量40 mg/g时硬度最小,20 mg/g时其次,60 mg/g时最大;其中,蛋白含量40 mg/g,凝胶内聚性最大,而蛋白含量20 mg/g和60 mg/g时内聚性最小。凝胶冻藏前,糖基化反应时的蛋白含量的变化对凝胶中可溶蛋白含量的影响不大,而冻藏后,蛋白含量40 mg/g,凝胶中可溶性蛋白含量最大,而糖基化反应时蛋白含量过高或过低都会导致凝胶中可溶性蛋白含量处于较低水平。
通过综合比较发现,糖基化反应中糖的添加量不宜过高,蛋白与糖的比例为2∶1时比较合适,反应pH对凝胶形成的影响不是很显著,因此选择pH为7,方便操作,而蛋白含量40 mg/g时凝胶有较好持水性和内聚性,表现出较好的抗冻特性。
2.3 蛋白凝胶SDS-聚丙烯酰胺凝胶电泳结果分析
如图2所示,糖基化后SPI的组成变化不大,但是,在泳道的上端,图谱上出现了分子质量增大的扩散现象,尤其是在α’亚基上部有比较明显的深色部分,说明葡萄糖糖基化反应后有某种分子质量较大的聚集体产生。这和苏志光[11]的研究结果相似,也说明部分亚基与糖分子发生结合,分子质量有不同程度的增加。

注:从左数,泳道1~2(SPI)、泳道3~ 4(糖基化后SPI)分别为冻前和冻后的电泳图谱。
图2 不同反应条件对大豆分离蛋白亚基的影响
2.4 蛋白凝胶冻藏前后水分分布
如图3所示,大豆分离蛋白(SPI)凝胶水分的弛豫时间主要分布在100 ms左右,且主要呈单一峰,主要表现为不易流动水[12];而冻藏后,水分分布更加分散,并出现2个峰,一部分弛豫时间增大,说明冻藏后凝胶中的一部分水分变得更易流动,另一部分弛豫时间减小,由于和蛋白等物质作用更加紧密而表现出更不易流动的结合水的特征。而糖基化大豆蛋白凝胶(GLU)冻藏前水分的分布峰较未糖基化的大豆分离蛋白凝胶整体向弛豫时间长的方向略有迁移,说明糖基化大豆蛋白凝胶中易流动水较多,而冻藏后凝胶的水分分布情况几乎没有改变,说明蛋白通过糖基化反应,可以有效的维持冻藏过程中大豆分离蛋白在的持水性结构,提高了大豆蛋白的凝胶抗冻性。
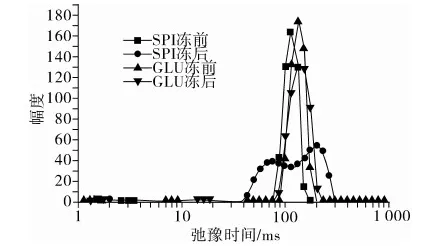
图3 大豆蛋白凝胶水分弛豫时间分布
3 讨论与结论
潘锦锋等[1]认为,糖类物质的抗冻作用机理是分子中的羟基与蛋白质分子的某些基团结合,使蛋白质分子的结合位点处于饱和状态,从而避免蛋白质分子之间的聚集变性。同时,糖类物质的游离羟基还能有效地束缚水分子,从而降低“共晶点”温度,减少冰晶体的形成量,形成一个不完全冻结区域,隔离和减缓蛋白质分子的聚集,进而防止蛋白质的凝聚变性。同时,糖基化蛋白分子上的羟基对水分子有一定的束缚能力,减少了蛋白质的脱水作用,一方面阻碍了蛋白分子间由于聚集所产生的新键的形成及构象的改变;另一方面提高了凝胶的持水性。因此,蛋白糖基化后增强了蛋白凝胶的抗冻能力。本研究中糖基化后的大豆分离蛋白制备的凝胶在冻藏后持水性还能维持在较高的水平,主要是保持了水分子在凝胶结构中的稳定性,从而使蛋白变性聚集的程度也得到了有效的控制,维持了蛋白凝胶的均匀网状结构。
结果表明,糖基化改性可以提高大豆分离蛋白凝胶的抗冻性,糖基化改性反应条件为蛋白∶葡萄糖2∶1、反应pH 7、蛋白含量40 mg/g。糖基化改性后的大豆分离蛋白凝胶经冷冻、冻藏、解冻后持水性较未处理的样品提高了13%,其持水性(87.65%)几乎接近为冷冻前(90.78%)。同时由于引入亲水基团,凝胶的可溶性蛋白含量明显增加,致使参与凝胶形成的蛋白量减少,因此,造成了凝胶的硬度下降的问题。但也正是由于这种作用,有效阻止了凝胶冻藏过程中由于冰晶形成而造成的蛋白分子聚集,持水性变差的问题。并且,凝胶内聚性的数据结果显示,糖基化改性并没有造成凝胶内聚性的较大变化,也就是说糖基化改性在提高蛋白凝胶持水性的同时,并没有影响凝胶内部键合作用强度。
[1]潘锦锋,沈彗星,宋永令,等. 鱼蛋白冷冻变性及其抗冻剂的研究综述[J]. 肉类研究,2009(6): 9-15
Pan Jinfeng, Shen Huixing, Song Yongling et al. A Review of Study on Freezing Denaturation of Fish Protein and Its Cryoprotectants[J]. Meat Research, 2009(6): 9-15
[2]Fennema, O R , Powrie W D, Marth E H. Low temperature preservation of foods and living matter. New York: Marcel Dekker, Inc, 1973(1): 1-77
[3]Ohta, F. Tanaka, K. Some properties of the liquid portion in the frozen fish muscle fluid. Bulletin of the Japanese Society of Scientific Fisheries, 1978(44):59-62
[4]曲楠,曾名涌,董士远.海藻糖对罗非鱼糜及蛋白抗冻作用的研究[J]. 肉类研究,2010(1):79-82
Qu Nan, Zeng Mingyong, Dong Shiyuan. The Effect of Trehalose on the Freezing Preservation of Frozen Tilapia Surimi and Protein[J]. Meat Research, 2010(1):79-82
[5]Achouri, A., Boye, J.I., Yaylayan, V.A., et al. Functional properties of glycated soy 11S glycinin [J]. Journal of Food Science, 2005, 70(4):269-274
[6]许彩虹.大豆球蛋白糖基化接枝改性及其热聚集行为的研究[D].华南理工大学, 2001
Xu Caihong. Research on the Glycosylation and Thermal Aggregation of Soybean Globulin-polysaccharide[D]. South China University of Technology, 2001.
[7]Brand C M J. Kinetic Modelling of Reaction in heated Disaccharide-Casein Systems[J]. Analytical Biochemistry, 1976(72):248-254
[8]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976(72):248-254
[9]Blakesley, Boezi J A. New staining technique for proteins in polyacrylamide gels using coomassie brilliant G250[J]. Analytical Biochemistry.1977, 82(2):580-582
[10]张馨木. 质构仪测定冷鲜肉新鲜度方法的研究[D].吉林大学, 2012Zhang Xinmu. Research on Detection Methods of Meat Freshness by Texture Analyzer.Ji Lin University, 2012
[11]苏志光,郭顺堂.大豆蛋白的甘露聚糖糖基化研究[J].大豆科学, 2010(3): 486-489
Su Zhiguang, Guo Shuntang. Study on Glycosylation of Soy Protein Isolated and Mannos[J]. Soybean Science, 2010(3): 486-489
[12]Goetz J,Koehler P.Study of the thermal denaturation of selected proteins of whey and egg by low resolution NMR [J]. Food Science and Technology, 2005, 38 (5): 501-512.
Antifreeze Capacity of Glucose Glycosylated Soybean Protein Isolate Gel
Du Yumeng Chen Zhenjia Shi Xiaodi Xu Jingting Guo Shuntang
(College of Food Sciences, China Agriculture University, Beijing 100083)
To solve the problem that the functional quality decreased caused by soy protein denaturation during frozen storage of frozen food, in this study, SPI (soybean protein isolate) was modified with glucose glycosylated modification, and the change of SPI gel antifreeze capacity was analyzed. According to the research results, the antifreeze capacity of SPI gel could be improved by glucose modification, and the glycosylated modified reaction condition was protein: glucose=2∶1, reaction pH=7, the content of protein was 40 mg/g. According to results such as protein solubility, subunits and gel water distribution of gel produced by glycosylated modified protein during frozen storage, it was concluded that the reason why the antifreeze capacity of modified soybean protein gel was improved was that glucose molecule in the glycosylated modified strengthened constraint of water molecules to reduce the dewatering denaturation of protein. Meanwhile, the steric hindrance effect of sugar molecule grafted on the protein chain could stop aggregation among protein molecules and formation of new bond to keep uniform reticular formation of gel.
glycosylation, SPI (soy protein isolate), antifreeze
TS214.2
A
1003-0174(2016)10-0045-06
国家科技支撑计划(2012BAD34B04)
2015-03-06
杜昱蒙,女,1992年出生,硕士,植物蛋白加工与利用
郭顺堂,男,1962年出生,教授,植物蛋白加工与利用
