复方盐酸苯海拉明糖浆质量控制研究
2016-12-24植国繁巫玲玲蓝献丽蒋敏捷蒋伟哲
植国繁,巫玲玲,蓝 彬,蓝献丽,蒋敏捷,蒋伟哲
(广西医科大学药学院,广西 南宁 530021)
复方盐酸苯海拉明糖浆质量控制研究
植国繁,巫玲玲,蓝 彬,蓝献丽,蒋敏捷,蒋伟哲
(广西医科大学药学院,广西 南宁 530021)
目的 建立复方盐酸苯海拉明糖浆的质量控制方法。方法 采用理化鉴别与薄层色谱(TLC)法对复方盐酸苯海拉明糖浆进行定性鉴别,用高效液相色谱(HPLC)法对盐酸苯海拉明进行含量测定。结果 理化鉴别结果现象显著,薄层色谱斑点清晰、集中。盐酸苯海拉明进样量在4.032~14.112 g范围内与峰面积积分值呈良好线性关系(r=0.999 6),平均加样回收率为98.80%,RSD=1.18%(n=9)。结论 TLC法和HPLC法准确、可靠,可用于复方盐酸苯海拉明糖浆的质量控制。
复方盐酸苯海拉明糖浆;盐酸苯海拉明;高效液相色谱法;质量控制
复方盐酸苯海拉明糖浆是由单糖浆、防腐剂、盐酸苯海拉明、葡萄糖酸钙配制而成,为抗组胺药,适用于治疗过敏性疾病。盐酸苯海拉明可与H1受体结合产生拮抗作用,从而抑制过敏反应,但嗜睡和抗胆碱能作用明显,故其应用受到一定限制[1]。葡萄糖酸钙能改善细胞膜的通透性,与促进神经末梢释放乙酰胆碱产生抗过敏效应,两者在不加大剂量的情况下联用具有协同抗过敏作用[2]。该制剂味甜、口感好,小儿用药依从性高,且效果好,疗效确切。为提高复方盐酸苯海拉明糖浆的质量标准,笔者对其含量测定方法和鉴别方法进行了研究,现报道如下。
1 仪器与试药
EL204型电子天平(梅特勒-托利多仪器上海有限公司);KF10002型电子天平(凯丰集团有限公司);XS205DU型十万分之一电子天平(梅特勒-托利多仪器上海有限公司);KQ-500DB型超声仪(昆山市超声仪器有限公司);LC-20A型高效液相色谱仪、SIL-20A型自动进样器、SPD-20A型紫外检测器、色谱化学工作站(日本岛津公司);Luna 5μm CN 100A色谱柱(250 mm×4.6mm,4μm,广州菲罗门科学仪器有限公司)。乙腈为色谱纯(Fisher Scientific)、超纯水(自制)、其他试剂均为分析纯;盐酸苯海拉明对照品(中国药品生物制品检定所,批号为100066-200807);复方盐酸苯海拉明糖浆(广西医科大学第一附属医院,批号为20150109,20150127,20150318)。
2 方法与结果
2.1 性状
本品为淡黄色液体,味甜,微有麻感。
2.2 鉴别
2.2.1 理化鉴别[3]
取本品50 m L,置分液漏斗中,用三氯甲烷萃取3次,合并萃取液,于水浴上加热蒸干,提取物在80℃干燥后,按下述方法试验。
1)取上述提取物少量,加硫酸1滴,开始出现黄色,随即变成橙红色,滴加蒸馏水,即成白色乳浊液。
2)取上述提取物少量,加蒸馏水溶解后,滴加硝酸银试液,即成白色凝乳状浊液。
2.2.2 薄层色谱鉴别
取本品15.0 mL,置60 m L分液漏斗中,用三氯甲烷萃取3次,每次5mL,取有机层,合并萃取液,作为供试品溶液;取盐酸苯海拉明对照品,加三氯甲烷制成每1m L含1mg的溶液,作为对照品溶液;取空白辅料(缺盐酸苯海拉明)15.0mL,同法制备阴性对照品溶液。照薄层色谱法[2015年版《中国药典(四部)》通则0502][4]试验,吸取上述3种溶液各5μL,分别点于同一硅胶G薄层板上,展开剂为二氯甲烷-甲醇(9∶1)[5],展开,取出,晾干,喷稀碘化铋钾试液,日光下检视,结果见图1。
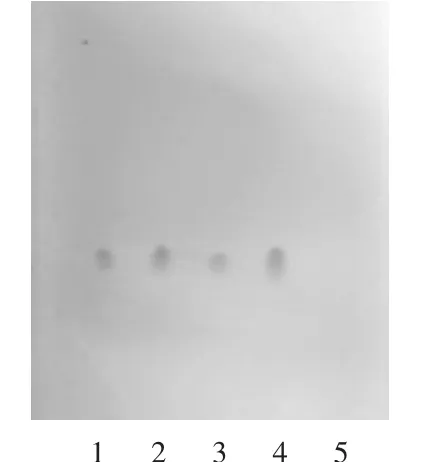
图1 盐酸苯海拉明薄层色谱图
2.3 有关物质检查
2.3.1 检查标准
应符合糖浆剂项下有关规定[2015年版《中国药典(四部)》通则0116][6]。
2.3.2 有关物质[3]
取本品5.0m L,加流动相溶解并稀释成每1mL约含0.5mg的溶液,作为供试品溶液;精密量取1.0m L,置100m L容量瓶中,用流动相稀释至刻度,摇匀,作为对照溶液。照含量测定项下的色谱条件,精密量取对照溶液与供试品溶液各20μL,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的3倍。供试品溶液色谱图中如有杂质峰,单个杂质峰面积不得大于对照溶液主峰面积的0.5倍(0.5%),各杂质峰面积的和不得大于对照溶液主峰面积(1.0%)。色谱图见图2。

图2 盐酸苯海拉明有关物质检查高效液相色谱图
2.4 盐酸苯海拉明含量测定
2.4.1 溶液制备
称取盐酸苯海拉明对照品125 mg,精密称定,置25mL棕色容量瓶中,加流动相溶解并稀释至刻度,摇匀,制成5 g/L的对照品贮备液,避光,置4℃冰箱贮存备用;精密量取对照品贮备液1mL置10mL容量瓶中,加流动相定容至刻度,摇匀,制成1mL含0.5mg的对照品溶液;精密量取装量差异项下的本品5.0mL,置10m L容量瓶中,加流动相稀释至刻度,摇匀,用0.45μm微孔滤膜过滤,即得供试品溶液;取辅料5.0m L,置10m L容量瓶中,加流动相稀释至刻度,摇匀,即得阴性对照品溶液。
2.4.2 色谱条件及系统适用性试验
色谱柱:Luna 5μm CN 100A柱(250mm×4.6mm,4μm);流动相:乙腈-水-三乙胺(50∶50∶0.5,冰醋酸调节pH至6.5)[3];流速:1.0mL/min;柱温:30℃;检测波长:258 nm;进样量:20μL。
取二苯酮5mg,置100mL容量瓶中,加乙腈5mL使溶解,加水稀释至刻度,摇匀;另精密量取盐酸苯海拉明标准品贮备液1mL,置10m L容量瓶中,加入上述二苯酮溶液 1 mL,加流动相稀释至刻度,用微孔滤膜(0.45μm)滤过,取续滤液注入高效液相色谱仪,记录色谱图。理论板数按苯海拉明峰计算不低于5 000,盐酸苯海拉明峰与二苯酮色谱峰的分离度应大于2.0。取2.4.1项下方法制备的阴性对照品溶液,按拟订色谱条件进样测定。结果,阴性对照品溶液在盐酸苯海拉明出峰处无色谱峰出现,表明阴性对照无干扰,见图3。
2.4.3 方法学考察
线性关系考察:精密吸取对照品贮备液0.4,0.6,0.8,1.0,1.2,1.4mL,分别置10mL棕色容量瓶中,加流动相稀释至刻度,摇匀,制成质量浓度分别为0.201 6,0.302 4,0.403 2,0.504 0,0.604 8,0.705 6 g/L的对照品溶液,按2.4.2项下色谱条件分别进样20μL。以对照品进样量(X,mg)为横坐标、峰面积积分值(Y)为纵坐标绘制标准曲线,得回归方程 Y=0.081 4X+ 0.030 8,r=0.999 6(n=6)。结果表明,盐酸苯海拉明进样量在4.032~14.112μg范围内与峰面积线性关系良好。
精密度试验:取同一对照品溶液,按2.4.2项下色谱条件分别连续进样测定6次。结果,盐酸苯海拉明峰面积积分值的 RSD=0.08%(n=6),表明仪器精密度良好。
稳定性试验:取同一批样品(批号为20150318)制备的供试品溶液,在室温下避光放置,分别于0,2,4,8,16,24 h时各进样 20μL测定。结果的 RSD=0.26%(n=6),表明供试品溶液在24 h内稳定。
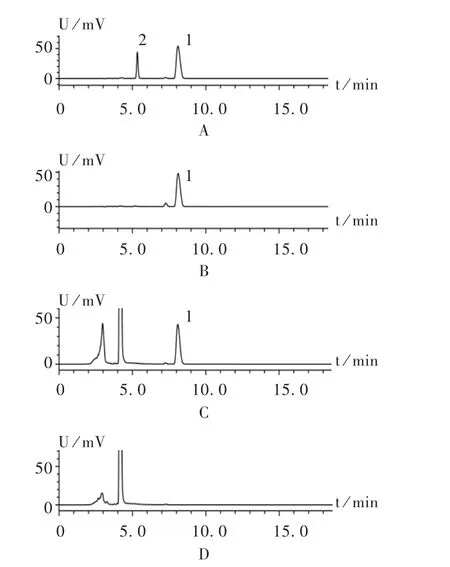
图3 盐酸苯海拉明含量测定高效液相色谱图
重复性试验:取同一批样品(批号为20150318),按2.4.2项下方法制备供试品溶液,按拟订方法平行测定6次。结果的 RSD=0.49%(n=6),表明方法重复性良好。
加样回收试验:按处方比例称取除盐酸苯海拉明外的其他辅料,配成100m L空白糖浆液,另精密量取盐酸苯海拉明对照品贮备液0.8,1.0,1.2m L各3份,用空白糖浆液溶解并定容至刻度,摇匀,按拟订色谱条件各进样20μL测定,计算回收率,结果见表1。
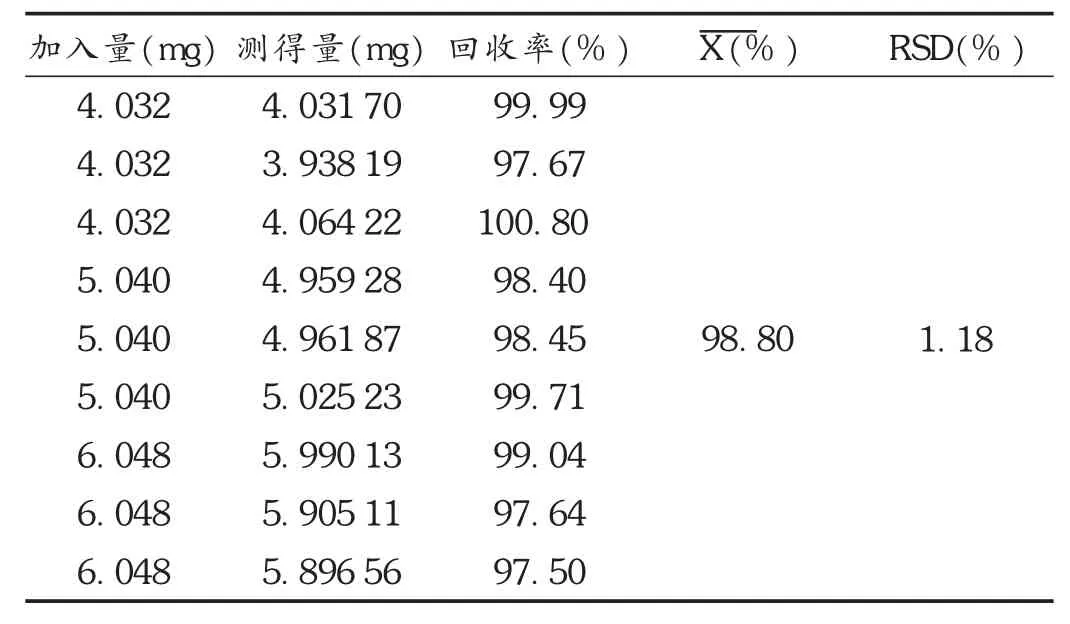
表1 盐酸苯海拉明加样回收试验结果(n=9)
2.4.4 样品含量测定
分别取3批供试品各2份,按2.4.1项下方法制备供试品溶液,按拟订色谱条件各进样20μL测定,计算盐酸苯海拉明的含量。结果见表2。

表2 3批样品中盐酸苯海拉明含量测定结果
3 讨论
复方苯海拉明糖浆含有盐酸苯海拉明和葡萄糖酸钙2种抗过敏药物,前者含量虽少,但其含量是否达标影响临床疗效。现行质量标准采用硝酸银滴定法测定其含量,此方法虽不需要特殊仪器,但由于终点判断要通过肉眼来完成等因素,会影响含量测定的准确性,含量低的成分影响更大。本研究中用高效液相色谱法测定其含量,样品无需复杂的预处理,其他成分不干扰测定,操作简便快速,而且稳定性、精密度均良好,结果准确可靠,可用于控制其质量。
相关研究指出,盐酸苯海拉明的主要降解产物之一是二苯酮[7],本研究中同时建立了有关物质的检查方法,确定了有关物质限量,有利于本品质量控制。
本制剂处方中防腐剂羟苯乙酯也有紫外吸收,故测定盐酸苯海拉明含量时须设法排除其干扰。本研究中用高效液相色谱法成功地将两者分离,提高了方法的专属性和准确度。
[1]张 罗,韩德民.H1抗组胺药[J].临床耳鼻咽喉头颈外科杂志,2013,27(2):104-109.
[2]廖芸芸,杨 斌,王柳萍,等.盐酸苯海拉明与葡萄糖酸钙联用抗过敏的实验研究[J].广西医科大学学报,2005,22(1):41-43.
[3]国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2015:1 001.
[4]国家药典委员会.中华人民共和国药典(四部)[M].北京:中国医药科技出版社,2015:57-59.
[5]冯婉姗,罗双辉.麝香拔湿膏定性定量方法研究[J].药物分析杂志,2010,30(1):120-122.
[6]国家药典委员会.中华人民共和国药典(四部)[M].北京:中国医药科技出版社,2015:20.
[7]吴爱琴,邓 红,叶俊鹏.HPLC法测定盐酸苯海拉明软胶囊中的二苯酮[J].广东药学院学报,2003,19(4):314-315.
Quality Control of Com pound Diphenhyd ram ine Hyd roch loride Syrups
Zhi Guofan,Wu Lingling,Lan Bin,Lan Xianli,Jiang M injie,Jiang Weizhe(Pharmaceutical College,Guangxi Medical University,Nanning,Guangxi,China 530021)
Objective To establish a quality control method for Compound Diphenhydramine Hydrochloride Syrups.M ethods Physical Chemical Identity and TLC were adopted for conducting the qualitative identification of Compound Diphenhydramine Hydrochloride Syrups,HPLC was used to determine the content of Diphenhydramine Hydrochloride in this preparation.Results The results of Physical and Chemical Identification was significant.TLC spots were clear.A good linearity relationship with the peak areas was exhibited(r=0.999 6)when the sample size of Diphenhydramine Hydrochloride was in the range of 4.032-14.112μg.The average recovery rate of diphenhydramine hydrochloride was 98.80%,RSD=1.18%(n=9).Conclusion The method of TLC and HPLC is accurate and specific with good reproducibility.It can be used for the quality control of Compound Diphenhydramine Hydrochloride Syrups.
Compound Diphenhydramine Hydrochloride Syrups;diphenhydramine hydrochloride;HPLC;quality control
R927.2;R976
A
1006-4931(2016)06-0059-03
植国繁,男,硕士研究生,研究方向为新药研究与开发,(电子信箱)726750095@qq.com;蒋伟哲,男,教授,博士研究生导师,研究方向为新药研究与开发,本文通讯作者,(电话)0771-5358272(电子信箱)jiangweizhe6812@163.com。
2015-09-16)
广西高校重点学科和重点实验室建设项目,项目编号:桂教科研[2013]8号-3。
