高效液相色谱法测定苯海拉明乳膏中盐酸苯海拉明的含量
2018-06-19王英超冯婉玉
王英超,于 泽,王 鹏,冯婉玉
(北京大学人民医院药剂科,北京 100044)
苯海拉明乳膏是由盐酸苯海拉明和二甲硅油石蜡乳膏组成的医院制剂,主要作为抗过敏药,用于治疗过敏性皮肤病。长期的临床实践证实,该药具有很好的疗效,受到患者和医师的普遍认可。本研究采用高效液相色谱法(high performance liquid chromatography,HPLC)测定苯海拉明乳膏中盐酸苯海拉明的含量[1-4],为该制剂的质量控制提供依据。
1 材料
1.1 仪器
Agilent 1200型高效液相色谱系统,包括G1312A型二元输液泵、G1329A型自动进样器、G1316A型柱温箱、G1379B型脱气机及G1315D型检测器(美国Agilent公司);Mini-13 K型微型高速离心机(杭州奥盛仪器有限公司);Vortex-Genie型涡旋仪(Scientific Industries公司);GM-50过滤器(天津腾达过滤器件厂);CPA225D型万分之一天平(德国Sartorius公司)。
1.2 药品与试剂
盐酸苯海拉明对照品(中国食品药品检定研究院,批号:100066-200807,纯度≥99%);苯海拉明乳膏(北京大学人民医院;批准文号:京药制字H20064300;批号:171208);甲醇、乙腈(HPLC级,Fisher公司);氨水(北京北化精细化学品有限责任公司,批号:20151009);Direct-Q©超纯水系统(美国Millipore公司)。
2 方法与结果
2.1 色谱条件
色谱柱:Venusil XBP CN柱(4.6 mm×250 mm,5 μm);流动相:乙腈-水-氨水(V∶V∶V=75 ∶25 ∶0.5);检测波长:258 nm;流速:1.0 ml/min;柱温:25 ℃;进样量:5 μl。
2.2 溶液的制备
2.2.1 盐酸苯海拉明标准溶液:精密称定盐酸苯海拉明对照品0.1 g,置于100 ml容量瓶中,加甲醇溶解,稀释至刻度并混匀,制得1 mg/ml的盐酸苯海拉明储备液。精密吸取1、2、4、6及8 ml置于10 ml容量瓶中,用甲醇稀释至刻度,摇匀,制成质量浓度为0.1、0.2、0.4、0.6及0.8 mg/ml盐酸苯海拉明标准溶液。
2.2.2 质控样品标准溶液:精密称定盐酸苯海拉明对照品0.01 g,置于10 ml容量瓶中,加甲醇溶解,稀释至刻度并混匀,配制成1 mg/ml的盐酸苯海拉明储备液。精密吸取1、4 ml置于10 ml容量瓶中,用甲醇稀释至刻度,摇匀,制成质量浓度为0.1、0.4 mg/ml盐酸苯海拉明质控样品标准溶液。
2.2.3 供试品溶液:精密称取5%苯海拉明乳膏1 g(相当于盐酸苯海拉明50 mg),置于100 ml烧杯中,加入甲醇40 ml,80 ℃水浴加热10 min,搅拌,趁热定量转移至100 ml容量瓶中,放冷至室温(25 ℃),用甲醇稀释至刻度,摇匀,冰浴冷却2 h以上,取出后迅速过滤,取续滤液作为供试品溶液进样分析。
2.2.4 阴性样品溶液:按处方比例,配制不含盐酸苯海拉明的制剂,再按“2.2.3”项下方法制备即得。
2.3 方法专属性试验
取空白溶剂(甲醇)、盐酸苯海拉明对照品溶液(0.6 mg/ml)、供试品溶液(0.5 mg/ml)、盐酸苯海拉明-二苯酮溶液(0.5 mg/ml)及阴性对照品溶液(空白基质)各5 μl,按“2.1”项下色谱条件进样测定。结果表明,空白溶剂和供试品中的辅料不干扰盐酸苯海拉明的测定,方法专属性良好,见图1。
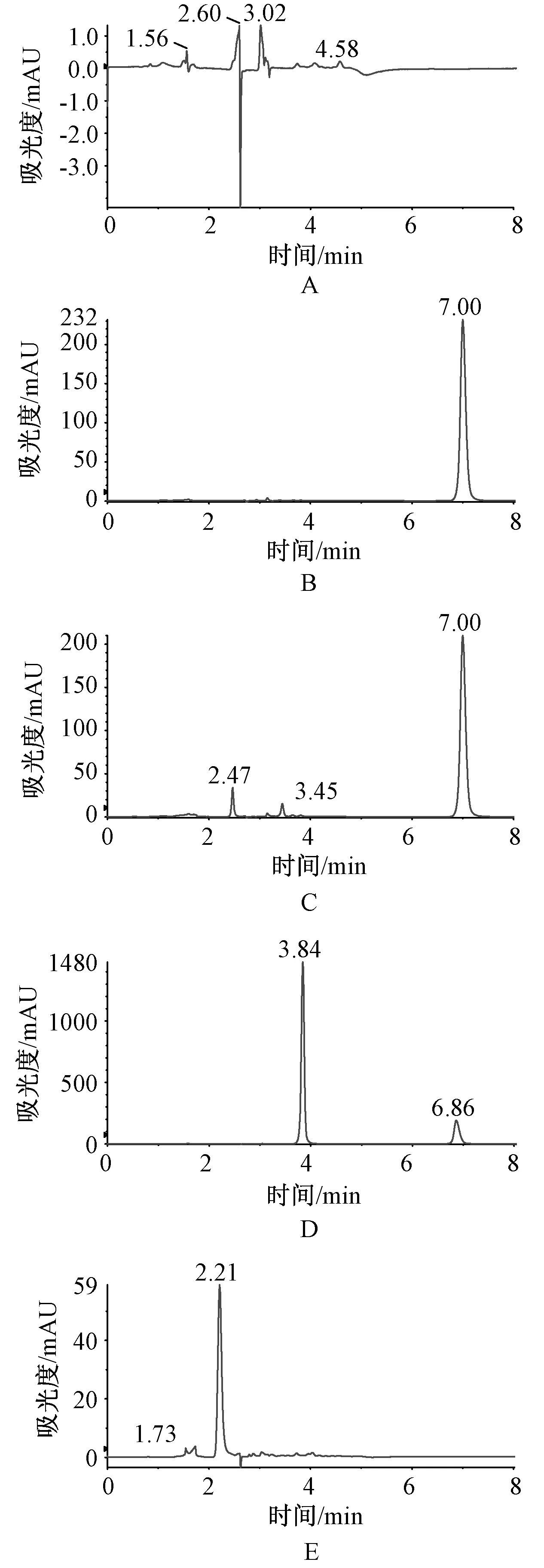
A.空白溶剂;B.盐酸苯海拉明对照品溶液(0.6 mg/ml);C.供试品溶液(0.5 mg/ml);D.盐酸苯海拉明-二苯酮溶液(0.5 mg/ml);E.阴性对照溶液A. blank solvent; B. diphenhydramine hydrochloride reference solution (0.6 mg/ml); C. test solution (0.5 mg/ml); D. diphenhydramine hydrochloride-diphenylketone solution(0.5 mg/m); E. negative reference solution
2.4 线性关系考察
取质量浓度为0.1、0.2、0.4、0.6、0.8及1.0 mg/ml的盐酸苯海拉明标准溶液5 μl进样分析,记录色谱图。以盐酸苯海拉明的质量浓度为横坐标(X),盐酸苯海拉明的峰面积为纵坐标(Y),用加权最小二乘法(W=1/x2)进行回归,得标准曲线的回归方程。盐酸苯海拉明的线性方程为Y=0.03X+24.96,R2=0.999 8;结果表明,盐酸苯海拉明在0.1~1.0 mg/ml范围内,质量浓度与峰面积呈良好的线性关系。
2.5 精密度试验
取盐酸苯海拉明低、中及高质量浓度(0.1、0.4及1 mg/ml)质控样品溶液,分别连续进样6次,得日内精密度;连续进样3 d,得日间精密度[5-6]。记录盐酸苯海拉明峰面积,结果显示,RSD均<0.5%,表明方法精密度良好。
2.6 稳定性试验
精密称定盐酸苯海拉明对照品0.043 4 g,置于10 ml容量瓶中,加甲醇溶解并稀释至刻度,配制成0.434 mg/ml盐酸苯海拉明对照品溶液,分别于0、2、4、8及24 h取5 μl进样分析,记录盐酸苯海拉明峰面积,结果RSD为0.25%,表明盐酸苯海拉明溶液在24 h内稳定性良好。
2.7 绝对回收率试验
按照低、中及高质量浓度分别精密称取3份盐酸苯海拉明原料药,置于100 ml烧杯中,分别加入苯海拉明乳膏空白基质1 g,加入40 ml甲醇,置于80 ℃水浴加热10 min,搅拌,趁热定量转移至100 ml容量瓶中,放冷至室温,用甲醇稀释至刻度,摇匀,冰浴冷却2 h以上,取出后迅速过滤,取续滤液5 μl进样分析,记录色谱图,计算平均回收率[7-8]。结果表明,低、中及高3个级别质量浓度的绝对回收率在98.0%~102.0%范围内,符合要求,见表1。
2.8 重复性试验
准确称取苯海拉明乳膏(批号:171208,标示含量5%)1 g(相当于盐酸苯海拉明50 mg),置于100 ml烧杯中,加入甲醇40 ml,置于80 ℃水浴加热10 min,搅拌,趁热定量转移至100 ml容量瓶中,放冷至室温,用甲醇稀释至刻度,摇匀,冰浴冷却2 h以上,取出后迅速过滤,取续滤液5 μl进样分析,平行操作6份,记录色谱图[9-10]。结果显示,RSD为0.43%,表明本方法重复性较好。
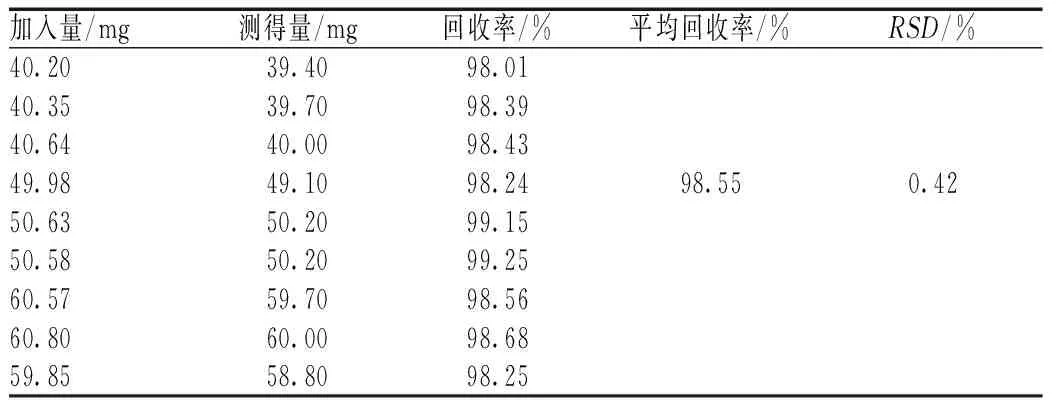
表1 绝对回收率试验结果Tab 1 Results of absolute recovery test
3 讨论
本研究比较了不同溶剂如水、甲醇、乙醇及其混合液对样品溶解效果的影响[11-13]。结果显示,单用水做溶剂时,样品不溶;常温条件下甲醇溶解效果不佳。因此,考虑采用以加热的方式促进本品在甲醇中溶解,并经放冷迅速过滤,综合效果较好。本研究考察了流动相中水相与有机相的比例,结果显示,二者比例为25 ∶75时,出峰时间较合适且不受杂峰干扰,而加入0.5%的氨水则可将峰形调至最佳[14-15]。
本研究建立的苯海拉明乳膏中盐酸苯海拉明的含量测定方法准确度较高,重现性较好,操作简便,为医院制剂苯海拉明乳膏的质量控制提供了科学依据。
[1]李傍娣,程江.HPLC法测定盐酸苯海拉明乳膏的含量[J].西北药学杂志,2012,27(1):41-43.
[2]郭美华,马妍妍,刘世萍.盐酸苯海拉明乳膏的制备及质量控制[J].中国药师,2010,13(3):392-393.
[3]张军,李瑞林,翟青,等.高效液相色谱法测定盐酸苯海拉明霜的含量[J].中国医院药学杂志,2003,23(4):249-250.
[4]会书钧.高效液相法测定复方樟脑乳膏中盐酸苯海拉明的含量[J].药品鉴定,2009,6(28):48-49.
[5]魏锋,刘薇,严华,等.我国中药材及饮片的质量情况及有关问题分析[J].中国药学杂志,2015,4(50):277-283.
[6]于泽,钟雪,李泰锋,等.高效液相色谱法测定人全血中羟氯喹浓度[J].中国临床药理学杂志,2017,33(11):1013-1015.
[7]朱雪妍.HPLC-ELSD法测定胃可宁片中贝母素甲和贝母素乙含量[J].中国医院用药评价与分析,2015,15(2):165-167.
[8]安珍珍,杨云,任磊,等.RP-HPLC法同时测定复方苯海拉明滴鼻液中3种成分的含量[J].中国药房,2017,28(18):2573-2575.
[9]刘炜,曾蔚欣,刘礼斌,等.反相离子对高效液相色谱法测定复方苯海拉明滴鼻液中盐酸苯海拉明和盐酸麻黄碱的含量[J].中国药房,2011,22(41):3894-3896.
[10] 颜挺,唐杨,晁若冰.反相离子对高效液相色谱法测定中药橡胶膏中盐酸苯海拉明的含量[J].药物分析杂志,2008,28(3):437-439.
[11] 植国繁,巫玲玲,蓝彬,等.复方盐酸苯海拉明糖浆质量控制研究[J].中国药业,2016,25(6):59-61.
[12] 胡立禄,高全清,刘振良.苯海拉明联合泼尼松预防碘造影剂过敏反应的临床观察[J].中国药房,2016,27(6):765-767.
[13] 王心怡,张志荣.美吡拉敏敏感的、逆质子有机阳离子转运体的研究进展[J].药学学报,2016,51(6):886-891.
[14] 贾恒明,张华峰,戴博,等.HPLC法测定止痒灵搽剂中盐酸苯海拉明的含量[J].解放军药学学报,2016,32(6):538-539.
[15] 余秀萍.RP-HPLC法测定玉真散胶囊中欧前胡素的含量[J].中国医院用药评价与分析,2016,16(s1):275-277.
