淮北采煤塌陷湖大型底栖动物群落结构季节动态研究
2016-12-23李晓明丁建华
李晓明,丁建华
(淮北师范大学 生命科学学院,淮北 235000)
淮北采煤塌陷湖大型底栖动物群落结构季节动态研究
李晓明,丁建华
(淮北师范大学 生命科学学院,淮北 235000)
2013年9月、12月和2014年3月、6月对淮北采煤塌陷区刘桥湖和临涣湖的大型底栖动物群落结构进行了采样调查,共采集到底栖动物 32种,隶属于 3门 6纲。统计数据表明,刘桥湖和临涣湖底栖动物年平均密度分别为 210.95和181.65 ind/m2,年平均生物量分别为 60.55和 40.17 g/m2。两湖Shannon-Wiener多样性指数(H′)和Margalef 多样性指数(D)季节变化趋势较为一致,12月均为最低,而6、9月相对较高,其中,Margalef指数季节性变化更为明显(F(3,16)> 3.95,P< 0.05)。在空间尺度上,SIMPER与One-Way ANOSIM分析结果表明在刘桥湖与临涣湖之间,底栖动物群落结构不同季节间优势种类的组成存在差异。
大型底栖动物;群落结构;季节动态;采煤塌陷湖
淮北市地处皖北,位于苏、鲁、豫、皖四省之交,属中纬度暖温带半湿润季风气候区,四季分明。作为国家的重要煤炭基地,淮北煤矿区采空塌陷始于20世纪 60年代[1]。目前,淮北全境采空塌陷面积达 157.86 km2,预测到 2020年,累计塌陷水域达 300 km2以上[2]。塌陷区内积水成湖,单个湖泊最大面积约 36.0 km2,底质多为煤矸石和粉煤灰,形成了较为特殊的水生态系统[2]。由于生活废水和工业污水的不断流入汇集,以及密集的渔业养殖对水体环境造成的污染等众多原因,淮北塌陷湖已出现了富营养化问题[3]。
大型底栖动物是一个庞杂的类群,主要包括寡毛类、水生昆虫、软体动物等,是湖泊生态系统的重要组成部分[4]。大型底栖动物以藻类、有机物颗粒和凋落物为食,部分为肉食性捕食者,同时其本身也是鱼类的重要食物来源。因此,大型底栖动物在水生态系统物质循环和能量流动过程中起着关键作用。大型底栖动物多数生活在湖底地质中,个体活动差,对于环境污染及变化主动适应能力弱,群落的破坏与重建需要相对较长的时间[5]。同时,不同类群的底栖动物对生境条件的耐受性,及对水质污染等外部因素的敏感性不同,利用其种群结构和生物学指数等参量可以确切反映和评价水体的健康状况,并有效地指示水生态系统的变化趋势[6]。煤矿塌陷湖相对于自然形成湖泊生态环境具有一定特殊性,但到目前为止,关于大型底栖动物群落结构的研究却鲜有报道。本研究选取淮北采煤塌陷湖的 2个典型——刘桥湖和临涣湖,进行大型底栖动物群落结构的研究,以期为塌陷区水生态系统的科学管理、生态修复和生物多样性保护提供一定的科学依据。
1 材料与方法
1.1 研究地点与采样时间
刘桥湖和临涣湖的地理位置等信息如表 1所示。依据塌陷湖水面形状、地理方位,以及面积相对较小的特点,两湖分别设东、西、南、北、中 5个采样点。根据当地节气特点,分别于 2013年 9月(秋)、12月(冬)和 2014年 3月(春)、6月(夏),对水域的水质参数和底栖动物分布状况进行调查。

表1 淮北煤矿区塌陷湖采样区基本情况
1.2 样品采集
使用 1/16 m2的彼得逊采泥器和直径为 0.3 m、40目的 D形抄网采样,每个样点各采集3次,通过 60目钢筛过滤洗净,在白瓷盘中筛选,分装到 10%的福尔马林溶液标本瓶中固定保存。样品带回实验室,在体视镜和显微镜下进行样品分类鉴定[7-8]。计数后,用吸水滤纸吸去样品表面溶液,在电子天平上称重,根据结果计算单位密度和生物量。
采用多参数水质检测仪(HORIBA,W-23XD)对水温、pH值和溶解氧现场测定;使用透明度盘现场测得透明度;水深则直接采用标杆进行测定;总氮和总磷浓度参考相关文献实验室内测定[9]。
1.3 生物学指数
生物学指数采用 Shannon-Wiener多样性指数、Margalef多样性指数,计算公式如下所示:
Shannon-Wiener多样性指数(H′):
式中,Pi为物种i的个体数占总个体数的比例,S为物种数。
Margalef 多样性指数(D):
D=(S-1)/lnN
式中,N为样品中所有物种的总个体数,S为样品中物种种类总数。
1.4 数据分析
采用SPSS13.0对生物密度与生物量进行ANOVA分析,采用大型多元统计软件PRIMER 5.0(Plymouth Routines In Multivariate Ecological Research)对底栖动物群落进行SIMPER(Similarity Percentages)和ANOSIM(Analysis of Similarities)分析。分析前对原始数据进行log10(x+1)转换,对稀有物种进行了加权。
2 结果与分析
2.1 刘桥湖和临涣湖的理化指标
两湖的环境理化参数均呈现显著的季节性变化(P<0.05)。6月和 9月的水温、pH值、总磷浓度均高于 3月和 12月,总磷最高值出现在 9月;6月和 9月溶解氧含量及透明度明显低于 3月和 12月,且最小值都出现在 9月(表 2)。
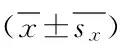
表2 刘桥湖与临涣湖的水体理化性质(平均值±标准误)
注:不同的字母上标表示同一地点不同季节间的差异(P<0.05,Duncan’s test)
2.2 底栖动物群落组成
共采得底栖动物 32种,隶属于 3门 6纲,分别为:节肢动物 19种(水生昆虫 18种,甲壳类 1种),占物种总数 59.4%;环节动物 8种(寡毛类 7种,蛭纲 1种),占物种总数25%;软体动物 5种,占物种总数 15.6%。刘桥湖 26种(寡毛类 6种,软体动物 3种,水生昆虫 15种,蛭纲 1种,甲壳类 1种),临涣湖 21种(寡毛类 4种,软体动物 4种,水生昆虫 12种,甲壳类 1种),见表3。
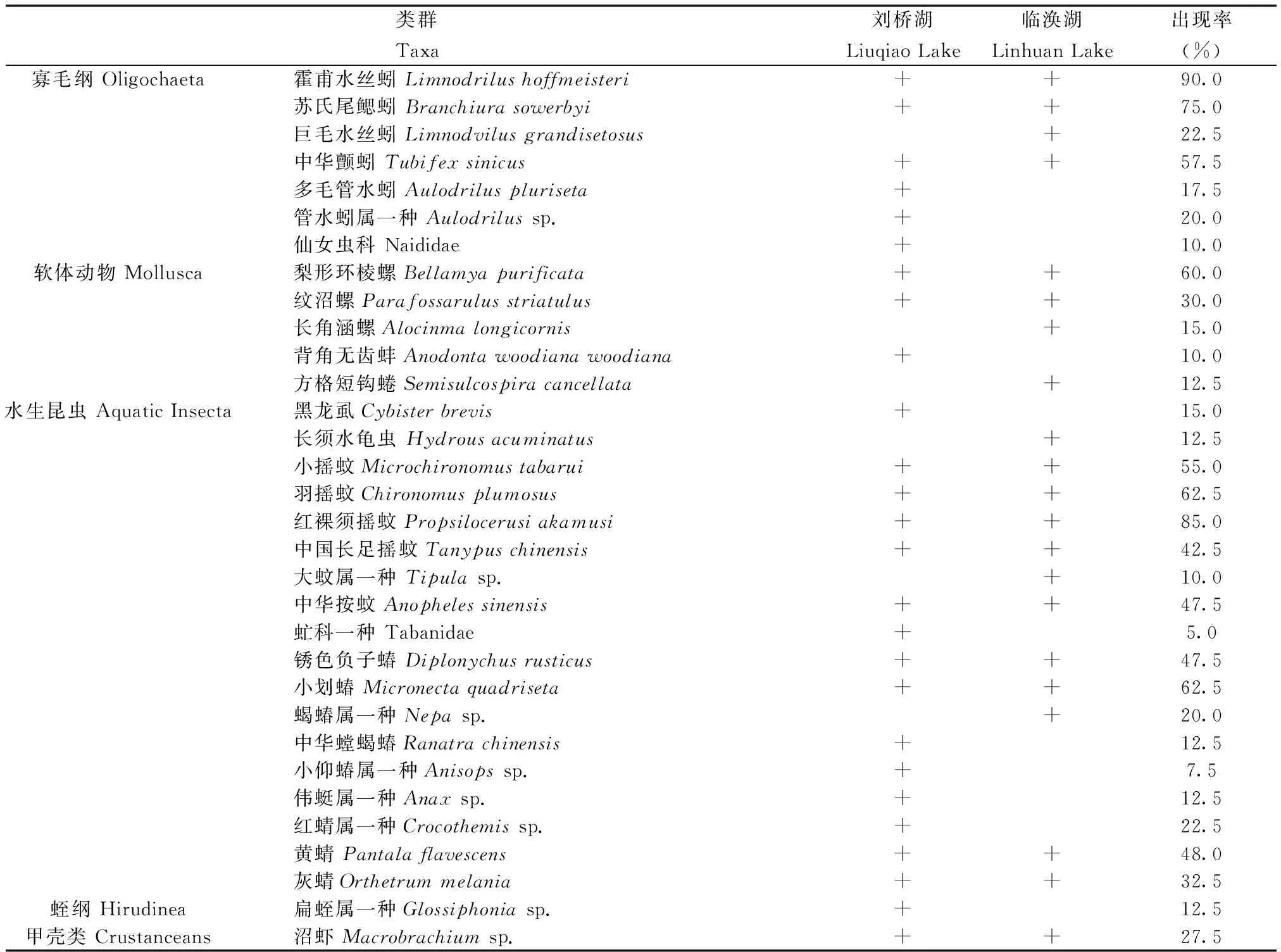
表3 淮北煤矿区塌陷湖大型底栖动物群落组成
2.3 底栖动物密度及生物量的季节变化
刘桥湖和临涣湖的大型底栖动物年平均密度分别为210.95和 181.65 ind/m2,年平均生物量分别为 60.55和 40.17 g/m2。就密度而言,两湖 12月处于较低水平,而 6月与 9月则有明显增加,其中刘桥湖 9月密度增加最为明显(F(3,16)> 7.32,P< 0.01),见图1。生物量的季节性变化在两湖中表现出与密度变化趋势相一致的态势,在 3月与 12月处于较低的水平,9月处于最高水平,全年呈现明显的季节性变化(F(3,16)> 9.25,P< 0.01,见图 1。从不同季节底栖动物各类群所占百分比来看,在密度上,寡毛类和水生昆虫为优势类群;在生物量上,则是软体动物和水生昆虫,它们对生物量的影响显著(表 4)。
在共计120份样品中,霍甫水丝蚓(Limnodrilushoffmeisteri)出现频率最高,为 90.0%;红裸须摇蚊(Propsilocerusiakamusi)和苏氏尾鳃蚓(Branchiurasowerbyi)次之,出现频率依次为 85.0%和 75.0%;小划蝽(Micronectaquadriseta)、羽摇蚊(Chironomusplumosus)、梨形环棱螺(Bellamyapurificata)、中华颤蚓(Tubifexsinicus)、小摇蚊(Microchironomustabarui)、中华按蚊(Anophelessinensis)等出现频率也均超过 50%,分别为 62.5%、62.5%、60.0%、57.5%和 55.0%。

图1 刘桥湖与临涣湖大型底栖动物生物密度与生物量的时间变化(平均值±标准误)
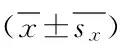
表4 淮北矿区塌陷湖底栖动物密度和生物量百分比的季节变化(%)
Table 4 Seasonal changes of the density and biomass percentageof macrozoobenthos in collapsed lakes of Huaibei mining area(%)

月份Month类别Taxa刘桥湖LiuqiaoLake密度百分比Densitypercentage生物量百分比Biomasspercentage临涣湖LinhuanLake密度百分比Densitypercentage生物量百分比Biomasspercentage3月寡毛类26.567.4646.3210.90软体动物3.1333.023.3040.76水生昆虫70.1059.3050.3848.34蛭纲0.210.22--6月寡毛类41.002.1965.284.23软体动物5.4147.132.7213.21水生昆虫52.5143.4831.4162.18蛭纲0.690.30--甲壳类0.396.900.5920.389月寡毛类60.732.1652.624.13软体动物4.5947.017.1926.62水生昆虫33.4434.5639.3949.56蛭纲0.530.72--甲壳类0.7115.550.8019.6912月寡毛类45.666.6335.197.02软体动物0.7414.585.7455.73水生昆虫53.6078.7959.0737.25
2.4 生物多样性指数
刘桥湖和临涣湖的Shannon-Wiener指数 12月最低,而 6、9月相对较高,但全年均无显著差别(F(3,16)< 3.14,P> 0.05),始终保持在介于 2.0~3.5这样一个较高的水平;Margalef指数的变化趋势虽与Shannon-Wiener指数较一致,亦表现出 12月最低、6月最高的态势,但其季节性变化甚为明显(F(3,16)> 3.95,P<0.05,见图2。

图2 Shannon-Wiener指数与Margalef指数的季节性变化(平均值±标准误)
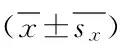
2.5 底栖动物群落结构组成的相似性分析
在空间尺度上,SIMPER与One-Way ANOSIM分析结果表明在刘桥湖与临涣湖之间,底栖动物群落结构优势种类的组成存在一定差别,其不相似百分比Dis刘,临= 57.34%,GlobalR=0.277,P<0.001。在时间尺度上,底栖动物群落结构优势种类的组成亦存在明显区别,其不相似百分比最小值Dis6月,9月为45.72%、最大值Dis6月,12月为63.06%,GlobalR=0.24,P<0.001。霍甫水丝蚓、苏氏尾鳃蚓、中华颤蚓和红裸须摇蚊无论是在空间尺度上,还是在时间尺度上,均为优势种类(表 5)。
表5 刘桥湖与临涣湖大型底栖动物优势种平均密度(ind·m-2)及其对组内相似性贡献百分比的时空变化
Table 5 Temporal and spatial variation of the mean density of dominant species for each group and the contribution towithin group similarity of the macrozoobenthos in Liuqiao Lake and Linhuan Lake

优势物种空间变化刘桥湖临涣湖时间变化3月6月9月12月霍甫水丝蚓51.35(20.90%)38.05(21.53%)28.30(23.47%)51.30(20.57%)89.80(23.73%)9.40(10.72%)红裸须摇蚊29.50(17.59%)25.85(16.31%)39.80(26.48%)12.40(8.87%)31.80(13.20%)26.70(23.24%)长足摇蚊23.15(12.22%)-14.90(3.23%)18.30(5.36%)--苏氏尾鳃蚓24.85(11.66%)32.35(15.28%)13.50(6.85%)43.30(14.79%)41.10(11.55%)16.50(20.76%)中华颤蚓11.20(7.18%)13.25(5.21%)9.20(3.08%)14.20(4.77%)16.20(8.48%)9.30(7.74%)羽摇蚊18.40(7.04%)11.00(7.15%)32.80(14.66%)6.90(3.75%)-9.80(12.07%)小摇蚊5.15(3.81%)10.40(6.70%)8.90(10.15%)3.50(2.13%)-11.90(14.81%)梨形环棱螺4.75(3.13%)3.50(4.55%)-3.50(4.83%)8.50(5.31%)2.20(3.22%)小划蝽3.25(2.72%)6.30(4.89%)2.50(2.60%)5.10(6.20%)10.30(7.98%)-中华按蚊9.85(2.71%)11.50(4.21%)-23.50(12.68%)17.80(10.02%)-管水蚓属一种4.50(1.83%-----多毛管水蚓-12.20(4.13%)----锈色负子蝽-2.65(2.83%)-2.70(2.37%)4.60(3.23%)-黄蜻属一种---5.00(2.65%)5.40(4.30%)-纹沼螺---3.50(2.55%)--沼虾一种----2.10(2.71%)-合计185.95(90.81%)167.05(92.78%)149.9(90.51%)193.2(91.51%)227.6(90.50%)85.8(92.56%)
3 讨论与结论
采煤塌陷形成的封闭性湖泊,自净能力较差,底质主要为煤炭废弃物粉煤灰和煤矸石,是一种特殊的淡水生态类型[10]。与我国大型淡水湖泊相比[11-13],淮北塌陷湖大型底栖动物的生物多样性较低,群落结构相对简单,这应与水域面积[14]、大型水生植物[15]、底质异质性[16]、沉积物稳定程度以及表面构造[17]等诸多环境因素密切相关。淮北塌陷湖形成时间较短,湖面较小,湖底异质性较差,底质多为煤矸石和粉煤灰,有机质贫瘠,大型水生植物难以生存,这些都是淮北煤矿塌陷湖大型底栖动物数目较低、群落结构较为简单的重要原因。
刘桥湖与临涣湖的寡毛类和摇蚊幼虫个体占绝对优势,优势类群相对集中,致使Shannon-Wiener指数全年均无显著区别;Margalef指数的变化趋势虽与Shannon-Wiener指数较一致,表现为 12月最低、6月最高,但其季节性变化更为明显。从优势类群的组成和存量比例来看,耐污性种类红裸须摇蚊和霍甫水丝蚓出现率高,两者均是湖泊富营养化的典型指示物种[18]。研究表明,塌陷湖大型底栖动物群落在季节上存在明显变化,生物多样性、密度和生物量均存在明显差异。从种群组成结构来看,刘桥湖与临涣湖密度均以寡毛类和水生昆虫占优势,霍甫水丝蚓、苏氏尾鳃蚓、摇蚊为密度优势类群,而生物量优势类群为软体动物。
结果表明,两湖泊的底栖动物的密度季节变化主要与寡毛类和摇蚊的数量有关,生物量季节变化主要与腹足类和水生昆虫非双翅目种类个体数量有关。寡毛类密度高峰出现在夏、秋季的 6月和 9月,此时总氮和总磷含量较高,这种营养水平高的底质生境易引起寡毛类密度和生物量的增加[19],尤其是耐污度极高的直接收集者霍甫水丝蚓和苏氏尾鳃蚓[20]。摇蚊密度高峰出现在冬、春季的 12月和 3月,当温度较高平均水温大于 19℃时,摇蚊发生垂直迁移,绝大多数迁移至较深的底质中[21],因而夏、秋季 6月和 9月采获摇蚊幼虫的数量低。腹足类软体动物在春季开始繁殖,夏季密度增加,但此时个体较小,秋季个体长大,到了冬季以后,大个体开始死亡,因而软体动物的密度在 6月和 9月高,3月和 12月最低,而生物量在 9月高[22]。水生昆虫鞘翅目及半翅目种类夏季密度升高,生物量也有明显的增加。
SIMPER与One-Way ANOSIM分析结果表明,在空间和时间两个尺度上,霍甫水丝蚓、苏氏尾鳃蚓、中华颤蚓和红裸须摇蚊这 4个物种均为刘桥湖和临涣湖的优势种类。SIMPER 分析表明两湖不同季节间大型底栖动物群落结构存在差异,且这些差异的主要贡献物种为寡毛类和摇蚊幼虫。刘桥湖湖面较为封闭,整体生境差异不显著。临涣湖临近工业园区,周边有选煤厂和部分农田,煤化工生产和化肥农药使用经雨水淋溶流入塌陷湖,影响湖水的碱性,东北侧有水闸,开闸期外部河水也会对塌陷区内的水质产生影响。pH值、溶解氧等这些物理因素差异均有可能是造成底栖动物群落结构出现时空异质性的原因[23]。
[1]完永钊,马洪康,王素芳.淮北市采煤塌陷区土地综合开发研究[J].地质灾害与环境保护,2007,18(4): 52-55.
[2]朱省峰.安徽省淮北市煤矿采空塌陷现状与治理对策分析[J].安徽地质,2009,19 (1): 75-77.
[3]邓道贵,金显文,葛 茜,等.淮北采煤塌陷区小型湖泊轮虫群落结构的季节变化[J].湖泊科学,2012,24(1): 111-116.
[4]段学花,王兆印,徐梦珍.底栖动物与河流生态评价[M].北京:清华大学出版社,2010.
[5]姜忠峰,李畅游,张 生.呼伦湖底栖动物调查与水质评价[J].江苏农业科学,2013,41(6):321-323.
[6]戴纪翠,倪晋仁.底栖动物在水生生态系统健康评价中的作用分析[J].生态环境,2008,17(6): 2107-2111.
[7]韩茂森,束蕴芳.中国淡水生物图谱[M].北京: 海洋出版社,1995.
[8]刘建康.高级水生生物学[M].北京: 科学出版社,1999.
[9]刘辉利,纪锐琳.地表水总氮总磷联合消解测定方法的研究[J].干旱环境监测,2005,19(2): 65-67.
[10]PETTY J T,GINGERICH G,ANDERSON J T,et al.Ecological function of constructed perennial stream channels on reclaimed surface coal mines[J].Hydrobiologia,2013,720(1): 39-53.
[11]CAI Y J,GONG Z J,QIN B Q.Benthic macroinvertebrate community structure in Lake Taihu,China: effects of trophic status,wind-induced disturbance and habitat complexity[J].Journal of Great Lakes Research,2012,38(1): 39-48.
[12]JI L,SUN A H,CHEN X,et al.Intra-habitat heterogeneity of macrozoobenthic community under varying degrees of eutrophication and sediment characteristics in a Chinese large shallow lake (Lake Taihu) [J].Fresenius Environmental Bulletin,2012,21: 406-412.
[13]汪 星,郑丙辉,刘录三,等.洞庭湖典型断面底栖动物组成及其与环境因子的相关分析[J].中国环境科学,2012,32(12): 2237-2244.
[14]OERTLI B,JOYE D A,CASTLLA E,et al.Does size matter? the relationship between pond area and biodiversity[J].Biological Conservation,2002,104(1): 59-70.
[15]谢志才,马 凯,叶 麟,等.保安湖大型底栖动物结构与分布格局研究[J].水生生物学报,2007,31(2): 174-183.
[16]BUSS D F,BAPTISTA D F,NESSIMIAN J L,et al.Substrate specificity,environmental degradation and disturbance structuring macroinvertebrate assemblages in neotropical streams[J].Hydrobiologia,2004,518(1): 179-188.
[17]PERLTA L,ESCOBAR E,ALCOCER J,et al.Oligochaetes from six trophicl crater lakes in Central Mexico: species composition,density and biomass[J].Hydrobiologia,2002,467(1): 109-116.
[18]GY RGY D,JUDIT M.An attempt to trace eutrophication in a shallow lake (Balaton,Hungary) using chironomids[J].Hydrobiologia,1983,103(1): 169-175.
[19]TEVESZ M J S,SOSTER F M,MCALL P L.The effects of size-selective feeding by oligochaetes on the physical properties of river sediments[J] .Journal of Sedimentary Petrology,1980,50(2): 561-568.
[20]RODRIGUEZ P,MARTINEZ-MADRID M,ARRATE J A,et al.Selective feeding by the aquatic oligochaeteTubifextubifex(Tubificidae,Clitellata) [J].Hydrobiologia,2001,463(1): 133-140.
[21]YAMAGISHI H,FUKUHARA H.Ecological studies on chironomids in Lake Suwa.I.population dynamics of two large chironomids,ChironomusplumosusL.andSpaniotomaakamusiTokunaga[J].Oecologia,1971,7(4): 309-327.
[22]舒凤月,张承德,张 超,等.南四湖大型底栖动物群落结构及水质生物学评价[J].生态学杂志,2014,33(1): 184-189.
[23]STOERTZ M W,BOURNE H,KNOTTS C,et al.The effect of isolation and acid mine drainage on fish and macroinvertebrate communities of Monday Creek,Ohio,USA[J].Mine Water and the Environment,2002,21(2): 60-72.
Community structure and seasonal variation of macrozoobenthosin collapse lakes of Huaibei mining areas
LI Xiao-ming,Ding Jian-hua
(School of Life Sciences,Huaibei Normal University,Huaibei 235000,China)
Seasonal variations in community structure of macrozoobenthos were investigated in collapsed lakes of Huaibei mining areas Liuqiao Lake and Linhuan Lake in September (autumn) and December (winter) of 2013,and in March (spring) and June (summer) of 2014.A total of 32 species belonging to 6 classes and 3 phylum were collected.The average densities were 210.956 ind/m2in Liuqiao Lake and 181.65 ind/m2in Linhuan Lake.The average biomass of macrozoobenthos were 60.55 g/m2in Liuqiao Lake and 40.17 g/m2in Linhuan Lake,respectively.The seasonal changes of Shannon-Weiner index (H′) and Margalef index (D) were same.The two indexes were all lowest in December,and higher in June and September.The seasonal change of Margalef index was more obvious (F(3,16)> 3.95,P<0.05).The analyses of SIMPER and One-Way ANOSIM indicated that community structure of dominant species of macrozoobenthos was obviously different between Liuqiao Lake and Linhuan Lake.
macrozoobenthos; community structure; seasonal variation; collapsed lake
2016-01-12;
2016-01-25
收稿日期:国家自然科学基金项目(No.31240075)资助;安徽高校省级自然科学研究重点项目(No.KJ2013A233)
李晓明,博士,副教授,主要从事昆虫系统与生态学研究,E-mail: lixiaomingchnu@126.com
丁建华,博士,副教授,主要从事湖沼生态学研究,E-mail: 59823039@qq.com
10.3969/j.issn.2095-1736.2016.06.057
Q958.8
A
2095-1736(2016)06-0057-05
