低温胁迫对鱼类PI3K/AKT/GSK-3β信号通路的影响
2016-12-23王金凤牛虹博陈良标
王金凤,胡 鹏,牛虹博,陈良标
(1.上海海洋大学 水产与生命学院,上海 201306;2.上海海洋大学省部共建水产种质资源发掘与利用教育部重点实验室,上海 201306)
低温胁迫对鱼类PI3K/AKT/GSK-3β信号通路的影响
王金凤1,2,胡 鹏1,2,牛虹博1,2,陈良标1,2
(1.上海海洋大学 水产与生命学院,上海 201306;2.上海海洋大学省部共建水产种质资源发掘与利用教育部重点实验室,上海 201306)
为探讨PI3K/AKT/GSK-3β信号通路在鱼类低温胁迫中的分子机制,利用3种抗寒能力不同的鱼类:斑马鱼(Daniorerio)、罗非鱼(Oreochromisniloticus)和草鱼(Ctenopharyngodonidellus),对其进行低温胁迫(8℃),监测这3种鱼鱼鳃中PI3K/AKT/GSK-3β信号通路中蛋白表达情况。结果表明:1)在相同低温胁迫下,3种鱼运动能力为:草鱼 > 斑马鱼 > 罗非鱼;2) Western blot结果表明:在罗非鱼中,低温抑制了p-PTEN蛋白的表达;诱导了AKT、p-AKT(Ser 473)和p-GSK-3β(Ser 9)蛋白的表达。在斑马鱼和草鱼中,低温都抑制了AKT和p-AKT(Ser 473)蛋白的表达;诱导了p-GSK-3β(Ser 9)蛋白的表达。尽管低温一致性诱导p-GSK-3β(Ser 9)在3种鱼中的表达,但其呈现不同的变化倍数:罗非鱼中p-GSK-3β蛋白的上升倍数显著高于其他两种鱼。低温诱导了PI3K/AKT/GSK-3β信号通路,在不同低温耐受能力的鱼中呈现出不同的表达模式,这些物种特异性的表达模式可能会影响鱼类低温下不同的耐受能力。
低温胁迫;鱼;AKT;GSK-3β;信号通路
在鱼类的生存条件中,水温占有重要位置,温度是限制鱼类地域分布的一个重要因素[1]。 鱼类在它们适宜的温度范围内生存,一旦水温低于其适宜范围的时候,低温胁迫会引起低温压力造成鱼全身的生理应激反应,会扰乱机体正常的生理活动,甚至会导致死亡[2-4]。鱼类是全世界分布最为广泛的脊椎动物之一,不同栖息温度的鱼类,具有不同的低温耐受能力[5]。而不同鱼种之间的低温耐受能力之间存在哪些差异,这将为文章研究鱼类低温适应的分子机制提供方向。
磷脂酰肌醇-3激酶(Phosphoinositide-3-kinase,PI3K)在细胞生长、存活、代谢调控等细胞的生理活动中发挥了重要的作用[6]。PI3K能催化质膜上的磷酸肌醇(PI)而生成二级信使PI-3,4,5-triphosphate (PIP3)。PIP3能招募细胞内信号蛋白(phosphoinositide dependent kinase-1,PDK1)和AKT到膜上,促使PDK1磷酸化AKT蛋白来激活AKT。AKT的活性是受到其上面两个氨基酸位点的磷酸化的控制:第308位的络氨酸(308 Tyr)和第473位的丝氨酸(473 Ser)。AKT能够磷酸化GSK-3β[7]第9位的Ser(9 Ser)而抑制GSK-3β的活性,导致核内cyclin D1蛋白积累,进而抑制细胞凋亡[8]。另一方面,PTEN(phosphatase and tensin homolog deleted on chromosome ten)蛋白可以使PIP3去磷酸化,变成PI(4,5)P2(3),来抑制PI3K/AKT通路[9]。
近年来,随着二代测序技术的发展,在基因组层面解析鱼类低温胁迫下转录组变化,研究者们鉴定出了大量与低温胁迫相关的候选基因和信号通路。尤其是在鳉鱼(Austrofunduluslimnaeus)[10]、斑马鱼[11-12]和南极鱼(Dissostichusmawsoni)[13]的转录组分析中,研究者们发现参与到细胞周期的调控基因,其表达量受到强烈的诱导,这些结果都表明低温压力会严重影响鱼类细胞周期的变化。目前,PI3K/AKT/GSK-3β信号通路主要是通过基因干预方法敲除或小分子药物抑制PI3K、AKT及相关基因,阻断其对下游多种抗凋亡效应分子的活化,促进细胞凋亡[21],但在低温胁迫下对鱼类的细胞存活及细胞周期调控中的作用,目前国内外还尚未有研究报道,结合实验室前期研究,笔者推测PI3K/AKT/GSK-3β信号通路在鱼类低温胁迫中发挥一定的作用。
通过对具有不同低温适应能力的鱼类进行比较来解析在低温适应中发挥重要作用的信号通路已经成为一种有效的手段[13]。随着越来越多鱼类基因组的发布,一些鱼类成为水生生物在遗传学和分子生物学上的研究热点,例如:斑马鱼[14]、罗非鱼[15]和草鱼[16]。斑马鱼作为一种被广泛研究的模式热带鱼,其温度适应范围比罗非鱼大,能在一定时间内忍受9℃的低温[17];罗非鱼是一种具有较高经济价值的重要的养殖热带鱼类,很难在低于10℃的水温下生存[18];草鱼适应能力很强,在0℃~38℃的温度范围内都能生存。在本研究中,我们利用这3种抗寒能力不同的鱼类:斑马鱼、罗非鱼和草鱼。通过实验室统一养殖,对这3种鱼进行相同的低温胁迫(8℃),来监测在相同低温压力下,3种鱼鱼鳃中PI3K/AKT/GSK-3β信号通路中蛋白表达情况,为研究鱼类低温适应相关的分子机制提供理论依据。
1 材料与方法
1.1 鱼种
野生型罗非鱼来自中国山东青岛罗非鱼良种场;野生型斑马鱼来自中科院北京遗传与发育生物学研究所,都在实验室条件下人工饲养和繁殖。野生型草鱼来自上海海洋大学李家乐研究员实验室。斑马鱼和罗非鱼最适应生长温度为28℃,草鱼最适生长温度范围为20℃~30℃之间。为消除初始温度的不同而引起的误差,实验室统一饲喂在28℃至少2个月以上,均取6个月龄的鱼用于实验研究。
1.2 降温策略及采样
降温策略参照文献[12]。大致如下:水温在12 h内从28℃匀速降到18℃,在18℃适应12 h后,在12 h内继续匀速降到8℃。一旦罗非鱼失去平衡(时间点约在36 h),立即收集组织,同时收集斑马鱼和草鱼的鳃组织用于后续分析。并取28℃鱼鳃样品作对照,每个实验点进行3次重复。
1.3 主要试剂和仪器
RIPA Buffer蛋白裂解液、cocktail和PMSF蛋白酶抑制剂来自Sigma公司;30%丙烯酰胺购于Solarbio公司;TEMED为生工公司产品;β-actin单抗与羊抗兔IgG-HRP均购于杭州华安生物技术有限公司;Phospho-AKT Pathway Antibody Sampler Kit购于CST公司;BCA蛋白浓度测定试剂盒和ECL显影液购于Thermo公司;4x SDS-PAGE蛋白上样缓冲液购于Takara公司;常规试剂均为国产分析纯试剂。
主要仪器:凝胶成像系统(Amersham Imager 600)来自GE公司;垂直电泳仪Power PAC HC 来自Bio-Rad公司;离心机和移液器均为Eppendorf公司产品;-86℃冰箱为Thermo 公司产品;-20℃和4℃冰箱为中国海尔公司产品。
1.4 鱼鳃蛋白的提取
由于斑马鱼个体较小,考虑到需要足够的蛋白用于实验研究,笔者混合了3条斑马鱼鱼鳃组织同一个温度下的样本,并置于含蛋白裂解液(PMSF+cocktail)的匀浆器中进行裂解,实验进行3次生物学重复;同时将断头后的罗非鱼和草鱼提取出的鳃组织置于含有液氮的研钵中进行研磨至粉末,置于冰上用蛋白裂解液进行裂解,一个样本来自于一条鱼,实验进行3次生物学重复。最后,将裂解好的样品在4℃ 12 000 r/min离心15~20 min,收集上清用于后续实验。
1.5 Western blot
收集好的蛋白样品先用BCA法测蛋白浓度。根据测得的结果,对其进行调试。然后向调试后的蛋白样品中加入4×Protein loading buffer,沸水煮10~15 min,在12% SDS-PAGE凝胶上分离蛋白质,然后将蛋白转移至PVDF膜上,再用5%脱脂牛奶封闭2 h后,分别用β-actin 与Phospho-AKT Pathway Kit ( 其中一抗为AKT、p-AKT、p-GSK-3β、p-PTEN ) 中的一抗4℃孵育过夜,用羊抗兔IgG-HRP二抗封闭液封闭2 h,用ECL显影曝光拍照,分析蛋白表达变化。
1.6 数据统计分析
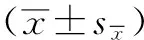
2 结果
2.1 低温胁迫下鱼运动能力的观察
当水温降低到8℃的时候,罗非鱼不能维持身体平衡;斑马鱼能维持身体平衡,但是具有较少的游动;草鱼能继续保持活跃游动。运动能力比较如下:草鱼 > 斑马鱼 > 罗非鱼。
2.2 低温对PI3K/AKT/GSK-3β信号通路的影响
2.2.1 罗非鱼PI3K/AKT/GSK-3β信号通路的影响
在罗非鱼鳃中,低温抑制了p-PTEN蛋白的表达;而诱导了AKT、p-AKT(Ser473)和p-GSK-3β(Ser9)蛋白的表达(图1)。

图1 罗非鱼鳃中p-PTEN、AKT、p-AKT(Ser473)和p-GSK-3β(Ser9)蛋白的表达情况
Fig 1 The expression level of p-PTEN,AKT(Ser473),p-AKT(Ser473) and p-GSK-3β(Ser9) in tilapia gill
a:Western blot检测常温28℃和低温8℃下蛋白表达水平;b:低温处理下蛋白表达情况柱形图。β-actin作为内参;图中所示为均值±标准误,数据来自至少3次独立的生物学重复;*表示显著差异(P< 0.05)
2.2.2 斑马鱼PI3K/AKT/GSK-3β信号通路的影响
在斑马鱼鳃中,低温抑制了AKT和p-AKT(Ser473)蛋白的表达;而诱导了p-GSK-3β(Ser9)蛋白的表达(图2)。值得注意的是,检测磷酸化PTEN的抗体,由于特异性较差,而未能捕获到p-PTEN的表达。
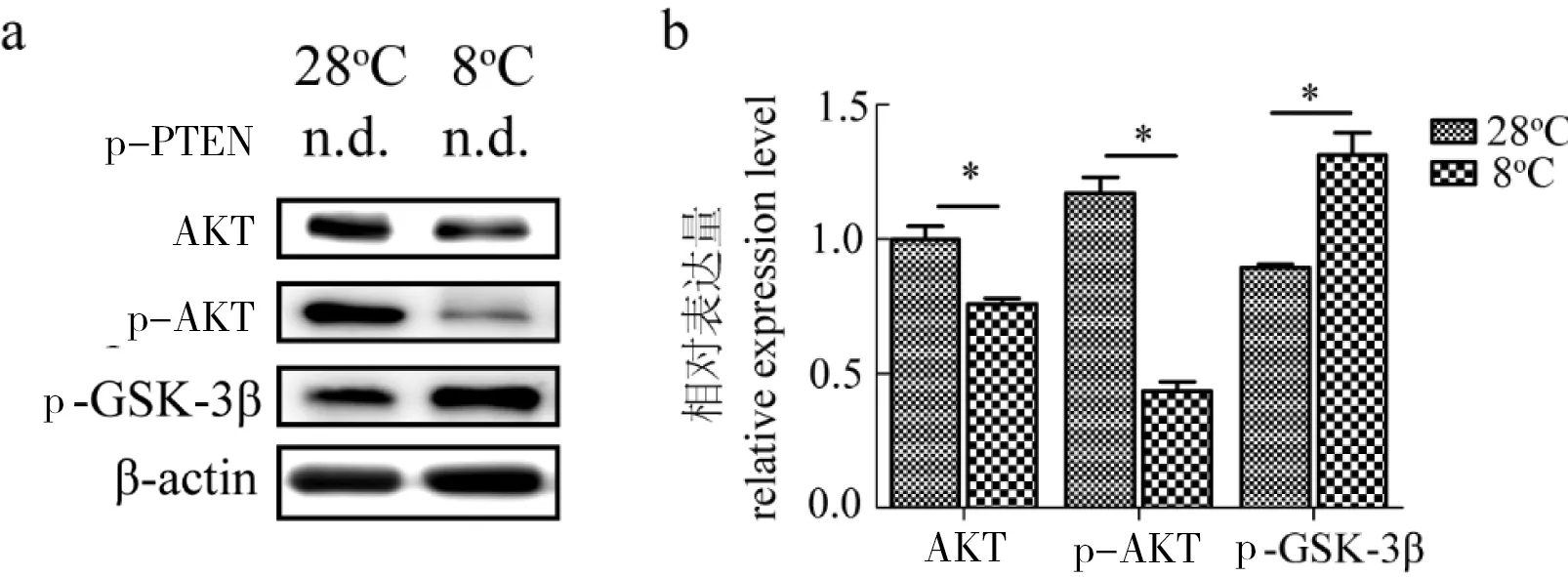
图2 斑马鱼鳃中p-PTEN、AKT、p-AKT(Ser473)和p-GSK-3β(Ser9)蛋白的表达情况
Fig 2 The expression level of p-PTEN,AKT,p-AKT(Ser473) and p-GSK-3β(Ser9) in zebrafish gill
a:Western blot检测常温28℃和低温8℃下蛋白表达水平(n.d.表示未检测到);b:低温处理下蛋白表达情况柱形图。β-actin作为内参;图中所示为均值±标准误,数据来自至少3次独立的生物学重复;*表示显著差异(P< 0.05)
2.2.3 草鱼PI3K/AKT/GSK-3β(Ser9)信号通路的影响
在草鱼鳃中,低温抑制了AKT和p-AKT(Ser473)蛋白的表达;而诱导了p-GSK-3β(Ser9)蛋白的表达(图3)。 PTEN蛋白磷酸化水平在低温下没有显著变化(图3)。
2.2.4 3种鱼之间蛋白表达差异
从图1~3中可以看出,低温在罗非鱼中诱导了AKT和p-AKT(Ser473)的表达;而在斑马鱼和草鱼中则相反。对于p-GSK-3β(Ser9)蛋白,低温一致性诱导了其在3种鱼鳃中的表达,呈现出不同的变化倍数:在罗非鱼中上升10.72 ± 0.80倍;而在斑马鱼和草鱼中分别上升1.47 ± 0.13倍和1.50 ± 0.08倍。低温下罗非鱼p-GSK-3β(Ser9)蛋白的上升倍数显著高于其他两种鱼 (图4)。

图3 草鱼鳃中p-PTEN、AKT、p-AKT(Ser473)和p-GSK-3β(Ser9)蛋白的表达情况
Fig 3 The expression level of p-PTEN,AKT,p-AKT(Ser473) and p-GSK-3β(Ser9) in grass carp gill
a:Western blot检测常温28℃和低温8℃下蛋白表达水平;b:低温处理下蛋白表达情况柱形图。β-actin作为内参;图中所示为均值±标准误,数据来自至少3次独立的生物学重复;*表示显著差异(P< 0.05)

图4 在3种鱼中低温诱导p-GSK-3β(Ser9)蛋白的表达变化
Fig 4 The fold changes of p-GSK-3β(Ser9) at low temperature (8℃) in three fish species
注:图中表达变化为低温和常温下表达量的比值;数据所示为均值±标准误,来自至少3次独立的生物学重复;差异的显著性用不同字母来表示
3 讨论
在之前的研究中,作者通过转录组分析对极地鱼类适应低温的分子机制进行了解析[13],还有通过在斑马鱼中对低温胁迫下的转录组进行分析[12],都发现低温会强烈诱导与细胞周期相关基因的表达变化。PI3K/AKT通路[19]是调控细胞生长和存活的一条经典的重要通路,GSK-3β作为PI3K/AKT通路中下游重要的蛋白,不但能调控糖原的代谢,而且在调控细胞增殖、分化和凋亡中发挥了广泛的作用。目前为止,PI3K/AKT/GSK-3β在鱼类低温胁迫和低温适应中发挥的作用尚未可知。在本研究中,笔者通过对3种低温耐受能力不同的鱼类(低温耐受能力:草鱼 > 斑马鱼 > 罗非鱼)进行低温胁迫,发现低温下AKT和GSK-3β蛋白在3种鱼间呈现出不同的表达模式和表达水平的变化。这说明PI3K/AKT/GSK-3β通路在鱼类低温胁迫和适应中发挥了重要的作用。
在PI3K/AKT通路中,PI3K能够磷酸化磷酯酰肌醇二磷酸(PIP2)生成PIP3,PIP3一旦被激活,能够在空间上拉近PDK1与AKT的距离,从而让PDK1磷酸化AKT第308位的络氨酸来激活AKT[20]。 AKT的磷酸化修饰会随后激活哺乳动物雷帕霉素靶蛋白mTORC1,来增强蛋白合成等;而另外一个哺乳动物雷帕霉素靶蛋白mTORC2能够磷酸化AKT第473位的丝氨酸来进一步完全激活AKT。活化的AKT通过磷酸化作用激活或抑制其下游靶蛋白Bad、Caspase9、GSK-3、FKHR、p21Cip1、p27Kip1等,进而调节细胞存活、增殖、分化和凋亡等[21],但在鱼类中的研究尚未可知。笔者检测了AKT蛋白的总量和p-AKT(Ser473),发现在耐受能力较弱的罗非鱼中(8℃低温导致罗非鱼失去平衡),无论是AKT还是p-AKT(Ser473)被强烈地诱导;而在耐寒能力较强的斑马鱼和草鱼中,AKT和p-AKT(Ser473)呈现出低温抑制的趋势。对于鱼类来说,这可能是由于较弱的低温应激会导致AKT的下调,在一定程度上可能通过上调细胞凋亡清除功能受到损害的细胞,维持组织的正常功能;而强烈的低温应激会反馈调控AKT蛋白的上调,加速细胞增殖和分化以维持细胞存活。
与AKT蛋白作用相反,PTEN是一个肿瘤抑制因子,它能通过把PIP3去磷酸化成PIP2而抑制AKT的磷酸化,从而促进细胞凋亡。笔者在罗非鱼观察到了相应的表达模式:低温诱导了AKT的表达,抑制了PTEN的表达。而在耐寒的草鱼中,虽然磷酸化的AKT表达量降低,但是PTEN的表达水平保持稳定。这暗示在草鱼中AKT可能通过PTEN非依赖的途径来激活。近年来,在哺乳动物乳腺癌研究中也表明有PTEN非依赖的途径来激活AKT[22]。在草鱼中,需要更多的研究证明这一点。
GSK-3β[23]是一个丝氨酸/络氨酸蛋白酶,在调控细胞增殖分化和血糖水平中发挥了重要的作用,它的活性主要受到两个氨基酸位点的控制:第216位的络氨酸Tyr和第9位的丝氨酸Ser。 AKT能够磷酸化GSK-3β第9位的Ser而抑制GSK-3β的活性。同样,低温胁迫下罗非鱼中的AKT与GSK-3β第9位Ser的磷酸化水平都显著升高,但二者之间具体的联系还有待进一步探讨。而在斑马鱼和草鱼中,尽管AKT的表达受到低温抑制,但是GSK-3β第9位Ser的磷酸化水平反而升高,一个可能的原因是在斑马鱼和草鱼中GSK-3β中Ser的磷酸化水平主要是受到AKT第308位的Tyr调控而不是第473位的Ser。在3种鱼中,低温普遍诱导了GSK-3β中Ser的磷酸化水平而抑制了GSK-3β的活性。值得注意的是,尽管低温都诱导了GSK-3β中Ser的磷酸化水平,但是其诱导水平有差异:与斑马鱼和草鱼相比,罗非鱼中GSK-3β磷酸化水平强烈升高。这样会导致大量GSK-3β失活,从而严重影响罗非鱼体内细胞代谢和糖原合成。结合3种鱼中低温下的运动能力,推测GSK-3β中Ser的磷酸化水平可能作为低温应激反应的一个指标来揭示不同鱼类之间低温下的应激反应。
综上所述,低温诱导了PI3K/AKT/GSK-3β信号通路,在不同低温耐受能力的鱼中呈现出不同的表达模式,这些物种特异性的表达模式可能会影响鱼类在低温下细胞凋亡、生存、糖代谢等方面的耐受能力。其中一些表达差异的关键蛋白如AKT和GSK-3β等,能为研究鱼类低温胁迫或者适应的分子机制提供一个很好的切入点,但其确切的分子信号通路有待进一步探讨。
[1]龙 华.温度对鱼类生存的影响[J].中山大学学报(自然科学版),2005,44: 254-257.
[2]DONALDSON M R,COOKE S J,PATTERSOON D A,et al.Cold shock and fish[J].J Fish Biol,2008,73(7): 1491-1530.
[3]WENDELAAR BONGA S E.The stress response in fish[J].Physiological Reviews,1997.77(3): 591-625.
[4]BARTON B A.Stress in fishes: a diversity of responses with particular reference to changes in circulating corticosteroids[J].Integr Comp Biol,2002.42(3): 517-525.
[5]COSSINS A R,CRAWFORD D L.Fish as models for environmental genomics[J].Nat Rev Genet,2005,6(4): 324-333.
[6]GARC A Z,KUMAR A,MARQUéS M,et al.Phosphoinositide 3‐kinase controls early and late events in mammalian cell division[J].The EMBO Journal,2006,25(4): 655-661.
[7]邹 伟,李兆育,李春蕾,等.蛋白激酶B及其在磷脂酰肌醇3-激酶介导的信号转导中的作用[J].生理科学进展,2000,31(2): 120-124.
[8]FRESNO J A,CASADO E,DE CASTRO CARPENO J,et al.PI3K/Akt signaling pathway and cancer[J].Cancer Treatment Reviews,2004,30(2): 193-204.
[9]CARNERO A,BLANCO-APARICIO C,RENNER O,et al.The PTEN/PI3K/AKT signaling pathway in cancer,therapeutic implications[J].Current Cancer Drug Targets,2008,8(3): 187-198.
[10]PODRABSKY J E,SOMERO G N.Changes in gene expression associated with acclimation to constant temperatures and fluctuating daily temperatures in an annual killifishAustrofunduluslimnaeus[J].Journal of Experimental Biology,2004,207(13): 2237-2254.
[11]CHOU M Y,HSIAO C D,CHEN S C,et al.,Effects of hypothermia on gene expression in zebrafish gills: upregulation in differentiation and function of ionocytes as compensatory responses[J].Journal of Experimental Biology,2008,211(19): 3077-3084.
[12]HU P,LIU M,ZHANG D,et al.Global identification of the genetic networks and cis-regulatory elements of the cold response in zebrafish[J].Nucleic Acids Res,2015,43(19): 9198-9213.
[13]CHEN Z,CHENG C H,ZHANG J,et al.Transcriptomic and genomic evolution under constant cold in Antarctic notothenioid fish[J].Proc Natl Acad Sci USA,2008,105(35): 12944-12949.
[14]HOWE K,CLARK M D,TORROJA C F,et al.The zebrafish reference genome sequence and its relationship to the human genome [J].Nature,2013,496(7446): 498-503.
[15]KOCHER T D.Adaptive evolution and explosive speciation: the cichlid fish model[J].Nat Rev Genet,2004,5(4): 288-298.
[16]WANG Y,LU Y,ZHANG Y,et al.The draft genome of the grass carp (Ctenopharyngodonidellus) provides insights into its evolution and vegetarian adaptation[J].Nature Genetics,2015,47(6): 625-631.
[17]ALLANSON B R,BOK A,VAN WYK N I.The influence of exposure to low temperature onTilapiamossambicaPeters (Cichlidae)[J].Fish Biol,1971,3(2):181-185.
[18]CORTEMEGLIA C,BEITINGER T L.Temperature tolerances of wild-type and red transgenic zebra danios[J].T Am Fish Soc,2005,134(6): 1431-1437.
[19]林跃辉,王 敏.PI3K-AKT 信号转导途径与凋亡的关系[J].国际病理科学与临床杂志,2005,25(4): 307-310.
[20]MARTINI M,DE SANTIS M C,BRACCINI L,et al.PI3K/AKT signaling pathway and cancer: an updated review[J].Ann Med,2014,46(6): 372-383.
[21]黄秀兰,崔国辉,周克元.PI3K-Akt 信号通路与肿瘤细胞凋亡关系的研究进展[J].癌症,2008,27(3): 331-336.
[22]SONG M S,SALMENA L,PANDOLFI P P.The functions and regulation of the PTEN tumour suppressor[J].Nature Reviews Molecular Cell Biology,2012,13(5): 283-296.
[23]郭丽萍,王 坚,蒋雨平.磷脂酰肌醇 3-激酶/蛋白激酶 B磷酸化是胰岛素受体后信号转导通路控制 PC12 细胞凋亡的机制[J].中国临床神经科学,2008,15(6): 596-599.
Effect of cold stress on PI3K/AKT/GSK-3β signal pathway in fishes
WANG Jing-feng1,2,HU Peng1,2,NIU Hong-bo1,2,CHEN Liang-biao1,2
(1.College of Aquaculture and Life; 2.Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources,Ministry of Education,Shanghai Ocean University,Shanghai 201306,China)
To investigate the PI3K/AKT/GSK-3β signaling pathway in fish cold regulatory mechanism,three fish species,including tilapia (Oreochromisniloticus),zebrafish (Daniorerio) and grass carp (Ctenopharyngodon-idellus),were exposed to the cold temperature (8℃).They were reared at a common temperature (28℃) but had different cold tolerance (grass carp > zebrafish > tilapia).The expression of protein in the PI3K/AKT/GSK-3β pathway were examined.Results showed that the swimming performance decreased in turn: grass carp,zebrafish and tilapia.In tilapia,the expression of p-PTEN was decreased at cold temperature,whereas the expression of AKT,p-AKT(Ser 473) and p-GSK-3β(Ser 9) was increased at 8℃.Both in zebrafish and in grass carp,the expression of AKT,p-AKT(Ser 473) was repressed at 8℃,whereas the expression of p-GSK-3β(Ser 9) was induced at 8℃.Although the expression of p-GSK-3β(Ser 9) was commonly induced at cold temperature,and the increased abundance varied in the three fish species.The induction of p-GSK-3β(Ser 9) at 8℃ in tilapia was more significantly than that in other two fishes.PI3K/AKT/GSK-3β signaling pathway is involved in cold response and whose regulation vary in the fish species,which may contribute to the various cold tolerance of fishes.
cold stress; fishes; AKT; GSK-3β; signal pathway
2016-01-22;
2016-02-14
收稿日期:国家“973”重点基础研究发展计划(2010CB126304);国家基金委重点项目(31130049);上海市一流学科水产基础生物学(沪教科 2012-62)
王金凤 ,硕士研究生,从事分子生物学研究,E-mail:jinyu1124829@163.com
陈良标,博士,教授,从事发育、分子生物学研究,E-mail: lbchen@shou.edu.cn
10.3969/j.issn.2095-1736.2016.06.024
S917.4;Q75
A
2095-1736(2016)06-0024-05
