病毒性脑膜炎患者脑脊液中乳酸脱氢酶、腺苷脱氨酶及肿瘤坏死因子-α的水平变化及临床意义
2016-12-23徐大兴李艳杰陈琳琳
徐大兴, 李 森, 李艳杰, 陈琳琳. 吴 浩
(南京鼓楼医院集团仪征医院 神经内科, 江苏 仪征, 211900)
病毒性脑膜炎患者脑脊液中乳酸脱氢酶、腺苷脱氨酶及肿瘤坏死因子-α的水平变化及临床意义
徐大兴, 李 森, 李艳杰, 陈琳琳. 吴 浩
(南京鼓楼医院集团仪征医院 神经内科, 江苏 仪征, 211900)
目的 探讨病毒性脑膜炎患者脑脊液中乳酸脱氢酶(LDH)、腺苷脱氨酶(ADA)及肿瘤坏死因子-α(TNF-α)的水平变化。方法 50例病毒性脑膜炎患者设为研究组,50例非脑膜炎患者设为对照组。观察研究者治疗3周时的临床疗效,比较2组治疗前后LDH、ADA、TNF-α的水平。结果 治疗前,研究组LDH、ADA、TNF-α水平显著高于对照组(P<0.05); 治疗后,研究组上述指标较同组治疗前显著降低(P<0.05), 且仍略高于对照组,但差异无统计学意义(P>0.05)。研究者临床治疗总有效率为100%。结论 病毒性脑膜炎患者脑脊液中LDH、ADA、TNF-α水平有所升高,其水平的变化可以指导临床治疗,提示患者预后情况,值得临床应用。
病毒性脑膜炎; 脑脊液; 乳酸脱氢酶; 腺苷脱氨酶; 肿瘤坏死因子-α
中枢神经系统(CNS)感染包括脑膜炎(脑膜或脊膜的炎症)、大脑炎(中枢神经系统受到细菌侵犯出现的脑部临床表现)、脑炎(中枢神经系统病毒感染引起的脑部临床表现)、脓肿以及蠕虫感染,其中脑膜炎是常见的CNS感染[1]。临床上根据病因又可将脑膜炎分为细菌性脑膜炎、病毒性脑膜炎、结核性脑膜炎和隐球菌性脑膜炎[2]。本研究选取本院收治的50例病毒性脑膜炎患者,探讨其相关指标水平的变化,现报告如下。
1 资料与方法
1.1 一般资料
选取本院2013年1月—2014年12月收治的病毒性脑膜炎患者67例作为研究组,其中男35例,女32例,年龄27~82岁,平均(47.3±4.7)岁。纳入标准: ① 临床症状有常见的上感样起病、头痛起病、行为异常起病或癫痫起病; ② 多数患者腰穿脑脊液压力很高(200~330 mmH2O), 细胞数均不高,蛋白阳性,定量在0.5~2.4, HSV抗体检测阴性; ③ 脑电图大多正常,无明显影像学改变; ④ 体征均有病理反射(巴氏征阳性,多为一侧),同时伴有发热、头痛、呕吐及脑膜刺激征等症状[3]; ⑤ 未合并其他神经系统疾病者。另选取本院同期非脑膜炎患者50例作为对照组,其中男30例,女20例,年龄18~68岁,平均(43.3±3.7)岁;呼吸系统感染23例,低颅压头痛9例,周期性麻痹11例,脑梗死7例。
1.2 研究方法
所有患者于入院24 h内由临床医生抽取脑脊液(CSF), 并离心取上清液分多个标本待检,研究组在治疗结束时再次抽取CSF留待检测使用。检测指标包括脑脊液中乳酸脱氢酶(LDH)、腺苷脱氨酶(ADA)和肿瘤坏死因子-α(TNF-α)水平。ADA、LDH采用酶速率法检测, TNF-α检测采用双抗体夹心酶联免疫吸附法(ELISA)。研究组患者治疗采用标准抗病毒方案,给予更昔洛韦10 mg/(kg·d), 静脉滴注2次/d, 连用3~6周;地塞米松10 mg/d连用1周,甘露醇脱水治疗。患者疗程3~6周,期间根据患者病情状况灵活调整临床用药方案。
1.3 疗效评价
治疗3周时,对研究组患者的临床疗效进行评价[4]: 显效:临床症状明显缓解,无发热、头痛、呕吐,脑膜刺激征消失,脑脊液压力正常,脑脊液常规及生化接近正常;有效:临床症状部分缓解,仍有低热头痛,无呕吐,脑膜刺激征减轻,脑脊液常规及生化检查好转,蛋白质及细胞数减少>60%, 脑脊液压力接近正常;无效:临床症状无缓解,反复发热、头痛、呕吐,脑膜刺激征存在,脑脊液常规检查无好转,脑脊液压力下降不明显。以显效+有效计算总有效率。
1.4 统计学方法
2 结 果
入院时,研究组患者LDH、ADA、TNF-α水平显著高于对照组,差异有统计学意义(P<0.05); 治疗3周后,研究组患者上述指标均有显著改善,与同组入院时比较差异有统计学意义(P<0.05), 但仍略高于对照组,差异无统计学意义(P>0.05), 表明研究组患者病情已有改善且趋于稳定。见表1。治疗3周后,对研究组患者进行疗效评价,其中显效28例,有效22例,无效0例,总有效率为100.0%。
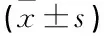
表1 2组治疗前后相关指标结果比较
与对照组比较, *P<0.05; 与同组治疗前比较, #P<0.05。
3 讨 论
病毒性脑膜炎是一组由各种病毒感染引起的软脑膜(软膜和蛛网膜)弥漫性炎症综合征,主要表现为发热、头痛、呕吐和脑膜刺激征,是临床最常见的无菌性脑膜炎。患者脑脊液无色透明,有以淋巴细胞为主的白细胞增多,糖和氯化物正常。患者预后较好,病程2~3周,有自限性[5]。CSF是临床上能够直接反映中枢神经系统病理变化的标本,而对CSF中相关指标水平的检测有助于病毒性脑膜炎的临床诊断,反映患者脑膜炎感染严重程度及治疗效果[6]。本研究收集50例病毒性脑膜炎患者的CSF标本,并检测LDH、ADA、TNF-α等相关指标的水平,根据上述指标的变化进行治疗及调整,获得了较好的疗效。
乳酸脱氢酶(LDH)是一种糖酵解酶,其存在于机体所有组织细胞的胞质内,其中以肾脏含量较高。LDH是能催化丙酮酸生成乳酸的酶,几乎存在于所有组织中。在健康人的脑脊液中, LDH的浓度只有血浆的10%, 而脑脊液中的LDH水平也易受各种因素影响。梁燕等[7]研究发现,影响脑脊液中LDH水平的因素有: ① 脑组织破坏时,酶从神经细胞内溢出; ② 脑脊液中各种细胞解体; ③ 脑脊液清除率降低; ④ 颅内高压时,酶的含量随脑脊液的增多而增加。当患者发生病毒性脑膜炎时,表明患者的中枢神经系统已经感染,而脑组织水肿、坏死使细胞内LDH等生物活性酶进入到脑脊液中,进而表现为脑脊液中LDH含量升高。腺苷脱氨酶(ADA)是嘌呤核苷代谢中重要的酶类,其广泛分布于人体各组织中,以胸腺、脾和其他淋巴组织中含量最高,肝、肺、肾和骨胳肌等处含量较低。1973年Piras[8]研究表明,脑脊液中ADA水平可用于结核性脑膜炎、化脓性脑膜炎及病毒性脑膜炎的鉴别。此后临床上对ADA水平的研究逐渐增多,如Mishra等[9]报道结核性脑膜炎组CSF-ADA活性明显高于细菌性脑膜炎组、脑炎组和对照组。肿瘤坏死因子-α(TNF-α)是一种主要由巨噬细胞和单核细胞产生的促炎细胞因子,并参与正常炎症反应和免疫反应,其能在许多病理状态下产生增多,包括败血症、恶性肿瘤、心脏衰竭和慢性炎性疾病。炎症、内毒素血症、脑膜炎双球菌感染、SLE、HIV感染、肾功能不全及肿瘤时TNF-α均可升高。病毒及结核菌不具备诱导产生TNF-α的强刺激物,其虽然也能对单核巨噬细胞产生刺激,但强度明显弱于细菌,故有较多研究[10]发现,在各类型的脑膜炎患者中,化脓性脑膜炎患者的TNF-α水平最高,其次为结核性脑膜炎和病毒性脑膜炎,究其原因可能与化脓性脑膜炎患者脑脊液中细菌繁殖及分解产生毒素对白细胞造成较大刺激,进而产生大量的炎性因子, TNF-α便是其中之一,而结核菌与病毒的刺激较小, TNF-α水平也就表现得较低。
本研究结果显示,入院时研究组患者LDH、ADA、TNF-α水平显著高于对照组,差异有统计学意义(P<0.05); 治疗3周后,研究组患者上述指标均有显著改善,与同组入院时比较差异有统计学意义(P<0.05), 但仍略高于对照组,差异无统计学意义(P>0.05), 表明研究组患者病情已有改善且趋于稳定。治疗3周后,对研究组患者进行疗效评价,其中显效28例,有效22例,无效0例,总有效率为100.0%。
综上所述,病毒性脑膜炎患者脑脊液中LDH、ADA、TNF-α水平有所升高,其水平的变化可以指导临床治疗,反映患者病情的发展,提示患者的预后情况,并且还有助于不同类型脑膜炎的鉴别诊断,值得临床推广应用。
[1] 邱斌, 李钢, 范小莲, 等. 联合检测血管内皮生长因子、腺苷脱氨酶在结核性脑膜炎和病毒性脑膜炎鉴别诊断中的价值[J]. 武汉大学学报:医学版, 2009, (6): 81-84.
[2] 邱丽华, 王学东, 刘国利, 等. 检测脑脊液诊断结核性和病毒性脑膜炎[J]. 泰山医学院学报, 2003, (3): 238-239.
[3] 张武英, 刘华瑞. 细菌性脑膜炎与病毒性脑膜炎脑脊液TNF-α的检测[J]. 中华传染病杂志, 1998, (3): 174-175.
[4] 王瑞金, 王得新, 王佳伟, 等. 成人病毒性脑膜炎62例临床分析[J]. 中华实验和临床病毒学杂志, 2009, (3): 218-220.
[5] 陈华英, 林伟华, 洪流, 等. 脑脊液乳酸脱氢酶在鉴别细菌性与病毒性脑膜炎的应用[J]. 实用医技杂志, 2014, (7): 747-748.
[6] 陈华英, 林伟华, 洪流, 等. 脑脊液胱抑素C和乳酸脱氢酶在化脓性和病毒性脑膜炎的应用[J]. 实验与检验医学, 2012, (1): 57-58.
[7] 梁燕, 谷晓林, 李梅, 等. 脑膜炎患者脑脊液中肿瘤坏死因子-α、乳酸脱氢酶及其同工酶检测的临床意义[J]. 临床神经病学杂志, 2010, 23(3): 174-176.
[8] Piras M M, Bindstein E, Piras R. Regulation of glycogen metabolism in the adrenal gland and the effect of insulin on glycogen synthetase, phosphorylase, and related metabolites[J]. Arch Biochem Biophys, 1973, 154(1): 263-268.
[9] Mishra A, Gupta D K, Gamangatti S, et al. Post-traumatic blepharocele: A rare manifestation of head injury[J]. Neurol India, 2014, 62(5): 568-572.
[10] 徐兆珍, 郭欣, 李晓光, 等. 脑脊液乳酸脱氢酶测定对鉴别细菌性脑膜炎和病毒性脑膜炎的临床意义[J]. 黑龙江医学, 2002, (7): 124-126.
Changes and significance of lactate dehydrogenase,adenosine deaminase and tumor necrosis factor-α in cerebrospinal fluid of patients with viral meningitis
XU Daxing, LI Sen, LI Yanjie, CHEN Linlin, WU Hao
(DepartmentofNeurology,YizhengHospitalofNanjingDrumTowerHospitalGroup,Yizheng,Jiangsu, 211900)
Objective To explore the changes of lactate dehydrogenase (LDH), adenosine deaminase (ADA) and tumor necrosis factor-α (TNF-α) in cerebrospinal fluid of patients with viral meningitis. Methods 50 patients with viral meningitis were designed as research group, and 50 patients without viral meningitis were designed as control group. Clinical efficacy after 3 weeks of treatment were observed in the research group, and the levels of LDH, ADA and TNF-α before and after treatment were compared between two groups. Results Before treatment, the levels of LDH, ADA and TNF-α in the research group were significantly higher than the control group (P<0.05). After treatment, the levels of indexes above decreased significantly in the research group (P<0.05), and the levels of indexes were higher than the control group at the same time, but there were no significant differences (P>0.05). Total effective rate in the research group was 100%. Conclusion The levels of LDH, ADA and TNF-α increase in cerebrospinal fluid of patients with viral meningitis, and changes of these indexes can provide a guidance for clinical treatment and indicate the prognosis of patients, so it is worthy of clinical application.
viral meningitis; cerebrospinal fluid; lactate dehydrogenase; adenosine deaminase; tumor necrosis factor-α
2016-09-26
R 742
A
1672-2353(2016)24-026-03
10.7619/jcmp.201624007
