跨肺压滴定PEEP在急性主动脉夹层术后低氧血症患者中的临床应用研究
2016-12-23章文豪穆心苇
赵 谊, 章文豪, 穆心苇, 章 淬, 孙 芳, 祁 祥, 邹 磊
(南京医科大学附属南京医院 南京市第一医院, 重症医学科, 江苏 南京, 210006)
论著
跨肺压滴定PEEP在急性主动脉夹层术后低氧血症患者中的临床应用研究
赵 谊, 章文豪, 穆心苇, 章 淬, 孙 芳, 祁 祥, 邹 磊
(南京医科大学附属南京医院 南京市第一医院, 重症医学科, 江苏 南京, 210006)
目的 探讨跨肺压指导呼气末正压通气(PEEP)选择对急性主动脉夹层术后低氧血症患者氧合、血流动力学及预后的影响。方法 采用前瞻性随机对照研究,入选2014年1月—2015年8月急性Stanford A型主动脉夹层术后低氧血症患者28例,随机分为2组:个体化治疗组(n=19), 肺复张后通过食道压监测结果调整PEEP; 传统机械通气治疗组(n=9), 肺复张后按照ARDSnet建议调整PEEP。比较2组患者呼吸、血流动力学参数、机械通气时间、住ICU时间及住院病死率。结果 第72 h, 个体化治疗组的PEEP、吸气末跨肺压均较传统机械通气治疗组高(P<0.05); 第72 h, 个体化治疗组动脉血氧分压(PO2)、氧合指数高于传统机械通气治疗组(P<0.05)。整个实验过程中, 2组患者的心率和心排量无明显差异(P>0.05)。个体化治疗组患者机械通气时间和住ICU时间均比传统机械通气组时间短(P<0.05), 2组患者的住院病死率无统计学差异(P>0.05)。结论 肺复张后应用跨肺压指导PEEP的机械通气策略可改善急性主动脉夹层术后低氧血症患者氧合,缩短机械通气时间、住ICU时间,且不会引起循环波动。
急性主动脉夹层; 低氧血症; 跨肺压; 食道压
急性Stanford A型主动脉夹层(AADA)是一种严重威胁人类生命的心血管疾病,需积极的外科干预[1]。急性呼吸功能障碍、低氧血症是AADA术后常见并发症,可导致患者的围术期死亡率增加[2-3], 其主要由肺泡塌陷、肺容积减少、肺泡表面透明膜形成所致[4], 临床上通常应用肺复张(RM)及呼气末正压通气(PEEP)改善氧合。而真正维持肺泡开放的压力是跨肺压,即气道压减去胸腔内压,PEEP大于胸腔内压才能真正防止已复张肺泡再次塌陷。在主动脉夹层术后患者,多种因素均可导致术后胸廓弹性阻力增加,引起胸腔内压升高,跨肺压降低[5], 如何监测胸腔内压成为研究的关键。食道压与胸腔内压有很好的相关性[6], 本研究拟通过前瞻性随机对照临床研究,观察测定跨肺压指导PEEP选择及RM对主动脉夹层术后低氧血症患者氧合、血流动力学的影响,探讨跨肺压指导此类患者PEEP选择的安全性和有效性,现报告如下。
1 资料与方法
1.1 研究对象
2014年1月—2015年8月本科收治的急性Stanford A型主动脉夹层术后低氧血症患者。入选标准: ① Stanford A型主动脉夹层患者; ② 年龄18~70岁,性别不限; ③ 需要机械通气的主动脉夹层术后早期低氧血症患者(发病时间<72 h, 预计机械通气时间>24 h); ④ p(O2)/FiO2<200 mmHg。排除标准: ① 慢性阻塞性肺病(COPD)、肺纤维化等慢性呼吸疾病; ② 食道梗阻、食道穿孔、严重食道静脉曲张出血,上消化道手术; ③ 胸廓畸形、膈疝、气胸,留置胸引管; ④ 血流动力学不稳定(收缩压<90 mmHg, 血管活性药物难以维持); ⑤ 严重左室功能不全。
1.2 方法
1.2.1 试验器材呼吸机:瑞士Hamilton公司, HAMILTON-G5呼吸机;食道压气囊导管:瑞士Hamilton公司, REF84310; 血气分析仪:美国NOVA公司, NOVA-CCX; 多功能监护仪:美国Philip公司, Philip MP60; 微创血液动力学监护仪:美国Edwards Lifesciences公司, Viligence-Ⅱ。
1.2.2 实验过程一: 患者入ICU后常规进行镇静镇痛、补液、维持水电解质及酸碱平衡、使用血管活性药、抗菌素等,采用同步间歇指令通气+压力支持(SIMV+PSV)辅助呼吸,频率12次/min, 2 L/min流量触发,潮气量6~8 mL/kg, 吸呼比1: 2, 吸入氧浓度(FiO2) 40%~60%, 呼气末正压(PEEP)4~5 cmH2O。机械通气30 min后血气分析检查,达到病例入选标准的患者随机分组,随机化方案采用住院号尾号单双号处理,分为2组:个体化RM治疗组和传统机械通气治疗组,最终分别收录19例和9例。
1.2.3 实验过程二:食道压导管放置及食道压测量: ① 患者斜坡卧位,床头抬高30°, 采用插胃管的方式,将食道压管插入胃内,确定食道压管道测压气囊部分位于食管中下段。病人肌松镇静状态,消除自主呼吸,纯氧通气120 s,使用呼吸机呼气、吸气暂停功能,呼吸暂停10 s, 冻结屏幕波形,测量呼气末2 s、吸气末2 s左右辅助压压力(此时气道气体流速为0 L/min, 且稳定在为0 L/min), 此压力即反映病人胸腔压力的食道压。
1.2.4 实验过程三:传统机械通气治疗组:根据ARDSnet的PEEP/FiO2滴定表进行调节PEEP和FiO2调整,保证SpO2≥90%。个体化肺复张治疗组:根据食道压监测结果调整PEEP, 保证呼气末跨肺压0~10 cmH2O, 吸气末跨肺压≤25 cmH2O, 保证SpO2≥90%。
1.3 观察指标
记录患者一般临床资料,于患者入组时、入组后每12 h各评估一次直至入ICU后72 h, 调整PEEP前应用P-V工具行RM, 调整PEEP后即观察生命体征,第72小时记录气体交换、呼吸力学、血流动力学等指标,并收集预后指标。
1.4 统计学分析
采用SPSS 17.0软件进行统计分析。计数资料以百分比表示,计量资料以(均数±标准差)表示。计数资料组间比较采用卡方检验或Fisher精确检验,计量资料组间比较采用t检验,多个样本间均数比较采用ANOVA方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 一般临床资料
观察期共28例患者入组,其中传统机械通气治疗组(依据ARDSnet法设定PEEP联合RM)9例,个体化RM治疗组(依据食道压滴定法设定PEEP联合RM)19例, 2组患者的基本信息见表1。2组患者基础状况无显著差异(P>0.05), 入ICU时2组病情均较重,平均APACHE Ⅱ评分均在16分左右; 2组平均氧合指数在150 mmHg左右,为中重度ARDS患者。此外2组患者并发ARDS的独立危险因素也无显著差异(P>0.05), 包括体质量指数(BMI)、主动脉阻断时间及体外循环时间等。2组入ICU时动脉血气、血流动力学状况及组织灌注情况(血乳酸的水平)之间也无显著差异(P>0.05)。
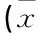
表1 2组患者入ICU时的基本状况±s)[n(%)]
2.2 治疗过程中的呼吸循环参数
2组患者在刚入ICU时呼吸状况及血流动力学情况无明显差异(P>0.05), 随着治疗的进程, 2组均有患者符合拔除气管插管指征而予拔除气管插管,整个过程中,没有患者需要再次插管。见表2。至第72小时, 可见个体化肺复张治疗组较传统机械通气治疗组有更多的患者拔管(P<0.05)。至第72小时, 个体化肺复张治疗组与传统机械通气治疗组分别有9例和6例患者尚未拔管,而个体化肺复张治疗组患者也较传统机械通气治疗组患者的p(O2)和氧合指数状况更佳(P<0.05), 2组患者的血流动力学指标无明显差异(P>0.05)。见表3。
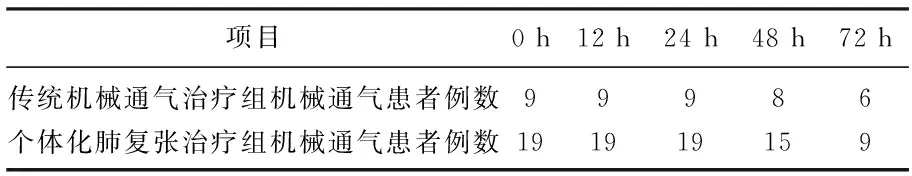
表2 2组各时间点行机械通气患者例数
详细分析整个实验过程,由图1可知,在整个实验过程中,个体化肺复张治疗组PEEP、吸气末跨肺压均较传统机械通气治疗组高,在第72小时的差异有统计学意义(P<0.05), 呼气末跨肺压整体也是个体化肺复张治疗组高, 2组在第72小时差异无统计学意义(P>0.05)。2组患者的氧合指数在第72小时也呈现出显著差异,个体化肺复张治疗组更有优势(P<0.05)。而在整个的实验过程中, 2组患者的血流动力学均基本能够维持稳定,心率和心排量无明显差异(P>0.05)。见图2。
2.3 临床预后
相比较依据ARDSnet设定PEEP联合RM的传统治疗组,食道压滴定PEEP联合RM的个体化RM治疗组患者机械通气时间(76.3±36.1、 92.6±47.1,P=0.038)和住ICU时间(132.0±65.8、 196.9±56.7,P=0.012)更短,且2组住院病死率无显著差异(P>0.05)。2组均未出现RM等相关并发症,如呼吸循环的急剧不稳定、新发的心律失常、气胸等。见表4。
3 讨 论
低氧血症是心外科术后患者的常见并发症,尤其是AADA患者,导致机械通气时间和住ICU时间延长,甚至可能增加病死率。因此所有能快速纠正急性呼吸窘迫综合征(ARDS)的安全有效策略,均可能改善AADA患者的预后。本研究在AADA术后并发ARDS的患者中探究了个体化的RM策略及跨肺压指导PEEP的设定这2项机械通气策略,发现此2项策略能快速改善患者的氧合,且不会引起循环上的波动,提示安全有效。循环的稳定、呼吸状态的快速改善使患者的机械通气时间明显缩短,住ICU时间相应缩短。虽然在病死率方面未见明显改善,这可能与本研究的样本量小有关。小潮气量高PEEP的保护性肺通气策略已为大量的动物实验所验证[7-8]。而对于ARDS患者,如何依据患者的病理生理特点设定合适的PEEP一直缺乏有效方法。理想的PEEP既能维持肺泡张开状态,防止肺泡塌陷,又能避免肺泡的过度扩张,导致气压伤。ARDSnet研究依据患者的氧合状态来调整吸入氧浓度(FiO2)和PEEP[9], 2004年的ALVEOLI试验表明,在6 mL/kg的小潮气量及限制平台压不超过30 cmH2O条件下,高PEEP组和标准PEEP组临床预后无明显差异[10]。2008年LOVS试验[11]表明,在6 mL/kg的小潮气量基础上,整合一系列“打开肺”策略,包括即使将平台压升至40 cmH2O和更高的PEEP, 能显著改善患者的氧合,且对患者全因病死率无影响,可能与患者原发病较重有关。2008年EXPRESS试验表明,与传统PEEP组相比,提升PEEP至平台压维持在28~30 cmH2O, 可明显改善肺功能,减少机械通气时间和器官功能衰竭时间,且不降低病死率[12]。虽然三项研究均得出了阴性结果,但2010年综合了三项研究的荟萃分析[13]显示,高PEEP可提高中重度ARDS患者的生存率。在最新的脓毒症指南中,对于脓毒症诱导的中重度ARDS中亦新增了有关高PEEP的推荐[14]。因此,本研究群体也选择了中重度的ARDS患者,即氧合指数≤200 mmHg。更高的PEEP可能会引起更多的气压伤,但它能更好的防止呼气末肺泡的塌陷,权衡利弊,食道压滴定PEEP的策略仍可能为临床所获益[15-17]。虽然作者在研究过程中未出现因RM导致的血流动力学不稳定、心律失常或者气胸等相关并发症,但如果扩大样本量的话,仍可能会出现,需密切注意[18-20]。
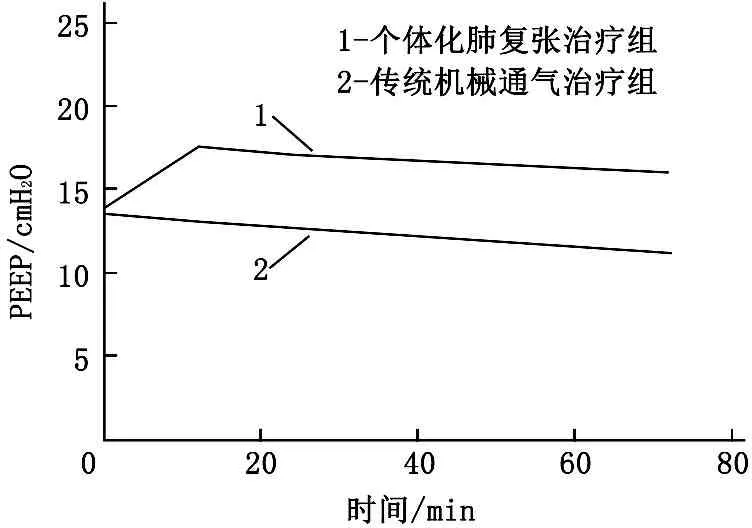
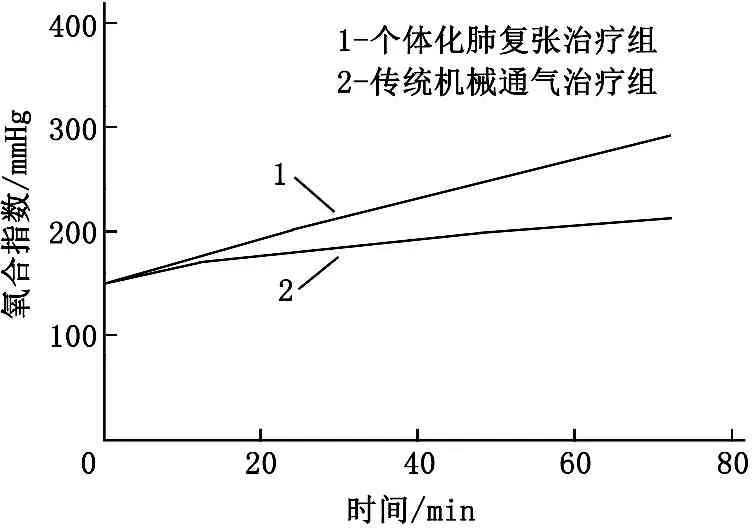
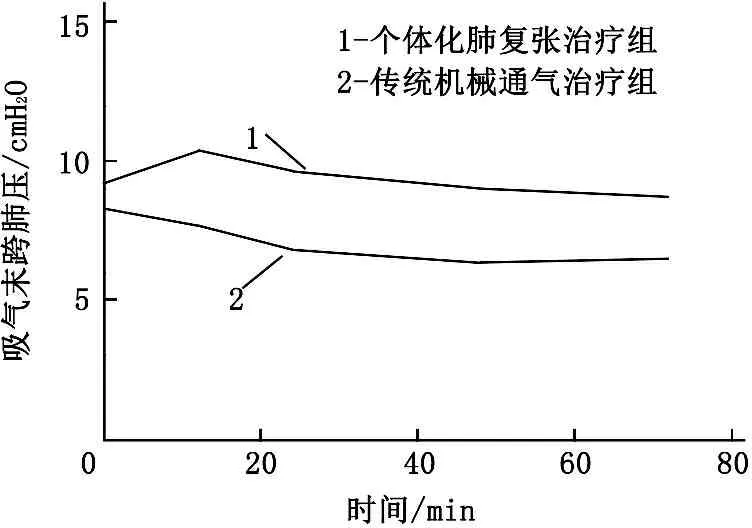

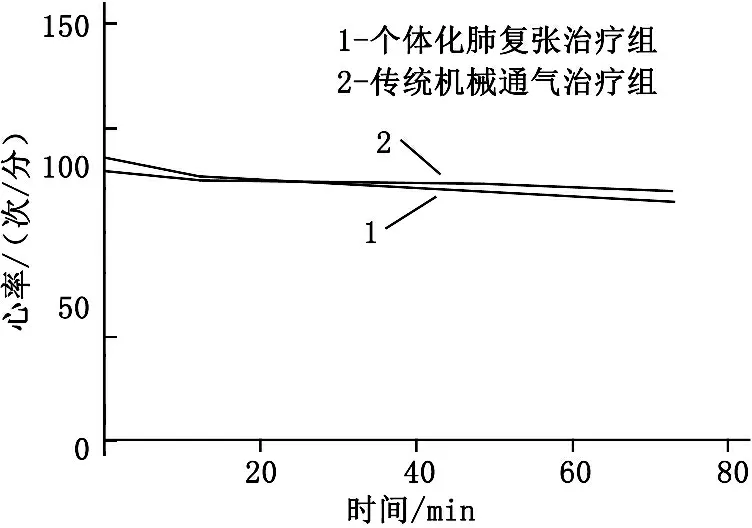
图1 2组在第0、12、24、48、72小时的呼吸参数
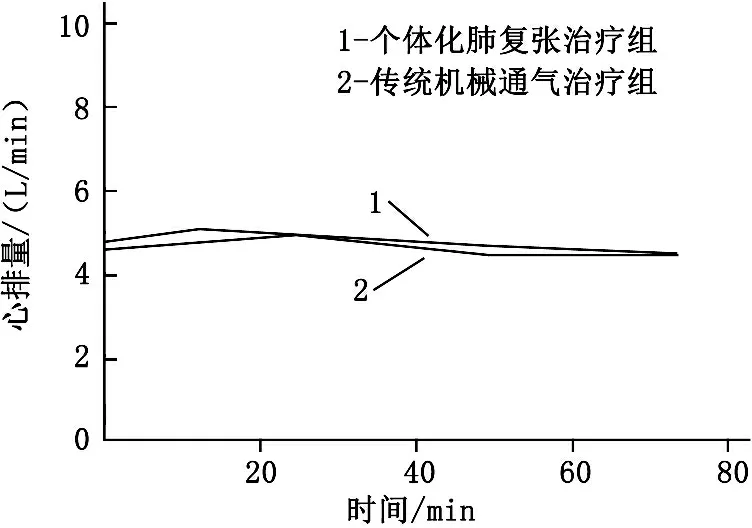
图2 2组第0、12、24、48、72小时的循环参数
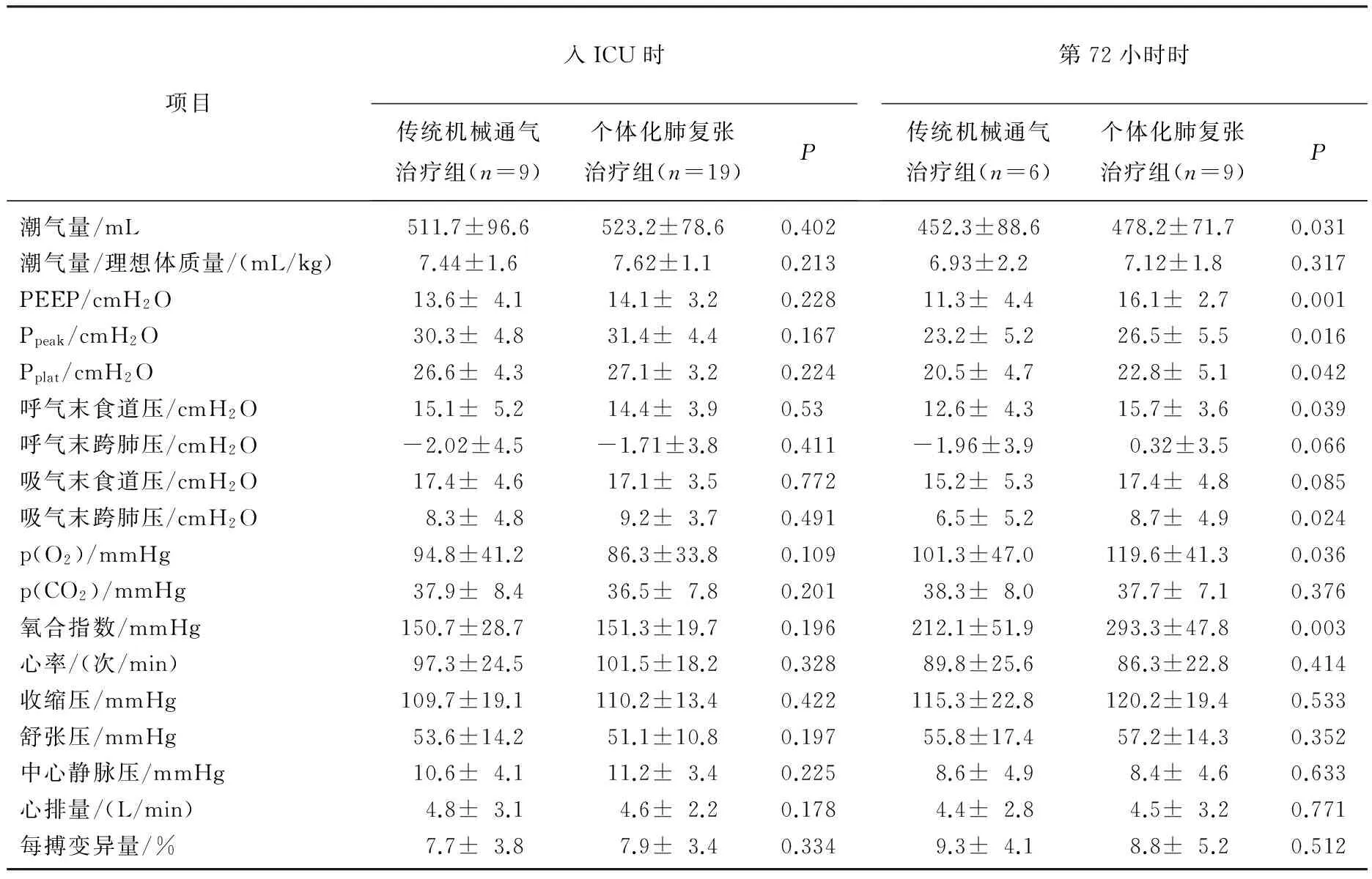
表3 2组入ICU时和第72小时的呼吸循环参数对比

表4 2组预后情况比较
与个体化肺复张治疗组比较, *P<0.05。
本研究结果表明,相比传统的ARDSnet方案联合肺复张,食道压滴定的PEEP联合RM, 即个体化RM方案,可更好的改善氧合,缩短患者的机械通气时间和住ICU时间。AADA术后患者由于全身麻醉、开胸手术、胸腔积液等因素均会导致术后胸廓弹性阻力增加,引起胸腔内压升高,因此需要更高的PEEP来使得呼气末跨肺压为正值以防肺泡塌陷。本研究分析发现个体化治疗组多数患者的PEEP较传统机械通气组高,即食道压滴定的PEEP较ARDSnet方案的PEEP更高,因此相比较于传统机械通气组,个体化RM组的临床获益可能来自于食道压滴定指导下所产生的更高的PEEP。这与其他学者在相关领域的研究结果基本一致[21]。
本研究存在一定的局限性。首先,这是一个单中心、小样本量、单一病种的临床研究,是否能适用于其他疾病,仍需要进一步的大规模多中心的临床研究来验证[22-24]。其次,本研究阳性结果是改善氧合、缩短机械通气时间和住ICU时间,但更高的PEEP亦可能导致气压伤,因此本研究方案是否真正降低病死率,亦需大样本量研究来验证。最后,通过CT扫描来评估局部的肺容量来决定AADA患者术后是否需要行RM, 本研究也未进行[25-27]。
综上所述,基于跨肺压的理念,食道压滴定的PEEP设置联合RM的个体化机械通气策略可能会为AADA术后并发ARDS的患者带来临床获益,但能否提高患者的生存率,仍需进一步的研究。
[1] Charlton-Ouw K M, Azizzadeh A, Sandhu H K, et al. Management of common carotid artery dissection due to extension from acute type A (DeBakey I) aortic dissection[J]. J Vasc Surg, 2013, 58(4): 910-916.
[2] Girdauskas E, Kuntze T, Borger M A, et al. Acute respiratory dysfunction after surgery for acute type A aortic dissection[J]. European Journal of Cardio-Thoracic Surgery, 2010, 37(3): 691-696.
[3] Naughton P A, Park M S, Morasch M D, et al. Emergent repair of acute thoracic aortic catastrophes: a comparative analysis[J]. Arch Surg, 2012, 147(3): 243-249.
[4] Luo F, Zhou X L, Li JJ, et al. Inflammatory response is associated with aortic dissection[J]. Ageing Res Rev, 2009, 8(1): 31-35.
[5] Terragni P P, Filippini C, Slutsky A S, et al. Accuracy of plateau pressure and stress index to identify injurious ventilation in patients with acute respiratory distress syndrome[J]. Anesthesiology, 2013, 119(4): 880-889.
[6] Pecchiari M, Loring S H, D′Angelo E. Esophageal pressure as an estimate of average pleural pressure with lung or chest distortion in rats[J]. Respir Physiol Neurobiol, 2013, 186(2): 229-235.
[7] Chiumello D, Pristine G, Slutsky A S. Mechanical Ventilation Affects Local and Systemic Cytokines in an Animal Model of Acute Respiratory Distress Syndrome[J]. Am J Respir Crit Care Med, 1999, 160(1): 109-116.
[8] Imai Y, Parodo J, Kajikawa O, et al. Injurious mechanical ventilation and end-organ epithelial cell apoptosis and organ dysfunction in an experimental model of acute respiratory distress syndrome[J]. JAMA, 2003, 289(16): 2104-2112.
[9] Fuchs H, Mendler M R, Scharnbeck D, et al. Very Low Tidal Volume Ventilation with Associated Hypercapnia-Effects on Lung Injury in a Model for Acute Respiratory Distress Syndrome[J]. PLoS ONE, 2011(8): e23816.
[10] Brower R G, Lanken P N, MacIntyre N et al. Higher versus lower positive end-expiratory pressures in patients with the acute respiratory distress syndrome[J]. N Engl J Med, 2004, 351(4): 327-336.
[11] Meade M O, Cook D J, Guyatt G H, et al. Ventilation strategy using low tidal volumes, recruitment maneuvers, and high positive end-expiratory pressure for acute lung injury and acute respiratory distress syndrome: a randomized controlled trial[J]. JAMA, 2008, 299(6): 637-645.
[12] Mercat A, Richard J C, Vielle B et al. Positive end-expiratory pressure setting in adults with acute lung injury and acute respiratory distress syndrome: a randomized controlled trial[J]. JAMA, 2008, 299(6): 646-655.
[13] Briel M, Meade M, Mercat A et al. Higher vs lower positive end-expiratory pressure in patients with acute lung injury and acute respiratory distress syndrome: systematic review and meta-analysis[J]. JAMA, 2010, 303(9): 865-873.
[14] Dellinger R P, Levy M M, Rhodes A et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012[J]. Crit Care Med, 2013, 41(2): 580-637.
[15] Plataki M, Hubmayr R D. Should mechanical ventilation be guided by esophageal pressure measurements[J]. Curr Opin Crit Care, 2011, 17(3): 275-280.
[16] 段旭洲, 徐志云. 炎性反应在急性A型主动脉夹层并发肺损伤中的作用[J]. 中华全科医学, 2015, 13(2): 172-174.
[17] 许海雁, 张一明. 1例急性Stanford A型主动脉夹层合并系统性红斑狼疮的护理[J]. 实用临床医药杂志, 2015, 19(20): 182-183.
[18] 倪妮, 王代红, 王沂芹, 等. 主动脉夹层术后急性肾损伤行肾脏替代治疗1例[J]. 第三军医大学学报, 2014, 36(12): 1344-1344.
[19] 梁真科. PEEP对肺叶切除患者单肺通气中氧合及分流的影响[J]. 临床肺科杂志, 2015, 20(2): 256-258.
[20] 孙尊鹏, 葛卫星, 严金霞. 不同呼气末正压对全麻术后患者氧合的影响[J]. 临床肺科杂志, 2013, 18(5): 931-932.
[21] Talmor D, Sarge T, Malhotra A et al. Mechanical ventilation guided by esophageal pressure in acute lung injury[J]. N Engl J Med, 2008, 359(20): 2095-2104.
[22] 陈文智, 赵中, 黄影兰, 等. 肺复张策略抢救急性呼吸窘迫综合征患者的最佳PEEP设置[J]. 实用临床医药杂志, 2013, 17(13): 20-23.
[23] 高新海, 徐仲卿, 张晓明, 等. 主动脉夹层患者临床特征及导致死亡相关危险因素分析[J]. 实用临床医药杂志, 2015, 19(13): 130-131.
[24] 季政, 林素, 周昌钻, 等. Stanford A型主动脉夹层合并肺实变保守治疗中长期存活1例并文献复习[J]. 中华全科医学, 2016, 14(5): 875-878.
[25] Constantin J M, Futier E. Lung imaging in patients with acute respiratory distress syndrome: from an understanding of pathophysiology to bedside monitoring[J]. Minerva Anestesiol, 2013, 79(2): 176-184.
[26] Fish E, Novack V, Banner-Goodspeed V M et al. The Esophageal Pressure-Guided Ventilation 2 (EPVent2) trial protocol: a multicentre, randomised clinical trial of mechanical ventilation guided by transpulmonary pressure[J]. BMJ Open, 2014, 4(9): e006356.
[27] 张朝霞. 主动脉夹层患者的护理干预[J]. 黑龙江医药科学, 2014, 37(1): 117-118.
Clinical application of transpulmonary gradient titration PEEP in patients with hypoxemia after acute aortic dissection surgery
ZHAO Yi, ZHANG Wenhao, MU Xinwei, ZHANG Cui,SUN Fang, QI Xiang, ZOU Lei
(IntensiveCareUnit,NanjingFirstHospitalAffiliatedtoNanjingMedicalUniversity,NanjingFirstHospital,Nanjing,Jiangsu, 210006)
Objective To explore the influence of transpulmonary gradient titration positive end expiratory pressure (PEEP) selection on oxygenation, hemodynamics and prognosis of patients with hypoxemia after acute aortic dissection surgery. Methods A perspective, randomized and controlled study was conducted, in which 28 patients with hypoxemia after acute type Stanford A aortic dissection surgery in our hospital from January 2014 to August 2015 were enrolled and randomly divided into two groups. Individual treatment group (n=19) received regulation of PEEP by esophageal pressure monitoring results after pulmonary re-expansion, while conventional mechanical ventilation treatment group (n=9) was given regulation of PEEP according to ARDSnet advice after pulmonary re-expansion. Respiration, hemodynamic parameters, mechanical ventilation duration, intensive care unit (ICU) stays and hospital mortality rate were compared between two groups. Results At 72 h after treatment, individual treatment group was markedly higher than conventional mechanical ventilation treatment group in PEEP and end-inspiratory transpulmonary gradient (P<0.05), and was notably higher in arterial partial pressure of oxygen (PO2) and oxygenation indexes (P<0.05). During the whole experiment, there was no significant difference between two groups in heart rate and cardiac output (P>0.05). Meanwhile, individual treatment group was evidently shorter than control group in mechanical ventilation duration and ICU stay (P<0.05). However, there was no significant difference between two groups in hospital mortality rate (P>0.05). Conclusion Application of mechanical ventilation using transpulmonary gradient-guided PEEP after pulmonary re-expansion can effectively improve the oxygenation and shorten the mechanical ventilation and ICU stay without triggering circular fluctuation in patients with hypoxemia after acute aortic dissection surgery.
acute aortic dissection; hypoxemia; transpulmonary gradient; esophageal pressure
2015-11-25
江苏省南京市医学重点科技发展项目(ZKX14036)
穆心苇, E-mail: 18951670877@163.com
R 543.1
A
1672-2353(2016)24-001-06
10.7619/jcmp.201624001
