不育男性精子DCXR mRNA表达与顶体酶阳性反应率的关系
2016-12-22马晓萍高晓勤丁贤胜周桦
马晓萍 高晓勤 丁贤胜 周桦
(1.贵州医科大学组织胚胎学教研室,贵州 贵阳,550004;2.遵义医药高等专科学校组织胚胎学教研室,贵州 遵义 563006;3.六盘水市人民医院病理科,贵州 六盘水 553000;4.贵州医科大学附属医院生殖医学中心,贵州 贵阳,550004)
不育男性精子DCXR mRNA表达与顶体酶阳性反应率的关系
马晓萍1,2高晓勤2△丁贤胜3周桦4
(1.贵州医科大学组织胚胎学教研室,贵州 贵阳,550004;2.遵义医药高等专科学校组织胚胎学教研室,贵州 遵义 563006;3.六盘水市人民医院病理科,贵州 六盘水 553000;4.贵州医科大学附属医院生殖医学中心,贵州 贵阳,550004)
目的 探讨原因不明男性不育患者精子DCXR mRNA的表达与顶体酶阳性反应率和受精力的关系。方法 收集88例精液标本,其中正常生育组20例,不育男性68例。参照世界卫生组织(WHO)标准方法对标本进行精液常规分析,68例不育标本分为不育A组和不育B组。采用实时荧光定量PCR 法,检测DCXR 基因mRNA 的相对表达量;以固定底物膜法观察顶体酶阳性反应率;以人精子穿透去透明带金黄地鼠卵异种体外受精试验(SPA)检测精子受精力。结果 实时荧光定量PCR检测结果显示:正常生育组的精子DCXR 基因mRNA 的相对表达量明显高于不育A、B两组,经统计学分析均有显著性差异(P<0.05);不育A、B两组的精子顶体酶阳性反应率和受精率与正常生育组比较均有显著性下降(P<0.05)。相关性分析提示精子DCXR 基因mRNA 的相对表达量与顶体酶阳性反应率存在正相关性(r=0.440,P<0.01),精子DCXR 基因mRNA 的相对表达量与受精率存在正相关性(r=0.422,P<0.01)。结论 原因不明男性不育患者精子DCXR mRNA 的表达减少,精子DCXR mRNA 的表达与顶体酶阳性反应率和受精率有一定相关性。
男性不育; DCXR; 顶体酶阳性反应率
男性不育可由多种疾病或多种原因引起,如内分泌功能失调、睾丸生精功能障碍、精子结构与功能异常等等。精液常规分析是目前判断男性不育的常用指标,但精液分析结果不能准确反映精子受精能力。因此,结合多种指标分析,才能提高临床的诊断水平,准确评估男性生育潜能[1]。随着研究的不断深入,受精过程中参与精子获能和精卵识别的精子蛋白与男性不育的关系越来越引起广泛关注[2]。由于精子必须经过附睾管道内的成熟过程才能获得受精能力,附睾内精子达到功能上成熟的过程主要依赖于雄激素调控下的附睾蛋白的合成和分泌[3-4]。有文献报道,人肾脏的双羰基/L-木酮糖还原酶(dicarbonyl/L-xylulose reductase,DCXR)与附睾精子蛋白P34H可能是同一个蛋白[5]。 P34H是在研究人精子透明带相互作用时发现的精子表面蛋白,主要分布在附睾体部的近端和远端。初步研究表明,P34H能够介导精子和透明带的结合,并可作为精子附睾成熟的标志物,而且低水平的附睾精子蛋白P34H与原发性男性不育相关[6]。通过对附睾精子蛋白P34H基因克隆及表达的初步研究,首次从cDNA 水平上证明,附睾精子蛋白P34H 与肾脏中的双羰基/ L-木酮糖还原酶( DCXR)是同一个蛋白;同时发现P34H 序列与人肾脏的双羰基还原酶cDNA序列完全一致[7]。我们采用实时荧光定量PCR检测正常生育组和不育组人精子中DCXR mRNA的表达水平,改良明胶底物膜法[8]评价顶体酶阳性反应率,用人精子穿透去透明带金黄地鼠卵异种体外受精试验(SPA)测定其受精力。通过比较正常者与不育患者精子的DCXR mRNA表达水平,并分析DCXR mRNA表达量与顶体酶阳性反应率、受精率的相关性,从而进一步探明DCXR mRNA表达对精子功能的影响,明确其在男性生殖过程中的功能提供理论和实验依据,为临床诊断和治疗男性不育拓宽思路。
1 材料和方法
1.1 材料
1.1.1 实验动物 金黄地鼠购自上海斯莱克实验动物有限公司
1.1.2 主要试剂 Percol1分离液购自美国Pharmacia公司;人输卵管液HTF购自美国InVitroCare公司; 精子细胞BWW培养液购自美国Toscience公司;TRIzol RNA提取试剂购自美国Invitrogen公司; RNA 抽提液购自美国Gibco 公司; cDNA 逆转录试剂盒和SYBR Green 荧光定量PCR 试剂盒,购自日本TaKaRa公司; 孕马血清促性腺激素(PMSG)、绒毛膜促性腺激素(HCG)为上海生化制药厂产品;透明质酸酶、胰酶为Sigma 公司产品。
1.2 方法
1.2.1 标本来源 选择贵州医科大学第一附属医院生殖检验中心就诊者。生育组:20例身体健康,有生育史的正常成年男性,年龄22~40岁,其精液常规各项指标符合WHO 规定的正常精液常规标准,精浆及血清抗精子抗体阴性;不育A组:28例婚后2年以上未育,已排除女方不孕因素,且精液常规各项指标在正常范围的不明原因原发不育症患者。不育B组:40例婚后2 年以上未育,已排除女方不孕因素,精液常规检查结果中有一项以上异常的不育患者。
1.2.2 精子标本制备 所有供精者均禁欲5~7 d,手淫方式取全部精液于无菌塑料杯中,置37 ℃恒温水浴箱孵育约30 min,完全液化后用40:80梯度的Percoll液进行密度梯度离心分离成熟精子。收集80%层精子,用HTF洗涤两次并在显微镜下确认纯化效果并计数精子密度,取自同一份精液标本的精子,一部分用于总RNA 提取;另一部分用于顶体反应阳性率和SPA的测定。
1.2.3 实时荧光定量PCR法 纯化后的精子室温500r/min离心5 min,弃上清,精子沉淀用于RNA提取。用TRIzol提取RNA,按TRIzol试剂说明书进行,用适量的DEPC 水溶解RNA 沉淀,-80 ℃保存。测定RNA的浓度和纯度,逆转录为cDNA,在实时定量PCR 中作为模板,以qPCR检测各组DCXR mRNA的表达量。DCXR引物序列为正向: 5’-TCGTGAATGTCTCCAGCAGTG-3’,反向: 5’-GGATTCGGTTCAGCATAGTCTTG-3’,产物174 bp;管家基因β肌动蛋白引物序列为正向: 5’-AGCGAGCATCCCCCAAAGTT-3’,反向: 5’-GGGCACGAAGGCTCATCATT-3’,产物285 bp;引物由上海生工生物有限公司合成。反应条件:95 ℃ 10 min(预变性)后进入循环(40个):95 ℃ 变性30 s; 60 ℃ 30 s 。整个反应过程中荧光信号的变化由qPCR仪监测。反应结束后,电脑自动分析并显示计算结果,2-△△CT为DCXR的相对表达量。
1.2.4 固定底物膜法评价顶体反应阳性率 Percol1分选的人精子以磷酸盐缓冲液(PBS)洗涤2次,调整精子浓度为4×107/mL,将上述精子悬浮液取50、l涂于改良明胶底物膜片[9]上,置于37 ℃恒温恒湿箱孵育,3 h后取出,室温下干燥,终止孵育后,每份孵育片于Leica DME光学显微镜下均匀选取5~6个视野,随机观察200个精子头部,出现周围晕环者视为顶体酶阳性反应。计算顶体酶阳性反应率。
1.2.5 人精子穿透去透明带金黄地鼠卵异种体外受精试验(SPA) 8~12周龄雌性金黄地鼠,用PMSG和hCG超数排卵,无菌条件下取出输卵管并挑出卵块,卵周围颗粒细胞及透明带分别用0.1%的透明质酸酶和0.1%胰酶消除,用上游法制备精子悬液,并在倒置显微镜下将分离得到的精子用HTF液调至2×106个/mL,37 ℃,5% CO2条件下孵育2 h 以获能。再将卵子转入获能精子悬液中,在5%CO2,37 ℃条件下孵育1 h受精。相差显微镜下观察卵细胞浆,以卵内有膨大的精子头及其尾部存在作为被精子穿透的指标,根据总卵数及受精卵数,计算受精率。
2 结 果
2.1 正常生育组与不育组精子的DCXR mRNA表达水平 实时荧光定量PCR熔解曲线显示,熔解曲线均为单峰,无引物二聚体或其他杂峰出现,表明扩增特异性良好。正常生育组和不育A、B两组的相对表达量分别为[(0.53±0.16)、(0.36±0.12)、(0.34±0.12)],不育A、B两组和正常生育组相比,DCXR 基因mRNA 的相对表达量差异具有统计学意义(P<0.05);不育A、B两组相比,DCXR 基因mRNA 的相对表达量差异无统计学意义(P>0.05)。
2.2 正常生育组与不育组的精子顶体酶阳性反应率和受精率 正常生育组和不育各组的精子顶体反应阳性率分别为[(72.79±8.66)、(49.99±10.56)、(38.24±8.34)],正常组和不育各组的受精率分别为[(43.09±6.23)、(30.29±6.09)、(19.64±6.10)],不育A、B两组的精子顶体酶阳性反应率和受精率与正常生育组比较均有显著性下降(P<0.05)。正常生育组和不育A、B组的顶体反应发生率见图1。
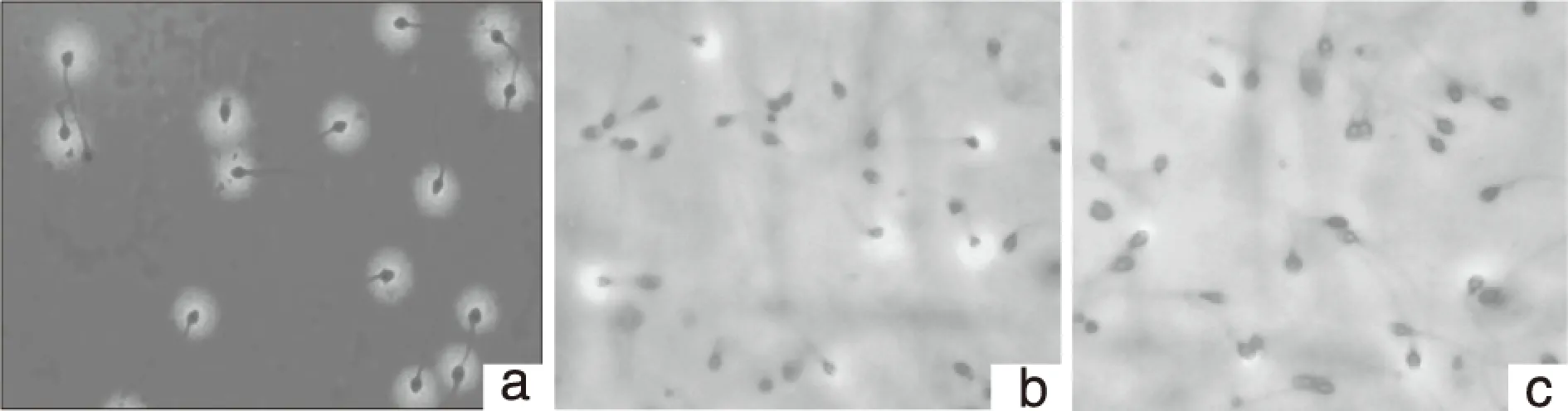
注:A.正常生育组(20例): 顶体反应发生率可达72.79%;B.不育A组(n=28): 顶体反应发生率为49.99%;C.不育B组(40例): 顶体反应发生率为38.24%。图1 正常生育组和不育A、B组的顶体反应发生率(光镜×400)
2.3 精子DCXR mRNA表达水平与顶体酶阳性反应率、受精率的相关性 相关性分析提示精子DCXR基因mRNA 的相对表达量与顶体酶阳性反应率存在正相关性(r=0.440,P<0.01);相关性分析提示精子DCXR 基因mRNA的相对表达量与受精率存在正相关性(r=0.422,P<0.01)。
3 讨 论
DCXR是一个属于短链脱氢酶/还原酶(SDR)家族[5]的四聚体,DCXR具有二乙酰还原酶,L-木酮糖还原酶活性,主要在二羰基复合物和葡萄糖代谢中发挥作用[9]。 DCXR分布在哺乳动物的多种组织中,在肝脏、肾脏和附睾中均有表达。提示DCXR是一个“兼职蛋白”,参与众多重要生命活动[10]。
目前尚未见文献报道人精子中是否有DCXR mRNA的表达。有研究[11]报道,人类成熟精子mRNA的表达与精子发生、质量及不育有关,成熟精子中的mRNA是精子发生过程中的残留物,定量检测可以间接反映精子发生过程中的基因表达情况。本研究通过荧光实时定量PCR证实DCXR mRNA在正常生育组和不育各组的精子中均有不同程度的表达,但表达量有所差别。其中正常生育组中精子DCXR mRNA表达显著高于不育各组,但在不育A、B两组的表达差异不显著。本结果提示DCXR在精子成熟中起一定的作用,DCXR mRNA表达水平不足,可能伴有精子成熟障碍和精子功能异常,从而使DCXR合成受阻和表达障碍,引起不育。
顶体反应发生率以及穿过透明带并与卵膜融合的能力是评价精子受精能力的重要功能指标。正常情况下,顶体反应是受精的前提,它可使精子顶体内所含的顶体酶释放出来,支持精子穿过卵透明带,从而促使精卵融合而受精,顶体反应发生障碍可引起不育[12]。本研究采用改良明胶底物膜法检测顶体酶阳性反应率,顶体酶阳性反应率的高低在一定程度上可反映精子顶体反应的发生率,不出现顶体酶阳性反应的精子,是不能测出顶体酶活性强度的。因此,我们检测了正常生育者和不育者精液标本中精子DCXR mRNA表达水平、顶体反应阳性率和受精能力,并且对DCXR mRNA表达水平、顶体反应阳性率和受精率分别做相关性分析。从实验结果可以看出,精子中DCXR mRNA含量与顶体反应阳性率、受精率都有一定相关性,说明DCXR mRNA与精子功能有关。
综上所述,精子中DCXR mRNA含量不仅反映了精子成熟过程的正常与否,还与精子顶体酶阳性反应率和受精能力有一定关系。我们在研究过程中发现部分不育男性的精子DCXR mRNA水平接近于正常人,但其在某些原因不明的不育患者精子中的异常表达,说明附睾功能紊乱可能是造成其不育的原因之一。但DCXR mRNA在参与受精过程中与其他相关功能的关系还需进一步研究,从而为临床诊断和治疗男性不育提供详尽的理论和实验依据。
[1] 刘继龙,陈枚燕,林春莲,等.不育患者精液质量与精子DNA碎片及血液微量元素关系的研究[J].贵州医药,2013,37(5):400-402.
[2] Bromfield EG,Brett N.The function of chaperone proteins in the assemblage of protein complexes involved in gamete adhesion and fusion processes[J].Reproduction,2013,145(2):31-42.
[3] 韩丽媛.附睾特异蛋白与精子功能的研究进展[J].国际生殖健康/计划生育杂志,2011,30(1):54-57.
[4] Timo B,Strehler EE,Filoteo AG,et al.Switch of PMCA4 splice variants in bovine epididymis results in altered isoform expression during functional sperm maturation.[J].Journal of Biological Chemistry,2010,286(10):7938-7946.
[5] Junichi N,Syuhei I,Jun A,et al.Molecular Characterization of Mammalian Dicarbonyl/L-Xylulose Reductase and Its Localization in Kidney[J].Journal of Biological Chemistry,2002,277(20):17883-17891.
[6] Moskovtsev SI,Jarvi K,Légaré C,et al.Epididymal P34H protein deficiency in men evaluated for infertility[J].Fertility & Sterility,2007,88(5):1455-1457.
[7] 夏欣一,许晓风,高云,等.人精子表面蛋白P34H的基因克隆及其在睾丸和附睾中表达分析[J].中华男科学,2003,9(1):24-27.
[8] 马晓萍,高晓勤,杨燕平,等.人精子顶体内顶体蛋白酶和透明质酸酶对男性生育力的影响[J].检验医学,2014,29(3):258-261.
[9] Takase R,Mikami B,Kawai S,et al.Structure-based conversion of the coenzyme requirement of a short-chain dehydrogenase/reductase involved in bacterial alginate metabolism.[J].Journal of Biological Chemistry,2014,289(48):33198-33214.
[10] Ayodélé A,Christine L,Robert S.Dicarbonyl L-Xylulose Reductase (DCXR),a “Moonlighting Protein” in the Bovine Epididymis[J].Plos One,2015,10(3): e0120869.
[11] Miller D,Ostermeier GC.Towards a better understanding of RNA carriage by ejaculate spermatozoa.[J].Human Reproduction Update,2006,12(12):757-767.
[12] Sakamoto M.Acrosome-reacted sperm in infertile and fertile men using the triple-stain technique[J].Archives of Andrology,2009,30(1):41-45.
The correlation between the level of DCXR mRNA expression and the positive rate of acrosin reaction in infertile males
MaXiaoping1,2,GaoXiaoqin2,DingXiansheng3,ZhouHua4.
1.DepartmentofHistologyandEmbryology,GuizhouMedicalUniversity,Guiyang550004,China. 2.DepartmentofHistologyandEmbryology,ZunyiMedicalandPharmaceuticalCollege,Zunyi563006,China. 3.DepartmentofPathology,thefirstPeople'sHospitalofLiupanshui,Liupanshui553000,China. 4.ReproductiveMedicineCenter,AffiliatedHospitalofGuizhouMedicalUniversity,Guiyang550004,China.
Objective To investigate the correlation between the level of DCXR mRNA expression and the fertilizing ability in unexplained infertility. Methods 88 semen samples were collected. 68 cases were in infertile group, and 20 in normal control group. Semen routine analysis was referred to WHO standard method. Real-time PCR was used to detect the level of DCXR mRNA expression on spermatozoa. Using a sperm penetration of zona-free hamster egg assay (SPA) to detect the fertilizing capability and the positive rate of acrosin reaction in each sample were examined by improved fixed-substrate film method. Results There were statistical significantly differences in the level of DCXR mRNA expression, the positive rate of acrosin reaction and the penetration rate of SPA between each infertile group and the control(P<0.05). The level of DCXR mRNA expression, the positive rate of acrosin reaction and the penetration rate of SPA in the each infertile group were significantly lower than that in control group. The relation between the DCXR mRNA expression and the positive rate of acrosin reaction had a significant positive correlation (r=0.440,P<0.01); the relation between the DCXR mRNA expression and the penetration rate of SPA had a significant positive correlation (r=0.422,P<0.01). Conclusion The level of DCXR mRNA expression is reduced in unexplained infertility, while the positive rate of acrosin reaction and the penetration rate of SPA are correlated with the level of DCXR mRNA expression.
Male infertility; DCXR; The positive rate of acrosin reaction
贵州省科技计划项目[黔科合LH字(2015)7567号];贵州省科技创新人才团队项目[黔科合人才团队(2014)4005号]
R321.1
A
1000-744X(2016)11-1129-03
2016-06-08)
△通信作者,E-mail:gxq550301@163.com
