小分子双链RNAs联合应用抑制膀胱癌细胞增殖的实验研究
2016-12-22张庆松李传昌陈忠李凡袁慧星杨为民
张庆松 李传昌 陈忠 李凡 袁慧星 杨为民
·实验研究·
小分子双链RNAs联合应用抑制膀胱癌细胞增殖的实验研究
张庆松 李传昌 陈忠 李凡 袁慧星 杨为民
目的 在膀胱癌细胞系T24和EJ细胞中转染两种不同的人工合成小分子双链RNA(dsRNA),观察联合应用与分别单独应用两种dsRNA对膀胱癌细胞生长的影响。 方法 根据对膀胱癌细胞的处理不同分为:①阴性对照组(dsControl)、dsP21-322组、dsP21-555组和dsP21-322+ dsP21-555组;②dsControl组、dsP21-322组、dsP53-285组和dsP21-322+dsP53-285组。采用实时荧光定量聚合酶链反应(qPCR)检测各组细胞p21 mRNA及细胞周期依赖性激酶CDK4、CDK6 mRNA的表达;蛋白印迹法(Western blot)检测P21蛋白和CDK4、CDK6蛋白的表达;细胞增殖实验检测转染后细胞增殖能力;集落形成实验检测单个细胞克隆增殖能力。 结果 qPCR结果显示,与dsControl组相比,dsP21-322组、dsP2l-555组和dsP53-285组均分别上调T24和EJ细胞中p21 mRNA的表达(P<0.01);而与单独转染dsP21-322、dsP2l-555相比,同时转染dsP21-322+dsP21-555,差异无统计学意义(P>0.05)。与dsControl组相比,dsP53-285能够上调p53基因的表达(P<0.05);与单独转染dsP53-285相比,p53 mRNA表达在同时转染dsP21-322和dsP53-285组中差异无统计学意义(P>0.05)。与单独转染dsP21-322、dsP53-285相比,dsP21-322+dsP53-285能够显著增加p21 mRNA的表达(P<0.05)。与dsControl相比,转染dsP21-322、dsP53-285分别使T24和EJ细胞中CDK4、CDK6 mRNA的表达下调(P<0.05);与单独转染dsP21-322、dsP53-285相比,CDK4/6 mRNA的表达在dsP21-322+dsP53-285组中明显被抑制(P<0.05)。Western blot检测结果验证了组间p21和CDK4/6基因表达的差异。细胞增殖实验结果显示,同时转染dsP21-322和dsP53-285比单独转染抑制膀胱癌细胞增殖能力更明显。细胞集落形成实验中,dsP21-322+dsP53-285组中形成的集落数量显著少于单独转染组。 结论 同时转染dsP21-322和dsP53-285能够显著抑制膀胱癌细胞的增殖。
膀胱肿瘤; dsRNAs; P21; RNA激活
前期研究发现微小非编码双链RNA(dsRNA)分子dsP21-322、dsP53-285能分别与膀胱肿瘤细胞中的抑癌基因p21和p53基因的启动子靶部位结合,从而激活p21和/或p21上游基因p53的表达[1-2]。Place等[3]研究发现dsRNA分子dsEcad-640和微小RNA(miRNA)分子miR-373分别与E-cadherin启动子的靶序列完全及不完全互补配对,在前列腺癌细胞中都能明显激活E-cadherin基因的表达,而将二者同时转入细胞后并没有使得E-cadherin的表达比单独转染时增高。为了研究两个不同作用点的dsRNA同时转入细胞后是否能够使得目的基因p21的表达更高并且显著抑制膀胱癌细胞的生长,本研究通过实时荧光定量聚合酶链反应(qPCR)初步检测转染处理的膀胱癌细胞中p21 mRNA表达变化,利用之前筛选出的可激活P21蛋白表达的dsP21-555进一步确定dsP21-555与dsP21-322及dsP21-322与dsP53-285同时转入后是否能明显激活p21基因的表达并观察其对膀胱癌细胞生长作用的影响。
材料与方法
一、材料
dsP21-322、dsP21-555、dsP53-285模拟物和随机序列(dsControl)(广州市锐博生物科技有限公司);人膀胱癌细胞系T24和EJ细胞(中国武汉典型培养物保藏中心);胎牛血清(美国GIBCO公司);RPMI 1640培养液(美国Hyclone公司);Opti-MEM©无血清培养液、Lipofeetamine©RNAiMAX转染试剂(美国 Invitrogen公司);PCR引物合成(上海Invitrogen公司);SYBR©Premix Ex TaqⅡ试剂盒、PrimeScriptTMRT-PCR逆转录试剂盒(宝生生物工程大连有限公司);BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司);一抗鼠抗P21(美国CST公司);一抗兔抗细胞周期依赖性激酶(CDK)4、CDK6(美国Affinity公司);一抗鼠抗β-actin、辣根过氧化物酶标记的二抗羊抗小鼠IgG、辣根过氧化物酶标记的二抗羊抗兔IgG(武汉博士德公司);超敏ECL发光试剂盒(美国Thermo公司);CellTiter 96©AQueous One Solution Cell Proliferation Assay试剂盒(美国Promega公司)。
二、方法
1.细胞培养和转染:人膀胱癌细胞系T24、EJ细胞在37 ℃、5% CO2培养箱中使用含有10%胎牛血清的RPMI 1640培养液培养。在细胞进入对数生长期后用胰酶消化细胞重新接种于6孔细胞培养板中,每孔约接种10×104~20×104个细胞,12 h后使用转染试剂Lipofectamine©RNAiMAX对细胞进行转染处理,并保证dsRNA的终浓度为50 nmol/L。24 h后观察细胞形态并更换培养液。根据对细胞的不同处理分为:①阴性对照组(dsControl)、dsP21-322组、dsP21-555组和dsP21-322+dsP21-555组;②dsControl组、dsP21-322组、dsP53-285组和dsP21-322+dsP53-285组(第一组的dsP21-322和dsP21-555都是作用于p21启动子的dsRNA,首先确定作用于同一个基因的两个dsRNA同时转染后激活作用是否能够叠加;第二组是一个作用于p21基因的dsRNA,一个作用于p53启动子的dsRNA,p53是p21的上游基因,同时转染后检查p21的表达是否会更高及细胞增殖的变化)。
2.总RNA的提取和qPCR检测:转染72 h后收集细胞用于p21、p53、CDK4和CDK6 mRNA表达水平的分析。使用TRIzol Reagent裂解细胞后提取总RNA。使用PrimeScriptTMRT MasterMix逆转录RNA为cDNA。合成的cDNA使用特异性引物及SYBR©Premix ExTaqⅡ通过qPCR进行扩增并检测分析,以GAPDH为内参,结果数据采用2-△△Ct方法分析。相关引物序列见表1。

表1 qPCR相关引物序列
3.总蛋白提取和蛋白印迹法(Western blot)分析:转染后72 h用胰酶消化并收集细胞。磷酸盐缓冲液(PBS)洗涤2遍,加入含有蛋白酶抑制剂的细胞裂解液NP-40,4 ℃裂解30 min,高速离心15 min后取上清。使用BCA蛋白浓度测定试剂盒测定各组蛋白浓度。每个样本加30 μg蛋白至SDS-PAGE胶进行电泳,使用PVDF膜转膜后用含5%牛血清白蛋白的TBST溶液在室温封闭1 h,然后分别用一抗:P21(1∶1 000稀释)、CDK4(1∶1 000稀释)、CDK6(1∶1 000稀释)和β-actin(1∶500稀释)抗体在4 ℃冰箱孵育过夜。第2天用TBST洗膜,洗3次,每次10 min。采用羊抗鼠的二抗(1∶1 000 稀释)、羊抗兔的二抗(1∶1 000稀释)室温下孵育1 h,同样用TBST溶液洗膜,洗4次,每次10 min。最后使用ECL曝光显影。
4.细胞增殖实验检测:膀胱癌细胞转染相应dsRNA mimics后的第1、2、3、4、5天分别采用CellTiter 96©Aqueous One Solution Cell Proliferation Assay 试剂盒检测细胞增殖能力。每隔24 h取出转染后待检测的96孔细胞培养板,弃去培养液;避光条件下,加入110 μl的MTS稀释液(10 μl MTS试剂和100 μl细胞培养液),在细胞培养箱内孵育2 h;取出96孔板,避免产生气泡,用酶标仪检测细胞在490 nm波长的吸光率,保存数据;检测完成后将96孔板放回培养箱待下一时间点检测。
5.集落形成实验检测:转染24 h后,用胰蛋白酶消化细胞,重新接种于6孔细胞培养板,每孔1 000个细胞;3 d更换一次培养液,连续培养10 d;弃掉培养液后用PBS洗2遍;每孔加入1 ml甲醇固定15 min,弃去甲醇再用0.1%结晶紫溶液固定30 min;用流动水缓慢洗去染液,室温晾干后拍照、计数分析。
三、统计学方法
采用SPSS 13.0统计软件处理实验数据。所有实验结果均以均数±标准差表示,采用单因素方差分析检验各组间的差异。以P<0.05为差异有统计学意义。
结 果
一、qPCR结果
与dsControl组相比,在膀胱癌细胞系T24和EJ细胞中分别转入dsP21-555或dsP21-322,p21 mRNA表达均增高(P<0.05,P<0.01,P<0.001),而同时转入dsP21-555和dsP21-322,p21 mRNA的表达与单独转入两个dsRNAs相比并没有明显改变。在膀胱癌细胞系T24和EJ细胞中转入dsP53-285后,p53 mRNA表达明显高于dsControl组(P<0.05),转入dsP21-322后p53 mRNA表达没有显著变化。同时转入dsP21-322和dsP53-285,p53 mRNA表达与单独转入dsP53-285差异无统计学意义。同时转入dsP21-322和dsP53-285,P21的表达明显比单独转入二者增高,CDK4和CDK6的表达明显比单独转入二者减低(P<0.05,P<0.01)。图1。
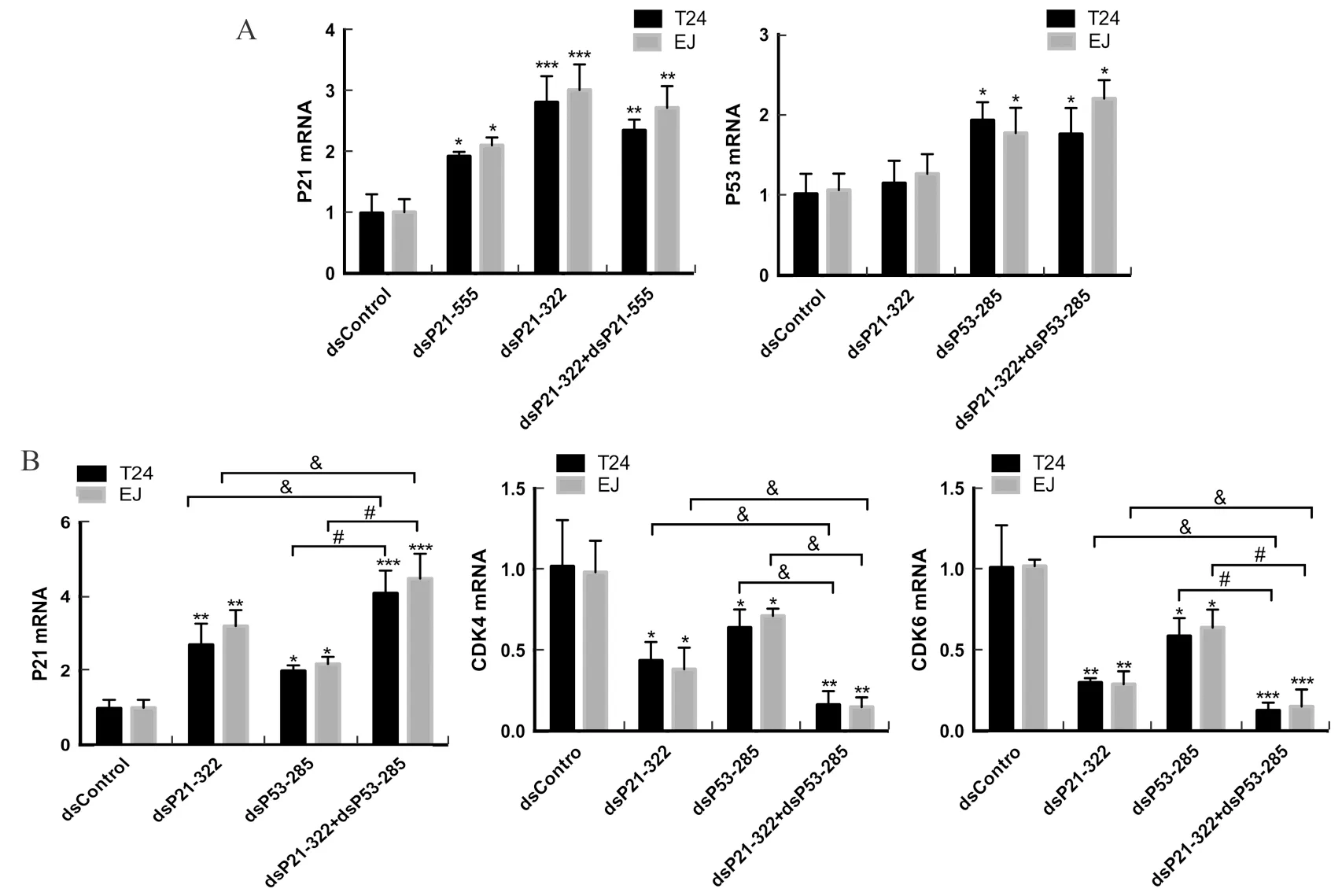
A:dsP21-322和dsP21-555都能使p21 mRNA表达增高(*P<0.05,**P<0.01,***P<0.001),而同时转入二者后p21 mRNA无明显变化,dsP53-285能激活p53基因,而dsP21-322对p53表达无影响,同时转入二者后p53 mRNA表达无明显变化;B:dsP21-322和dsP53-285都可以使得p21 mRNA表达增高,抑制CDK4和CDK6的表达(*P<0.05,**P<0.01,***P<0.001),同时转染dsP21-322和dsP53-285后,p21 mRNA明显增高,CDK4和CDK6显著被抑制(&P<0.05,#P<0.01)
图1 qPCR分析检测p21、p53和CDK4/6 mRNA相对表达量
二、Western blot检测P21和CDK4/6蛋白的表达
与单独转染dsP21-322 及dsP53-285相比,同时转染dsP21-322和dsP53-285组P21蛋白呈高表达,CDK4和 CDK6蛋白均呈现低表达。图2。
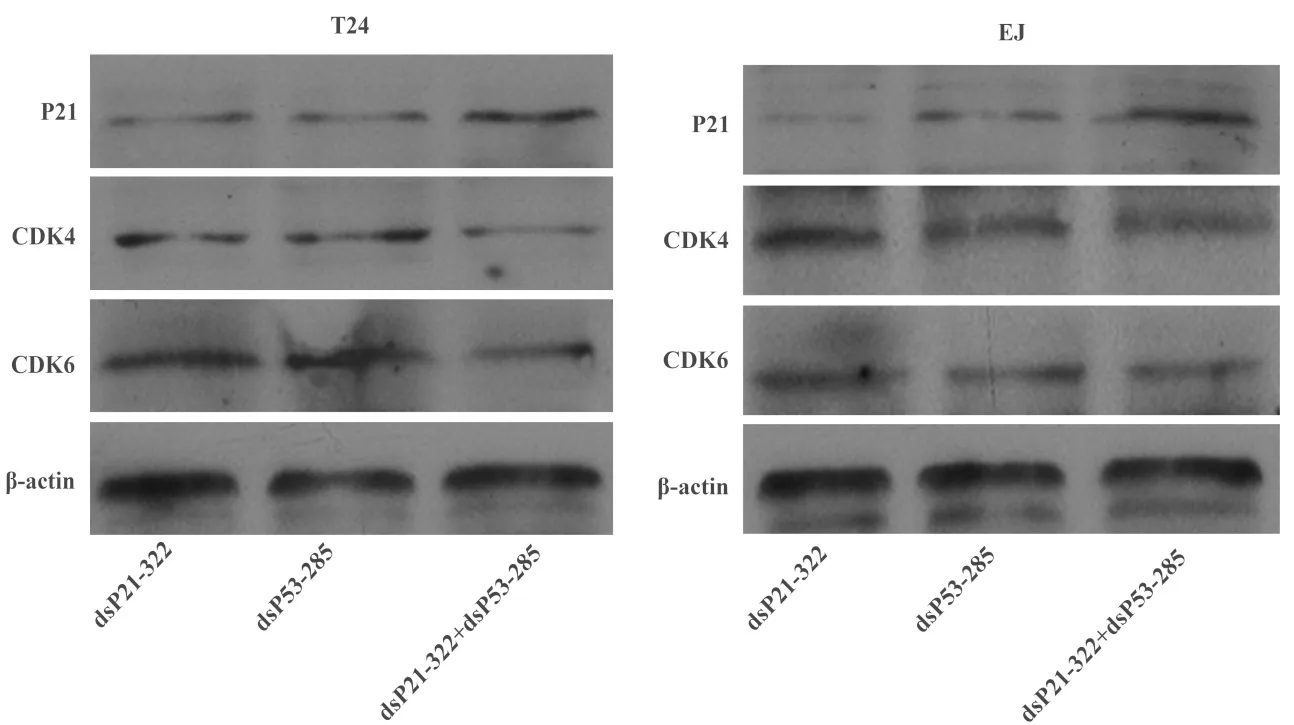
图2 Western blot检测P21、CDK4/6蛋白相对表达量,同时转入dsP21-322和dsP53-285后膀胱癌细胞系T24和EJ细胞中P21蛋白表达明显增高,CDK4和CDK6表达受抑制
三、细胞增殖实验
同时转染dsP21-322和dsP53-285的细胞增殖能力明显弱于单独转染dsP21-322或dsP53-285的细胞(P<0.05)。图3。
四、集落形成实验
dsP21-322+dsP53-285组形成的集落数要显著少于单独转染dsP21-322或dsP53-285形成的集落数。图4。
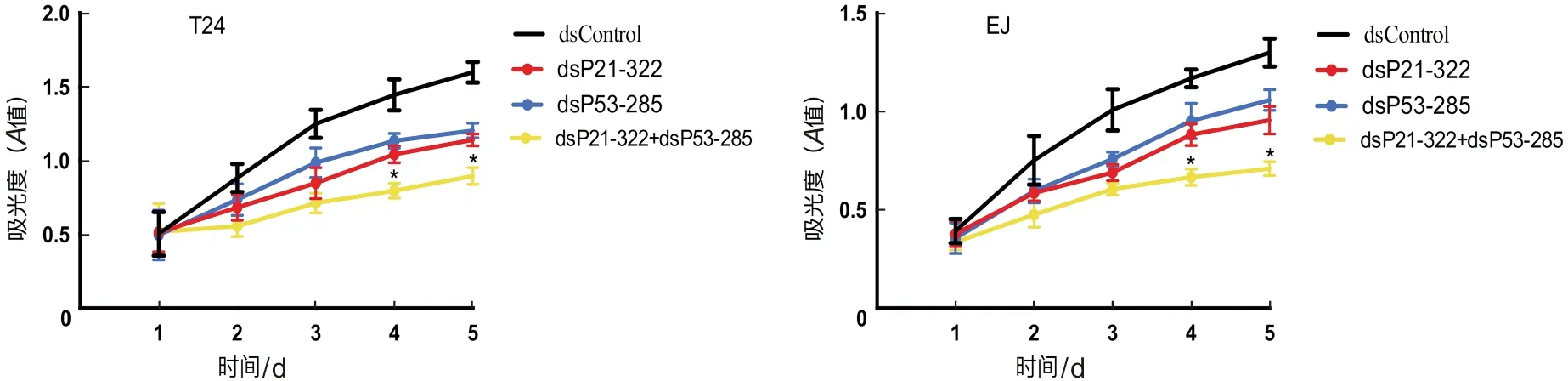
图3 细胞增殖实验检测细胞增殖能力,在dsP21-322+dsP53-285组中T24和EJ细胞生长能力明显弱于dsP21-322组和dsP53-285组(P<0.05)

图4 细胞集落形成实验检测细胞集落形成率,EJ和T24细胞在dsP21-322+dsP53-285组中的集落明显比dsP21-322组和dsP53-285组少
讨 论
RNA激活(RNAa)是近年来发现的由微小非编码RNA与目的基因的启动子区域结合而激活靶基因的一种基因表达调节机制[4-5]。人体内存在一些内源性微小RNA分子(miRNAs)具有RNAa效应[6]。RNAa的发现在医学生物范围内具有重要的理论和实际意义[6-7]。与之前发现的RNA干扰(RNAi)在转录后水平沉默特定靶基因的表达不同,RNAa是由小分子非编码RNA的反义链在转录水平激活靶基因的表达[8]。RNAa作用一般在转染细胞后48 h起作用,72 h达到高峰,作用时间可持续2周左右[1],所以本实验在转染72 h后收集细胞,提取总RNA和蛋白进行检测。
我们前期研究发现dsP21-322能够与p21启动子结合并激活p21基因的表达[4]。最近研究发现dsP21-555也可以通过与p21启动子结合而激活p21基因及其下游的表达[9]。本实验将dsP21-322和dsP21-555同时转入膀胱癌细胞系T24和EJ细胞中,发现这两个dsRNAs共存并没有使p21基因表达高于单一的dsRNA的作用。Place等[3]研究发现,将能够激活E-cadherin基因表达的miR-373与dsEcad-640一起转入前列腺癌细胞中也不能显著上调E-cadherin的表达。在此基础上,我们选择可以激活p53基因的dsP53-285,其能够间接的上调p21基因的表达;然后我们挑选激活p21基因作用明显的P21-322,并将二者同时转入膀胱癌细胞系T24和EJ细胞中。从实验结果可见,在T24和EJ细胞中同时转入P21-322和dsP53-285时,p21表达明显高于单独转入P21-322或dsP53-285。由此推论,作用于同一目的基因启动子的不同dsRNAs或者miRNAs并不能使其激活作用更强。而作用于不同靶基因的dsRNAs可能同时激活各自的靶基因从而发挥各自的生物学作用。这一发现为dsRNA在肿瘤中的应用提供了更广阔的理论基础。
目前RNAa已得到国际上越来越多学者的认可,而且RNAa在肿瘤发生、发展中也起到了非常重要的作用,但是其确切的作用机制还不清楚,还需要进行更为广泛而深入的研究。
[1] Li LC, Okino ST, Zhao H, et al.Small dsRNAs induce transcriptional activation in human cells[J].Proc Natl Acad Sci U S A,2006,103(46):17337-17342.
[2] Wang C, Ge Q, Zhang Q, et al.Targeted p53 activation by saRNA suppresses human bladder cancer cells growth and metastasis[J].J Exp Clin Cancer Res,2016,35:53.
[3] Place RF, Li LC, Pookot D, et al.MicroRNA-373 induces expression of genes with complementary promoter sequences[J].Proc Natl Acad Sci U S A,2008,105(5):1608-1613.
[4] Chen Z, Place RF, Jia ZJ, et al.Antitumor effect of dsRNA-induced p21(WAF1/CIP1) gene activation in human bladder cancer cells[J].Mol Cancer Ther,2008,7(3):698-703.
[5] 胡嘏,陈忠,吴嘉,等.saRNA在转录水平激活人膀胱癌细胞P21WAF1/CIP1的表达研究[J].现代泌尿生殖肿瘤杂志,2012,4(3):165-168.
[6] Wang C, Chen Z, Ge Q, et al.Up-regulation of p21(WAF1/CIP1) by miRNAs and its implications in bladder cancer cells[J].FEBS Lett,2014,588(24):4654-4664.
[7] 毛祺琦,谢立平,郑祥毅,等.RNA激活技术介导的E-cadherin基因上调表达抑制5637膀胱癌细胞侵袭与迁移[J].现代泌尿生殖肿瘤杂志,2009,1(1):34-38.
[8] Janowski BA, Younger ST, Hardy DB, et al.Activating gene expression in mammalian cells with promoter-targeted duplex RNAs[J].Nat Chem Biol,2007,3(3):166-173.
[9] 盖强强,汪成合,陈忠,等.人工合成小分子双链RNA通过激活P21蛋白对膀胱癌细胞生长的影响[J].中华医学杂志,2016,96(10):812-816.
(本文编辑:徐汉玲)
Combination of small double-stranded RNAs suppress the proliferation of bladder cancer cells
ZHANGQing-song,LIChuan-chang,CHENZhong,LIFan,YUANHui-xing,YANGWei-min.
DepartmentofUrology,TongjiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China
CHENZhong,E-mail:chenzhongtj@126.com
Objective To investigate the different effects between combined application of two different synthetic small double-stranded RNAs (dsRNAs) dsP21-322+dsP21-555, dsP21-322+dsP53-285 and one dsRNA on proliferation of bladder cancer cell lines T24 and EJ. Methods Bladder cancer cells were divided into: ①negative control group (dsControl), dsP21-322 group, dsP21-555 group and dsP21-322+dsP21-555 group.②dsControl group, dsP21-322 group, dsP53-285 group and dsP21-322+dsP53-285 group.Real-time fluorescent quantitative polymerase chain reaction (qPCR) was conducted to detect the expressions of p21 mRNA and cyclin-dependent kinases 4/6 (CDK4/6) mRNA.Western blot was operated to verify the expression of p21 and CDK4/6 proteins.Cell proliferation assay was performed to evaluate the proliferation capacity of transfected cells.Colony formation assay was carried out to analyze the proliferative ability of single cancer cell. Results qPCR results showed that, compared with the negative dsControl group, dsP21-322 group, dsP21-555group and dsP53-285 group up-regulated the expressions of P21 mRNA (P<0.01) in T24 and EJ cells.Compared with transfection of dsP21-322, or dsP21-555 alone, the expression of p21 mRNA showed no significantly difference in combined transfection of dsP21-322 and dsP21-555 group (P>0.05).Compared with dsControl group, dsP53-285 activated p53 mRNA expression.And the expression of p53 mRNA in dsP21-322 + dsP53-285 group and dsP53-285 group showed no difference.Compared with dsControl group, dsP21-322 and dsP53-285 dramatically reduced CDK4/6 mRNAs expression (P<0.05).Besides, compared with transfection of dsP21-322, dsP53-285 alone, the expression of p21, CDK4/6 mRNAs were suppressed in combined transfection of dsP21-322 and dsP53-285 group (P<0.05).Western blot assay verified the different expression of p21 and CDK4/6 genes among groups.Cell proliferation assay showed that, compared with dsP21-322 group and dsP53-285 group, the proliferative capacities of cells transfected with dsP21-322 and dsP53-285 together decreased significantly (P<0.05).Colony formation assay showed that the numbers of colonies formed in the dsP21-322 +dsP53-285 group were fewer than that in the dsP21-322 group and the dsP53-285 group. Conclusions The proliferation of bladder cancer cells could significantly suppressed when transfected with dsP21-322 and dsP53-285 together.
Urinary bladder neoplasms; dsRNAs; P21; RNAa
国家自然科学基金(81372759)
430030 武汉, 华中科技大学同济医学院附属同济医院泌尿外科
陈忠,E-mail:chenzhongtj@126.com
10.3870/j.issn.1674-4624.2016.04.009
2016-07-12)
