温室中有机氯农药残留及其对映体选择性研究
2016-12-22张安平孙建强
张安平,吕 立,孙建强,董 文,陈 炫
(1.浙江工业大学 环境学院,浙江 杭州 310014;2.中国环境科学研究院, 北京 100020)
温室中有机氯农药残留及其对映体选择性研究
张安平1,吕 立1,孙建强1,董 文1,陈 炫2
(1.浙江工业大学 环境学院,浙江 杭州 310014;2.中国环境科学研究院, 北京 100020)
以杭州市某温室蔬菜基地为例,对温室环境中土壤、地膜以及茄子、黄瓜与辣椒三种温室蔬菜组织中有机氯农药(Organochlorine pesticides, OCPs)的残留和来源状况进行分析,并对污染物在温室环境中的归趋进行探究.结果表明:温室土壤、地膜和蔬菜组织中滴滴涕(DDTs)的残留量均值分别为26,39,15 ng/g;六六六(HCHs)为4.9,8.5,2.8 ng/g;氯丹为2.0,1.8,0.68 ng/g,地膜的OCPs平均残留质量分数最高.残留组成分析表明:温室土壤都曾受到过DDTs、HCHs和氯丹的污染,但不存在大量的新污染源.对映体分数分析结果同样表明温室中不存在DDTs和HCHs的新污染源.各类OCPs中,DDTs在蔬菜组织中的质量分数最高,其次为HCHs和氯丹.
有机氯农药;温室;残留;对映体选择性
有机氯农药(Organochlorine pesticides, OCPs)作为一种应用较早的有机合成农药,其主要种类有六六六、滴滴涕、氯丹、艾氏剂、狄氏剂和三氯杀螨醇等.OCPs由于优良的杀虫效果而被广泛用于农作物的病虫害防治,但其本身具有持久性、高毒性以及易于在生物体中富集等特性,会对人体的内分泌、生殖系统等产生副作用.斯德哥尔摩公约规定禁止或限制使用DDTs、HCHs和氯丹等OCPs,而中国于1983年开始禁止或限制OCPs的生产及使用,但由于OCPs的持久性,近年来在全国各地水[1-2]、土壤[3-4]、大气[5]和生物体[6-7]等多种介质中都有检出OCPs残留.
温室由于能有效控制蔬菜生长的环境条件,有助提高作物产量,而被广泛应用于农业生产.根据联合国粮食及农业组织的统计,2008年中国设施蔬菜的产量占全国蔬菜总产量的36.86%.有研究表明:虽然多数OCPs在我国已经禁用多年,但我国多地的蔬菜及种植土壤中仍有OCPs残留[8-12],因此温室环境中OCPs的主要来源应是土壤残留,其中氯丹具有防治白蚁的功效,现在仍被少量使用.温室环境由于其自身的封闭性,OCPs在其中的迁移转化会受到影响,因此,笔者选取茄子、南瓜和辣椒三种蔬菜作为研究对象,分析OCPs在温室环境和蔬菜中的分布及迁移趋势,为设施蔬菜安全生产提供理论和技术支持.
1 实验部分
1.1 样品采集
本实验采集土壤、地膜和蔬菜三类样品,采样地点为杭州市某蔬菜温室基地,且均在无风晴天天气下进行.
土壤样品分为非根际土与根际土,非根际土指采集时被根部包裹并掉落的土壤;根际土是指未从根部掉落的土壤[13],样品用均匀布点法采集,每个监测单元设立3个采样点,样品采集混匀后取1 kg,用铝箔纸包裹后装入样品袋.土壤样品去除杂质、风干后过60目(0.25 mm孔径)尼龙筛保存.
地膜采集于蔬菜植株附近,去除表面粘附的泥土灰尘后,剪成小块保存.
三类蔬菜样品分别从三个不同温室中采集,采样点数和点位与土壤样品相同,每个采样点位内采集3株植株组成混合样品.果实从植株不同高度处分别采取,叶子根据新老分别均匀采集.根、茎、叶和果实采样量均为1 kg左右(鲜重),分开装入聚乙烯塑料袋后扎紧,运回实验室冷藏待用.
1.2 OCPs质量分数的测定
1.2.1 试剂及药品
11种有机氯农药标样购自Sigma公司,包括α-六六六(α-HCH),β-六六六(β-HCH),γ-六六六(γ-HCH),δ-六六六(δ-HCH),o,p′-DDT,o,p′-DDD,p,p′-DDT,p,p′-DDD,p,p′-DDE,顺氯丹(cis-Chlordane,CC),反氯丹(trans-Chlordane,TC).实验用的内标五氯硝基苯(pentachloronitrobenzene,PCNB),示踪标四氯间二甲基苯酚(2,4,5,6-tetrachloro-m-xylene,TCmX)和十氯联苯(decachlorobiphenyl,PCB209)购自Sulpelco公司.正己烷、二氯甲烷为色谱纯,购自TEDIA公司.硅胶(60~100 目)和氧化铝(100~160 目)分别经马弗炉130 ℃烘烤3,4 h,无水硫酸钠在300 ℃中烘烤4 h.
1.2.2 土壤和地膜样品前处理
称取20.0 g土壤样品,用滤纸包裹好后装入250 mL索氏提取管,加入120 mL二氯甲烷提取24 h,期间保持每秒小于3滴的回流速度.提取冷却完毕后转移至圆底烧瓶,利用旋转蒸发仪浓缩至约5 mL,并将溶剂置换成正己烷.层析柱采用湿法装填,从下至上依次为2 g无水硫酸钠、4 g活化硅胶、2 g活化氧化铝和2 g无水硫酸钠.淋洗过程先用10 mL正己烷淋洗,再用70 mL二氯甲烷和正己烷(V(二氯甲烷)∶V(正己烷)=3∶7)混合溶剂淋洗,将淋洗液转移到平底烧瓶后,旋蒸至微湿并替换溶剂为正己烷,然后氮吹至5 mL.取一部分样品加入10 μL内标(PCNB,2 μg/mL)后定容到1.0 mL.剩余样品用0.5 mL浓硫酸酸洗后浓缩到100 μL用于手性有机氯农药的对映体分数(Enantionmer fraction,EF)分析.地膜样品在前处理之前,先用纯水清洗附着的土壤,其提取、净化和浓缩过程与土壤样品相同.
1.2.3 蔬菜样品前处理
蔬菜的叶和果实置于加了无水硫酸钠的研钵中研磨至无水分,根、茎样品用高速粉碎机粉碎成浆状.称取10.0 g蔬菜组织样品放入装有50 mL丙酮的具塞三角瓶中搅拌3 min,再超声提取30 min后抽滤,将残渣反复提取2 次.提取液一并转移到250 mL分液漏斗中,加入10 mL浓硫酸并振摇5 min,放气静置后弃去硫酸层,重复上述净化过程2 次,然后加入70 mL饱和氯化钠溶液并振摇5 min,弃去水层.有机溶剂过装有无水硫酸钠的漏斗除去水分后转移至平底烧瓶,旋蒸至微湿并替换溶剂为正己烷.净化过程用120 mL正己烷和丙酮(V(正己烷)∶V(丙酮)=9∶1)作为淋洗液,其他步骤与1.2.2中相同.
1.2.4 测试方法
仪器为美国Agilent气相色谱仪(6890A),配备ECD检测器.色谱柱采用DB-1701(30 m×0.32 mm×0.25 μm).载气为高纯氮,载气流速1.0 mL/min,进样量1 μL,不分流进样,进样口温度220 ℃,检测器温度325 ℃;升温程序初始温度为60 ℃,保持5 min,再以20 ℃/min速率升至140 ℃后直接以5 ℃/min速率升至260 ℃,保持10 min[14].
1.3 有机氯农药的EF值测定
测定所用的外消旋体标准品α-HCH,CC、TC、o,p′-DDT和o,p′-DDD购自Sigma公司.仪器为美国Agilent气相色谱-质谱联用仪(7890 GC-5975C MSD),配备负化学离子源(NCI),色谱柱为手性柱BGB-172(30 m×0.25 mm×0.25 μm).载气为99.999%高纯氦气,载气流速1.0 mL/min,进样量2 μL,不分流进样,进样口温度250 ℃,接口温度220 ℃,离子源温度150 ℃,四级杆温度150 ℃,甲烷压力1.0Torr.初始温度为90 ℃,以15 ℃/min升温到160 ℃,再以1 ℃/min 升至190 ℃后保持温度35 min,最后以20 ℃/min升至 230 ℃,保持20 min.
1.4 分析过程的QA/QC
本实验采用现场空白、方法空白、加标回收和样品平行样对整个实验流程进行监控,各样品的回收率在64%~116%之间,TCmX和PCB209两种示踪标的回收率分别为(88.3±11.3)%和(77.8±9.6)%,11种目标化合物的方法检出限处在0.009~0.23 ng/g之间.
2 结果与讨论
2.1 土壤和地膜中OCPs分布
温室茄子、南瓜和辣椒的非根际土HCHs质量分数范围分别为4.7~5.9,5.0~5.2,4.6~4.9 ng/g.根际土中HCHs质量分数范围分别为3.9~5.1,4.8~4.9,4.4~4.9 ng/g.HCHs的质量分数均低于国家土壤环境的第一级标准值10 ng/g.茄子、南瓜和辣椒温室地膜中HCHs的残留量分别为12,8.2,5.9 ng/g,地膜中HCHs的残留量均高于土壤.如图1所示,非根际土、根际土和地膜中α-HCH所占百分比范围为27%~50%,低于工业品值,可能原因为α-HCH是HCHs四种异构体中最容易降解的,在没有新污染源输入的情况下,α-HCH比例会不断下降.HCHs异构体中最稳定的是β-HCH,其次为δ-HCH,除茄子非根际土中的β-HCH外,其它介质中β-HCH和δ-HCH的比例皆大于工业值,与其环境稳定性相符.土壤中γ-HCH的比例高于地膜,且γ-HCH是唯一非根际土平均质量分数(1.2 ng/g)高于地膜平均质量分数(0.53 ng/g)的异构体.

1—茄子非根际土;2—南瓜非根际土;3—辣椒非根际土;4—茄子根际土;5—南瓜根际土;6—辣椒根际土;7—茄子地膜;8—南瓜地膜;9—辣椒地膜;10—工业品图1 土壤、地膜和工业品中各HCHs异构体的比例Fig.1 The proportion of HCHs isomers in soil, agricultural films and industrial products
温室中茄子、南瓜和辣椒的非根际土DDTs质量分数范围分别为23~26,29~30,25~27 ng/g.根际土的DDTs质量分数范围则分别为21~24,26~29,21~29 ng/g,皆低于国家土壤环境DDTs质量分数的第一级标准值50 ng/g.茄子、南瓜和辣椒地膜中DDTs残留量分别为38,50,28 ng/g.如图2所示,本实验中p,p′-DDD在三类蔬菜土壤DDTs残留中所占比例均为最高,但广东省典型农业土壤的研究结果表明:p,p′-DDE在土壤中残留量最高[15-16],可能是土壤环境、性质不同引起的[17].如图3所示,DDTs是三类蔬菜土壤OCPs残留总量中占比最高的,这与国内外相关研究结果相一致[18-20].

1—茄子非根际土;2—南瓜非根际土;3—辣椒非根际土;4—茄子根际土;5—南瓜根际土;6—辣椒根际土;7—茄子地膜;8—南瓜地膜;9—辣椒地膜;10—工业品图2 土壤、地膜和工业品中各DDTs的比例Fig.2 The proportion of DDTs in soil, agricultural films and industrial products

1—茄子非根际土;2—南瓜非根际土;3—辣椒非根际土;4—茄子根际土;5—南瓜根际土;6—辣椒根际土;7—茄子地膜;8—南瓜地膜;9—辣椒地膜图3 蔬菜土壤、地膜中各OCPs占比情况Fig.3 The proportion of OCPs in soil and agricultural films
温室中茄子、南瓜和辣椒的非根际土氯丹平均质量分数分别为1.4,3.1,1.6 ng/g,根际土氯丹的平均质量分数分别为1.5,2.8,1.6 ng/g,地膜中分别为2.5,1.4,1.4 ng/g.从图3可知:氯丹是土壤及地膜中残留量最低的OCPs,原因是氯丹虽然是杀虫剂,其主要用途是防治白蚁,而在农业上的用量不及HCHs和DDTs[21].
2.2 土壤中OCPs污染源分析
工业HCHs中γ-HCH比例为10%~12%,林丹中γ-HCH质量分数在99%以上.利用分子标志示踪可对污染源进行分析,通常工业HCHs的α/γ-HCH值为5~7,林丹则接近于0.由于γ-HCH易降解,且在环境中会转化为α-HCH,林丹污染会使环境中的γ-HCH比例上升,因此当α/γ-HCH值处在0~5时,可认为环境曾受工业HCHs和林丹污染.α/β-HCH值被用来判断污染是否为历史使用,因为β-HCH比α-HCH更为稳定,工业HCHs中α/β-HCH值约为11.8,当环境中该值小于11.8可认为曾有工业HCHs输入.茄子、南瓜和辣椒土壤中α/γ-HCH值范围分别为0.98~3.0,1.1~1.3,0.90~1.2;α/β-HCH值分别为0~3.6,1.3~1.4,1.3~1.5.这说明三类蔬菜土壤都曾受到过工业HCHs和林丹污染,α/β-HCH远低于工业值说明污染发生时间较久远,且无新污染源.
DDT在环境中会发生降解,降解产物为DDDs和DDEs,因此DDTs/(DDDs+DDEs)值可以说明环境中是否存在新的DDTs污染源[22].工业品DDTs的o,p’-DDT/p,p’-DDT值为0.2~0.3,三氯杀螨醇中含有一定量的o,p’-DDT,且环境中o,p’-DDT比p,p’-DDT更易降解[23],因此o,p’-DDT/p,p’-DDT值大于0.3可以作为环境曾受三氯杀螨醇污染的依据.茄子、南瓜和辣椒土壤中DDTs/(DDDs+DDEs)值分别为0.31~0.45,0.18~0.22,0.22~0.41,该值偏小说明温室土壤没有新的DDTs污染源[24].o,p’-DDT/p,p’-DDT值分别为0.29~0.48,0.63~0.76,0.28~0.57,并且均值都大于0.3,这表明温室土壤曾受三氯杀螨醇的污染.
对映体分数(EF)也是分析手性化合物污染的一种途径.EF值是(+)对映体占(+)和(-)对映体总量的比值,其表达式为
(1)
式中:A+为(+)对映体峰面积;A-为(-)对映体峰面积.
EF是地球环境化学重要示踪剂,手性化合物在新进入环境时,其EF值接近于0.5,随着在环境中存留时间的增加,其EF值将逐渐偏离0.5[25].手性化合物进入环境后不同对映异构体的消解和归趋表现是不同的,且对映异构体之间存在相互转化的现象.研究表明,在土壤介质中,微生物群落和行为的不同是使手性农药选择性降解的原因之一,手性选择性酶的诱导以及土壤本身酸碱性的差异也会造成不同手性对映体残留量的不同[26-27].本实验测定了α-HCH、o,p’-DDT、o,p’-DDD、CC和TC五种手性OCPs的EFs值,图4为非根际土中所测物质的EF值与EF=0.5的偏差.由图4可知:α-HCH、o,p’-DDT和o,p’-DDD的EF值存在较大偏离,证明各温室中不存在新的HCHs和DDTs污染源,而茄子、南瓜的CC和TC的EF偏差仅为±0.1,说明氯丹可能有新的污染源.通过相关性分析发现:三类蔬菜非根际土的EF值两两之间均无显著相关性,这说明手性OCPs在不同土壤环境下的选择性降解存在差异性.

1—α-HCH;2—o,p’-DDT;3—o,p’-DDD;4—CC;5—TC图4 非根际土中手性化合物EF值的偏离情况Fig.4 The EF values deviations of chiral compounds in rhizosphere soils
2.3 蔬菜组织中OCPs分布
三类蔬菜根、茎、叶和果实中OCPs残留总量从高到低依次为DDTs、HCHs、氯丹,这与土壤中的残留情况相一致.
茄子根、茎、叶和果实四类组织中HCHs的残留量为1.3~3.6 ng/g.DDTs在茄子茎中残留量最高,范围为41~66 ng/g,其中叶的残留量最低,范围为1.9~5.2 ng/g,与土壤中DDTs异构体和降解产物残留量不同,茄子的四类组织中o,p′-DDT质量分数最高,说明茄子对DDTs具有选择性吸收.氯丹在茄子四类组织中的残留范围为0.24~1.5 ng/g,其中根部质量分数最高.
南瓜根、茎、叶和果实四类组织中HCHs的质量分数在0.87~2.5 ng/g之间,其中α/β-HCH和α/γ-HCH值与土壤相近,说明南瓜的四类组织中HCHs主要来自土壤.南瓜果实中DDTs残留量最高,范围为8.0~26 ng/g,叶中质量分数最低,为1.1~1.6 ng/g.氯丹在南瓜的四类组织中残留量为0.11~0.88 ng/g.研究表明,南瓜等葫芦科植物对二噁英、OCPs等有机化合物富集能力较强[28-31],本研究中南瓜与其它两种蔬菜相比,果实的OCPs残留总量最高,与此结论相符.
辣椒根、茎、叶和果实四类组织中HCHs的残留质量分数范围分别为1.3~4.5 ng/g,α/β-HCH和α/γ-HCH值与辣椒土壤相近,说明辣椒中HCHs的来源为土壤.辣椒根的DDTs质量分数最高,为14~17 ng/g,其次是果实,质量分数范围为6.8~7.0 ng/g.氯丹的质量分数处在0~1.4 ng/g之间.
植物对污染物的吸收以及传输能力受到多种因素的影响,脂溶性强的有机物污染物更容易在植物根部富集,但其在植物体内的传输作用会减弱.当有机物污染物Kow>1 000时,有机物的吸收几乎都是依靠脂肪的分配作用,脂肪是植物体内亲脂性机物的主要存在介质,脂肪含量对植物吸收有机污染的方式起到决定作用.因此,不同OCPs在茄子、南瓜和辣椒中分布的差异可能是由不同OCPs脂溶性的差异以及植物组织中脂含量不同所造成的.
2.4 蔬菜温室中OCPs归趋分析
生物富集因子(BCF)是衡量环境污染物在生物体内富集趋势的参数,本研究中BCFs值为根与非根际土中OCPs质量分数的比值,该值越大,说明根的OCPs富集能力越强.分析结果表明DDTs的BCF平均值最大,最易被根部富集,其次为HCHs,氯丹最不易被富集.
三类蔬菜OCPs的BCFs值如图5所示,从污染物角度分析,o,p′-DDT的BCFs值在三类蔬菜中都是最高的,这说明根对o,p′-DDT的富集能力最强.根对p,p′-DDD的富集能力最弱,BCF平均值为0.01,基本不会被根部吸收.从植物角度分析,辣椒根对β-HCH、p,p′-DDT、o,p′-DDD和p,p′-DDD的吸附能力是三类蔬菜中最强的,且最容易吸收o,p′-DDD,但辣椒根部几乎不会吸附氯丹.而茄子则对o,p′-DDD、α-HCH和氯丹的吸附能力较强,以上分析说明,不同种类植物对OCPs的吸收存在明显的选择性.通过显著性分析发现,在不包含o,p′-DDT的前提下,南瓜和辣椒之间的BCFs值存在显著相关性(r=0.72,p=0.018),而茄子其他两类蔬菜的BCFs值之间不存在显著相关性,这说明南瓜和辣椒根系对OCPs的吸收能力相似,而茄子与其他两类蔬菜的吸收能力存在较大差异性.
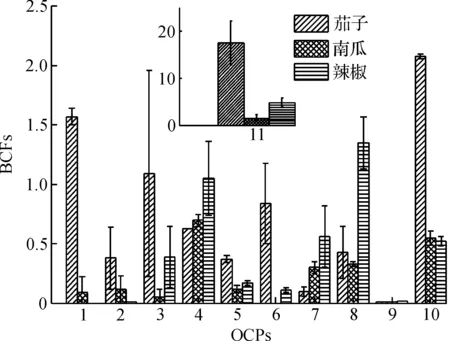
1—CC;2—TC;3—α-HCH;4—β-HCH;5—γ-HCH;6—δ-HCH;7—p,p′-DDT;8—o,p′-DDD;9—p,p′-DDD;10—p,p′-DDE;11—o,p′-DDT图5 蔬菜中各类OCPs的BCFs值Fig.5 The BCFs values of OCPs in vegetables
此外,通过皮尔森相关系数分析发现:茄子、南瓜和辣椒根部与根际土的OCPs质量分数存在显著相关性(r=0.59,0.82,0.76;p=0.03,0.00,0.002),这说明三类蔬菜根部OCPs主要来自土壤.
3 结 论
土壤中各类OCPs质量分数从高到低依次为DDTs、HCHs、氯丹,并且都低于国家土壤环境的第一级标准值.根据分析可知:三类蔬菜的温室土壤都曾受到工业HCHs、林丹、三氯杀螨醇以及氯丹的污染.茄子、南瓜和辣椒组织中OCPs残留量从高到低依次为DDTs,HCHs,氯丹,与土壤残留状况保持一致.蔬菜根部对OCPs的吸收具有选择性,且DDTs最容易被富集,氯丹最不易被富集.
[1] 唐访良,张明,徐建芬,等.千岛湖库区及其主要入库河流水中有机氯农药残留污染特征及健康风险评价[J].环境科学,2014,35(5):1735-1741.
[2] 龚香宜,孙云雷,何炎志,等.江汉平原地下水中有机氯农药的残留及分布特征[J].地质科学情报,2015,34(1):210-215.
[3] 裴绍峰,刘海月,叶思源.我国南方主要城市土壤有机氯农药残留及分布特征[J].山东农药大学学报(自然科学版),2014,45(5):768-774.
[4] 王岩,肖燕,张保华,等.聊城市耕地土壤有机氯农药残留与农业功能定位研究[J].山东农业大学学报(自然科学版),2013,44(2):193-198.
[5] 马子龙,毛潇萱,丁中高,等.新疆哈密地区有机氯农药大气、土壤残留特征、气-土交换及潜在生态风险[J].环境科学,2013,34(3):1120-1128.
[6] 周珊珊,杜晴,王翀,等.舟山渔场海产品中有机氯农药的残留及对映体过剩[J].浙江工业大学学报,2012,40(6):599-605.
[7] 万译文,洪波,肖维,等.某市水产品中有机氯农药残留水平及健康分析评价[J].中国渔业质量与标准,2013,3(2):18-23.
[8] 游远航.广州地区蔬菜生产基地有机污染物含量状况及分布[J].吉林大学学报(地球科学版),2015,45(4):1205-1216.
[9] 罗赟,向仲朝,岳蕴瑶.绵阳市蔬菜、水果和粮食中四中有机氯农药残留量调查[J].中国卫生检验杂志,2012,22(8):1950-1955.
[10] 潘声旺,罗竞红,何茂萍,等.成都市蔬菜种植土壤中有机氯农药分布特征及风险评价[J].成都大学学报(自然科学版),2011,30(3):195-200.
[11] 贺心然,宋晓娟,逢勇,等.连云港市典型蔬菜基地土壤中重金属和有机氯污染调查与评价[J].环境监控与预警,2014,6(4):39-42.
[12] 胡春华,周文斌,易纯,等.环鄱阳湖区蔬菜地土壤中有机氯农药分布特征及生态风险评价[J].农业环境科学学报,2011,30(3):487-491.
[13] MATTINA M I, WHITE J, EITZER B, et al. Cycling of weathered chlordane residues in the environment: compositional and chiral profiles in contiguous soil, vegetation, and air compartments[J]. Environmental toxicology and chemistry,2002,21(2):281-8.
[14] 曹慧,林珍珍,陈小珍,等.固相萃取-气相色谱/三重四级杆质谱法同时分析蔬菜中的50种农药残留量[J].浙江工业大学学报,2012,40(3):279-283.
[15] 杨国义,万开,张天彬,等.广东省典型区域农业土壤中有机氯农药含量及其分布特征[J].农业环境科学学报,2007,26(5):1619-23.
[16] 陈向红,胡迪琴,廖义军,等.广州地区农田土壤中有机氯农药残留分布特征[J].环境科学与管理,2009,34(6):117-20.
[17] 汤宇恋,汪志威,何岸飞,等.设施环境下百菌清、毒死蜱在黄瓜中的分布特征[J].浙江工业大学学报,2012,40(3):289-294.
[18] 岳强,管玉峰,涂秀云,等.广东北江上游流域农田土壤有机氯农药残留及其分布特征[J].生态环境学报,2012,21(2):321-326.
[19] 朱英月,刘全永,李贺,等.辽东与山东半岛土壤中有机氯农药残留研究[J].土壤学报,2015,52(4):888-900.
[20] DEVI N L, YADAV I C, RAHA P, et al. Spatial distribution, source apportionment and ecological risk assessment of residual organochlorine pesticides (OCPs) in the Himalayas[J]. Environmental science and pollution research,2015,22(24):20154-20166.
[21] 李军,张干,祁士华,等.珠江三角洲土壤中氯丹的残留特征[J].土壤学报,2007,44(6):1058-1062.
[22] 王卿梅,何玘霜,王雁,等.巢湖悬浮物中有机氯农药的分布、来源与风险[J].湖泊科学,2014,26(6):887-896.
[23] LI X H, WANG W, WANG J, et al. Contamination of soils with organochlorine pesticides in urban parks in Beijing, China[J]. Chemosphere,2008,70(9):1660-8.
[24] CALAMARI D, BSCCI E, FOCARDI S, et al.Role of plant biomass in the global environmental partitioning of chlorinated hydrocarbons[J]. Environment science technology,1991,25:1489-1495.
[25] HEGEMAN W J M, LAANE R. Enantiomeric enrichment of chiral pesticides in the environment[J]. Reviews of environmental contamination and toxicology,2002,173:85-116.
[26] BUERGE I J, POIGER T, MULLER M D, et al. Influence of pH on the stereoselective degradation of the fungicides epoxiconazole and cyproconazole in soils[J]. Environmental science &technology,2006,40:5443-5450.
[27] WU C W, SUN J Q, ZHANG A P, et al. Dissipation and enantioselective degradation of plant growth retardants paclobutrazol and uniconazole in open field, greenhouse, and laboratory soils[J]. Environmental science &technology,2013,47,843-849.
[28] WHITE J C.Differential bioavailability of field-weathered p,p′-DDE to plants of the Cucurbita and Cucumis genera[J]. Chemosphere,2002,49(2):143-52.
[29] HULSTER A, MULLER J F, MARSCHNER H.Soil-plant transfer of polychlorinated dibenzo-p-dioxins and dibenzofurans to vegetables of the cucumber family (cucurbitaceae)[J]. Environmental science & technology,1994,28(6):1110-1115.
[30] MATTINA M I, WHITE J, EITZER B, et al. Cycling of weathered chlordane residues in the environment: compositional and chiral profiles in contiguous soil, vegetation, and air compartments[J]. Environmental toxicology and chemistry,2002,21(2):281-288.
[31] WHITE J C.Plant-facilitated mobilization and translocation of weathered 2,2-bis(p-chlorophenyl)-1,1-dichloroethylene (p,p′-DDE) from an agricultural soil[J]. Environmental toxicology and chemistry,2001,20(9):2047-2052.
(责任编辑:陈石平)
Residues and enantioselectivity of organochlorine pesticide from greenhouse
(1.College of Environment, Zhejiang University of Technology, Hangzhou 310014, China; 2.Chinese Research Acaemy of Environmental Sciences, Beijing 100020, China)
This work investigated the pollution sources and the transport trend of organochlorine pesticides (OCPs) in greenhouse soils, agricultural films, eggplants, cucumbers and peppers in greenhouse farm in Hangzhou. The mean concentrations of dichlorodiphenyltrichloroethanes (DDTs) in soils, agricultural films and vegetables were 26 ng/g, 39 ng/g and 15 ng/g, respectively. The mean concentrations of hexachlorocyclohexane (HCHs) were 4.9 ng/g, 8.5 ng/g, and 2.8 ng/g for soils, agricultural films and vegetables, respectively. The mean concentrations of chlordane were 2.0 ng/g, 1.8 ng/g and 0.68 ng/g for soils, agricultural films and vegetables, respectively. The results showed that greenhouse soils have been polluted by chlorophenothane (DDT), hexachlorocyclohexane (HCHs) and chlordane in history and no new obvious pollution source of OCPs in these greenhouses. The results of enantiomer fraction analysis also showed that there was no new pollution source of HCHs and DDTs in greenhouses. DDTs have the highest concentration in vegetable tissues, and followed by HCHs and chlordane.
organochlorine pesticide; greenhouse; residues; enantioselectivity
2016-03-18
国家自然科学基金面上项目(41073090);环境基准与风险评价评估国家重点实验室开放课题(20B-GOT-016-N-02)
张安平(1976—),男,甘肃定西人,教授,研究方向为污染物迁移与转化,E-mail:azhang@zjut.edu.cn
X172
A
1006-4303(2016)06-0639-06
