硫化氢及其合成酶抑制剂对小鼠急性胰腺炎自噬功能的影响
2016-12-22徐玲玲凤辉殷国建周春华王少峰
徐玲玲 凤辉 殷国建 周春华 王少峰
·论著·
硫化氢及其合成酶抑制剂对小鼠急性胰腺炎自噬功能的影响
徐玲玲 凤辉 殷国建 周春华 王少峰
目的 探讨给予外源性硫化氢(H2S)及其合成酶抑制剂炔丙基甘氨酸(PAG)对雨蛙素诱导的小鼠急性胰腺炎(AP)自噬功能的影响。方法 60只雄性BALB/c小鼠,按数字表法随机分为对照组、AP组、硫氢化钠(NaHS)组、PAG组。采用连续6次腹腔注射雨蛙素(50 μg/kg体重)、每次间隔1 h的方法建立小鼠AP模型。NaHS组及PAG组在造模前1 h分别腹腔注射NaHS 10 mg/kg体重、PAG 50 mg/kg体重,对照组及AP组小鼠腹腔注射等容积生理盐水。于第1次注射雨蛙素12 h后处死小鼠,取血检测血清淀粉酶、脂肪酶含量,采用去蛋白分光光度法测定血清H2S含量;取部分胰腺组织常规行病理学检查并进行病理评分;采用Real-time PCR法检测胰腺组织硫化氢合成酶胱硫醚-γ裂解酶(CSE)mRNA表达,蛋白质印迹法检测胰腺组织自噬相关的微管相关蛋白轻链3-Ⅱ(LC3-Ⅱ)与LC3-Ⅰ的比值及泛素结合蛋白(p62)的表达。结果 对照组血清淀粉酶、脂肪酶、H2S浓度及胰腺组织CSE mRNA、LC3-Ⅱ/LC3-Ⅰ值和p62表达量分别为(2 700±100 )U/L、(70±20 )U/L、(22.9±1.7)mmol/L、1.0±0.1、0.419±0.080、0.227±0.140; AP组小鼠分别为(17 290±500)U/L 、(520±40)U/L、 (31.3±3.0)mmol/L、5.4±0.4、1.184±0.120、1.985±0.210; NaHS组分别为(27 784±1 200)U/L、(900±80)U/L、(38.6±3.3)mmol/L、6.9±0.9、1.600± 0.210、4.229±0.050;PAG组分别为(13 750±2 000)U/L、(370±20)U/L、(24.5±2.1)mmol/L、4.2±0.5、0.745±0.130、1.203±0.080。AP组上述指标均显著高于对照组,NaHS组又较AP组进一步显著升高,而PAG组较AP组显著降低,差异均有统计学意义(P值均<0.05)。NaHS组胰腺病理损伤较AP组进一步加重,而PAG组胰腺病理损伤较AP组显著减轻。结论 PAG能够降低血清淀粉酶、脂肪酶水平,减轻AP时自噬功能的受损状况,减轻AP的严重程度。
胰腺炎; 硫化氢; 炔丙基甘氨酸; 自噬
Correspondingauthor:WangShaofeng,Email:sfwang59@sina.cn
急性胰腺炎(AP)是多种病因导致的胰蛋白酶在胰腺内被异常激活而引起的胰腺组织自身消化、水肿、出血坏死的炎症反应,近年来该病发病率有上升趋势。研究发现,AP时,在动物和人的胰腺组织中均可发现大量自噬空泡,且抑制自噬可缓解AP的炎症反应和组织损伤[1-2],认为自噬受损参与了AP胰腺腺泡空泡形成及胰蛋白酶原的激活[3]。硫化氢(H2S)作为一种重要的气体信号分子,具有分子量较小、起效快等优点,参与机体广泛的生理、病理过程[4],其中一种重要的机制便是调节细胞的凋亡和自噬[5]。虽然近年来有关H2S在多种疾病中自噬通路方面的研究越来越多,但其对AP时自噬的作用尚未见相关报道。因此,本研究采用腹腔注射H2S的外源性供体硫氢化钠(NaHS)及H2S合成酶抑制剂炔丙基甘氨酸(DL-propargylglycine,PAG)干预AP小鼠,探讨H2S及PAG对小鼠AP自噬功能的影响,为临床上治疗AP探索新的策略。
材料与方法
一、材料及试剂
清洁级雄性BALB/c小鼠60只,体重(20±2)g,购于苏州大学实验动物中心,在室温22℃、相对湿度40%~70%的动物房内适应性饲养1周后进行实验。NaHS、PAG购于美国Sigma公司,雨蛙素(caerulein)购于美国AanSpec公司,与自噬相关的微管相关蛋白轻链3(microtubule-associated light chain-3,LC3)、泛素结合蛋白(ubiquitin binding protein,p62/SQSTM1,p62)抗体购于美国Abcam公司。cDNA逆转录试剂盒购于美国Thermo公司,荧光定量PCR SYBR green mix试剂盒购于诺唯赞公司,H2S合成酶胱硫醚-γ 裂解酶(cystathionine γ-lyase, CSE)及内参GAPDH引物购于上海生工生物工程有限公司。
二、动物分组及模型制备
实验小鼠造模前禁食过夜,自由饮水。将小鼠按数字表法随机分为对照组、AP组、NaHS组、PAG组,每组15只。采用腹腔注射雨蛙素50 μg/kg体重6次、每次间隔1 h的方法建立小鼠AP模型。NaHS组及PAG组在造模前1 h分别腹腔注射NaHS 10 mg/kg 体重、PAG 50 mg/kg体重。对照组及AP组小鼠腹腔注射等容积生理盐水。于第1次注射雨蛙素12 h后处死小鼠,取血离心分离血清,同时快速取出胰腺组织,部分置4%中性甲醛液固定,部分液氮冷冻后置-70℃冰箱保存。
三、血清淀粉酶、脂肪酶及H2S含量检测
血标本送苏州大学附属第二医院检验科应用全自动生化分析仪测定血清淀粉酶、脂肪酶含量;采用去蛋白的分光光度法检测血清H2S含量。
四、胰腺组织病理学检查
取固定的胰腺组织,常规行病理学检查,并采用双盲法按Schmidits标准对胰腺组织进行病理评分。
五、胰腺组织CSE mRNA表达检测
应用TrIzol试剂提取胰腺组织总RNA,按RT-PCR试剂盒说明书逆转录合成cDNA,再以cDNA为模板,按照SYBR Premix EX Taq 试剂盒说明书进行定量PCR扩增。CSE上游引物序列为5′-GGGTCTTGCTGCCACCATTA-3′,下游引物序列为5′-TGTGGTGTAATCGCTGCCTC-3′;内参GAPDH上游引物序列为5′-TGGCCTTCCGTGTTCCTAC-3′,下游引物序列为5′-GAGTTGCTGTTGAAGTCGCA-3′。
六、胰腺组织LC3及p62表达检测
取冻存的胰腺组织,应用RIPA裂解液试剂提取总蛋白,使用BCA法测定蛋白浓度后常规行蛋白质印迹法检测LC3及p62蛋白,以GAPDH作为内参。LC3及p62一抗工作浓度 1∶1 000,最后ECL发光,X片曝光、显影、定影。LC3蛋白经分离后出现2个条带,分子质量较大的为LC3-Ⅰ,较小的为LC3-Ⅱ。采用Image J软件进行条带扫描,以目的条带与内参条带的灰度值比表示蛋白相对表达量,并计算LC3-Ⅱ/LC3-Ⅰ值。
七、统计学处理
结 果
一、各组血清淀粉酶及脂肪酶比较
与对照组比较,AP组血清淀粉酶[(17 290±500)U/L比(2 700±100 )U/L]、脂肪酶[(520±40)U/L比(70±20 )U/L]均显著上升;与AP组比较,PAG组淀粉酶[(13 750±2 000)U/L]、脂肪酶[(370±20)U/L]均显著下降,而NaHS组淀粉酶[(27 784±1 200)U/L]、脂肪酶、(900±80)U/L]均显著升高,差异均有统计学意义(P值均<0.05)。
二、各组血清H2S含量比较
AP组小鼠血清H2S含量较对照组显著升高[(31.3±3.0)mmol/L比(22.9±1.7)mmol/L];PAG组血清H2S含量[(24.5±2.1)mmol/L]较AP组显著下降,而NaHS组[(38.6±3.3)mmol/L]较AP组显著升高,差异均有统计学意义(P值均<0.05)。
三、各组胰腺组织病理学改变
对照组胰腺小叶形态正常;AP组胰腺小叶间水肿明显,炎症细胞浸润,腺泡结构破坏;NaHS组胰腺组织病变较AP组加重,炎症细胞浸润增多,水肿及细胞结构破坏更加明显;而PAG组较AP组胰腺组织病变减轻,炎症细胞浸润及水肿程度减轻(图1)。各组胰腺病理评分见表1。

图1 对照组(1A)、AP组(1B)、NaHS组(1C)、PAG组(1D)胰腺组织的病理改变(HE ×200)


组别只数水肿炎症坏死对照组150±00±00±0AP组153.0±0.0a2.6±0.1a1.8±0.1aNaHS组153.0±0.2a3.0±0.2ab2.1±0.2aPAG组153.0±0.0a2.1±0.2abc1.4±0.2abc
注:与对照组比较,aP<0.05;与AP组比较,bP<0.05;与NaHS组比较,cP<0.05
四、各组胰腺组织CSEmRNA表达量比较
与对照组比较,AP组胰腺组织CSEmRNA的表达量升高(5.4±0.4比1.0±0.1);与AP组比较,PAG组CSEmRNA表达量(4.2±0.5)显著下降,而NaHS组CSEmRNA表达量(6.9±0.9)显著升高,差异均有统计学意义(P值均<0.05)。
五、各组胰腺组织LC3-Ⅱ/LC3-Ⅰ值及p62表达量比较
AP组LC3-Ⅱ/LC3-Ⅰ值及p62的表达量均显著高于对照组(1.184±0.120比0.419±0.080,1.985±0.210比0.227±0.140),NaHS组LC3-Ⅱ/LC3-Ⅰ值 (1.600±0.210) 及p62表达量(4.229±0.050)较AP组进一步升高,而PAG组LC3-Ⅱ/LC3-Ⅰ值(0.745±0.130) 及p62表达量(1.203±0.080) 较AP组显著下降,差异均有统计学意义(P值均<0.05 ,图2)。
讨 论
H2S是一种无色却具有臭鸡蛋气味的气体,近300多年来,人们一直以为其是有毒的废气,直到1989年,Warenyeia等[6]在脑组织中检测到了H2S。
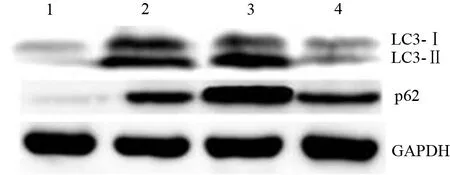
图2 对照组(1)、AP组(2)、NaHS组(3)、PAG组(4)胰腺组织LC3及p62蛋白的表达
近年来,随着研究的不断深入,人们发现H2S作为一种新型的气体信号分子广泛分布于体内多种器官和组织中,在许多生理病理活动中都起着非常重要的作用,如调节自噬及凋亡、抗氧化、抗炎、舒张血管、神经保护等[7]。生理状态下,内源性H2S有2种存在形式,其中有2/3的H2S以NaHS的形式存在,另外1/3以H2S气体分子的形式存在,两者之间存在着动态平衡。哺乳动物体内,H2S合成酶主要有3种,CSE、胱硫醚-β合成酶(cystathionineβ-synthase,CBS)以及3-巯基丙酮酸盐硫转移酶(3-mercaptopyruvatesulfurtransferase, 3MTS)。在中枢神经系统内,其合成酶主要是CBS,而外周组织中H2S主要是通过CSE合成。虽然H2S对AP的作用已有相关报道,但主要倾向于对炎症反应的研究,且其在AP炎症反应中表现出抗炎和促炎的双重作用,而H2S在AP时对自噬通路功能的影响尚未见相关研究报道。
自噬是真核细胞内所特有的消化通路,通过降解和回收利用受损细胞成分及大分子物质等有害成分,不仅可以清除受损细胞,还可以为细胞提供营养物质和能量[8]。自噬对维持细胞内环境及分解代谢过程的稳定非常重要,当细胞受到外界不良刺激或者缺乏能量时自噬会迅速上调,在饥饿的情况下,细胞内自噬水平也会上调。自噬是先通过双层膜包裹细胞内待降解产物形成自噬体,自噬体再与溶酶体结合形成自噬溶酶体,然后再通过自噬溶酶体内多种溶酶体酶降解内容物的过程,该过程具有动态性、溶酶体依赖性及细胞适应等特点[9]。LC3是自噬的特异性标志物,胞质中存在的可溶性的形式为LC3-Ⅰ,当自噬发生时,LC3-Ⅰ脂化成LC3-Ⅱ,LC3-Ⅱ定位于自噬体膜上,参与自噬体膜的延伸及闭合。LC3-Ⅱ与LC3-Ⅰ的比值大小可以反映自噬水平的高低[1]。在自噬过程中,p62负责识别及递送泛素化蛋白进入自噬降解通路,因其本身也是自噬通路的特异性降解产物,所以其也是自噬降解能力的重要评价指标[10]。因此,LC3-Ⅱ/LC3-Ⅰ联合p62被认为是监测自噬通路功能状态的经典指标,LC3-Ⅱ增高而p62下降,提示自噬被诱导且自噬功能正常,而两者同时升高则提示自噬降解通路受阻,功能出现障碍[11]。本研究结果显示,雨蛙素诱导AP模型后12h胰腺组织LC3-Ⅱ/LC3-Ⅰ升高,p62蛋白表达上调,提示AP存在自噬受阻情况。
AP时腺泡细胞内出现许多非正常的自噬空泡,且自噬溶酶体的功能降低,自噬效率下降,表现为长寿蛋白降解速率减慢以及p62蛋白表达的增加,使得大量的酶原颗粒在自噬溶酶体内异常激活。有研究表明,敲除AP小鼠胰腺腺泡的自噬调控相关基因Atg5后,可明显减轻小鼠AP的严重程度,且减少细胞内胰蛋白酶原的异常激活[12]。还有研究发现,AP时诱导自噬,胰腺炎的严重程度会加重,相反,抑制自噬,可减轻胰腺炎的严重程度[13]。因此,抑制或诱导自噬对减轻或加重AP具有极其重要的作用。本研究结果显示,给予外源性H2S后AP小鼠血清淀粉酶及脂肪酶含量升高,胰腺组织CSEmRNA表达显著上调,LC3-Ⅱ/LC3-Ⅰ进一步升高,p62蛋白表达进一步上调,提示给予外源性H2S能够加重自噬通路功能的损伤,加重AP严重程度。使用CSE抑制剂PAG后小鼠血清淀粉酶及脂肪酶含量下降,CSEmRNA表达下调,LC3-Ⅱ/LC3-Ⅰ及p62蛋白表达下降,提示抑制H2S合成能改善AP时自噬功能受损状况,减轻AP的严重程度。
[1]ChinzeiR,MasudaA,NishiumiS,etal.VitaminK3attenuatescerulein-inducedacutepancreatitisthroughinhibitionoftheautophagicpathway[J].Pancreas, 2011, 40(1): 84-94.DOI: 10.1097/MPA.0b013e3181f69fc9.
[2]HashimotoD,OhmurayaM,HirotaM,etal.Involvementofautophagyintrypsinogenactivationwithinthepancreaticacinarcells[J].JCellBiol, 2008, 181(7): 1065-1072.DOI:10.1083/jcb.200712156.
[3]ThomesPG,TramblyCS,ThieleGM,etal.Proteasomeactivityandautophagosomecontentinliverarereciprocallyregulatedbyethanoltreatment[J].BiochemBiophysResCommun, 2012, 417(1): 262-267.DOI: 10.1016/j.bbrc.2011.11.097.
[4] 王刚,孙备,姜洪池,等.硫化氢与急性胰腺炎的研究进展[J].中华肝胆外科杂志,2010,16(3):238-240.DOI:10.3760/cma.j.issn.1007-8118.2010.03.030.
[5] 韩冰,孙备,姜洪池,等.气体信号分子在急性胰腺炎中作用的研究进展[J].中华外科杂志,2012,50(11):1036-1038.DOI:10.3760/cma.j.issn.0529-5815.2012.11.019.
[6]WarenyeiaMW,GoodwinLR,BenishinCG,etal.Acutehydrogensulfidepoisoning.Demonstrationofselectiveuptakeofsulfidebythebrainstembymeasurementofbrainsulfidelevel[J].BiochemPharmacol,1989,38(9):973-981.
[7]KimuraH,NagaiY,UmemuraK,etal.Physiologicalrolesofhydrogensulfide:synapticmodulation,neuroprotection,andsmoothmusclerelaxation[J].AntioxidRedoxSignal, 2005, 7(5-6): 795-803.DOI:10.1089/ars.2005.7.795.
[8] 孙浩林,李淳德.气体信号分子硫化氢在调节细胞凋亡和自噬中的作用[J].中华医学杂志,2013,93(31):2520-2522.DOI:10.3760/cma.j.issn.0376-2491.2013.31.024.
[9] 刘晓,湛先保.自噬及其在急性胰腺炎中的研究进展[J].中华消化杂志,2012,32(9):647-648.DOI:10.3760/cma.j.issn.0254-1432.2012.09.023.
[10]RyterSW,CloonanSM,ChoiAM.Autophagy:acriticalregulatorofcellularmetabolismandhomeostasis[J].MolCells, 2013, 36(1): 7-16.DOI:10.1007/s10059-013-0140-8.Epub2013May24.
[11]GukovskayaAS,GukovskyI.Autophagyandpancreatitis[J].AmJPhysiolGastrointestLiverPhysiol, 2012, 303(9):G993-G1003.DOI:10.1152/ajpgi.00122.2012.Epub2012Sep6.
[12]HashimotoD,OhmurayaM,HirotaM,etal.Involvementofautophagyintrypsinogenactivationwithinthepancreaticacinarcells[J].JCellBiol, 2008, 181(7): 1065-1072.DOI:10.1083/jcb.200712156.
[13]HuYY,ZhouCH,DouWH,etal.ImprovedautophagicfluxiscorrelatedwithmTORactivationinthelaterrecoverystageofexperimentalacutepancreatitis[J].Pancreatology, 2015, 15(5): 470-477.DOI:10.1016/j.pan.2015.06.004.
(本文编辑:冀凯宏)
The effects of H2S and its synthetase inhibitor on the autophagy in acute pancreatitis mice
XuLingling,FengHui,YinGuojian,ZhouChunhua,WangShaofeng.
DepartmentofGastroenterology,SecondAffiliatedHospitalofSoochowUniversity,Suzhou21500,China
Objective To investigate the effect of H2S and its synthetase inhibitor propargylglycine (PAG) on the autophagic function in caerulein-induced acute pancreatitis (AP) mice. Methods A total of 60 male BALB/c mice were randomly divided into control, AP, NaHS and PAG group using random number method. AP was induced in mice via hourly intraperitoneal injection of caerulein (50 μg/kg) continuously for 6 hours. NaHS and PAG group received NaHS (10 mg/kg) or PAG (50 mg/kg) 1 h before the AP induction. A equal volume of normal saline solution was injected in control group and AP group. All the mice were killed at 12 h after the first caerulein injection and blood sample was collected for the detection of serum amylase and lipase content. Deproteinization spectrometry was used to detect serum H2S content, and pancreatic tissue was pathological examined and scored. Real-time PCR detected mRNA expression of CSE, and the protein expression of LC3-Ⅱ/LC3 Ⅰ and p62 was measured using Western blot. Results Serum amylase, lipase,H2S, CSE mRNA, LC3 Ⅱ/LC3 Ⅰ and p62 were (2 700±100)U/L, (70±20)U/L,(22.9±1.7)mmol/L,1.0±0.1,0.419±0.080, 0.227±0.140 in control group; (17 290±500)U/L,(520±40)U/L, (31.3±3.0)mmol/L, 5.4±0.4, 1.184±0.120, 1.985±0.210 in AP group; (27 784±1 200)U/L,(900±80)U/L,(38.6±3.3)mmol/L, 6.9±0.9,1.600±0.210, 4.229±0.050 in NaHS group; (13 750±2 000)U/L,(370±20)U/L,(24.5±2.1)mmol/L, 4.2±0.5, 0.745±0.130, 1.203±0.080 in PAG group. All those biomarkers detected above in AP group significantly increased compared with control group, which were much lower than those in NaHS group, but higher than those in PAG group, and the differences were statistically significant (allP<0.05). Pancreatic histological damage in NaHS group was more severe than that in AP group, which in PAG group was less severe than that in AP group. Conclusions PAG could greatly decrease serum amylase and lipase level, and reduce the damage on autophagy and the severity of AP.
Pancreatitis; Hydrogen sulfide; Propargylglycine; Autophagy
10.3760/cma.j.issn.1674-1935.2016.06.007
215000 江苏苏州,苏州大学附属第二医院消化科
王少锋,Email: sfwang59@sina.cn
2016-09-01)
