FHL1在慢性胰腺炎胰腺组织中的表达及其临床意义
2016-12-22王慧魏娟刘烔汪芳裕
王慧 魏娟 刘烔 汪芳裕
·论著·
FHL1在慢性胰腺炎胰腺组织中的表达及其临床意义
王慧 魏娟 刘烔 汪芳裕
目的 探讨细胞转录调节因子FHL1在慢性胰腺炎(CP)胰腺组织中的表达及其临床意义。方法 采集南京军区南京总医院消化内科收治的20例CP患者和同期体检合格的健康者血清,采用酶联免疫吸附试验法检测血清FHL1水平。取20只雄性Wistar大鼠,按体重随机分成对照组和CP组。通过大鼠尾静脉注射二丁基二氯化物建立CP模型。建模后28 d处死大鼠,分离大鼠胰腺,HE染色观察胰腺组织的病理变化。采用免疫组织化学染色法和蛋白质印迹法检测胰腺组织FHL1的表达。结果 CP患者、健康对照者血清FHL1水平分别为(0.86±0.22)、(1.18±0.22)g/L,CP患者血清FHL1水平显著低于健康者,差异具有统计学意义(t=10.54,P=0.001)。CP组大鼠胰腺小叶结构破坏,腺泡萎缩变形,纤维组织增生明显,其胰腺组织异常结构、腺泡萎缩、纤维化、炎性细胞浸润的病理评分分别为(2.2±0.4)、(2.0±0.7)、(2.4±0.3)、(2.8±0.6)分,对照组均为0分,两组差异具有统计学意义(t值分别为17.24、9.01、25.22、14.75,P值均<0.001)。CP组大鼠胰腺组织FHL1蛋白表达量显著低于对照组,差异具有统计学意义(免疫组织化学法:15 798±3 247比37 570±9 254,t=2.438,P=0.016;蛋白质印迹法:0.44±0.11比0.89±0.03,t=4.289,P=0.002)。结论 FHL1蛋白在CP胰腺组织中低表达,可能参与胰腺纤维化的形成。
胰腺炎,慢性; 转录调节成分; 纤维化; FHL1
Fund program: National Natural Science Foundation of China (81270453)
FHL1(four and a half LIM) 蛋白是一种细胞骨架相关蛋白,广泛参与蛋白质之间的相互作用。近年来研究发现FHL1具有抑制肿瘤生长作用[1]。研究报道,FHL1蛋白在胰腺癌中低表达,参与胰腺癌的发生过程[2]。慢性胰腺炎(CP)与胰腺癌的发生关系密切[3-5],其中,胰腺纤维化是CP与胰腺癌共同的病理标志。为探讨FHL1蛋白与CP的关系,本研究采用成组设计、随机对照的方法检测CP胰腺组织FHL1蛋白的表达,探讨其临床意义。
材料与方法
一、临床患者血清标本
选择2014年8月至2015年10月间南京军区南京总医院消化内科确诊、临床资料完整的20例CP患者,其中男性12例,女性8例,年龄42~58岁,平均年龄48岁。选择体检合格的健康者20名作为对照,其中男性9例,女性11例,年龄38~65岁,平均年龄52岁。CP患者于入院后第1天空腹抽取外周静脉血2 ml,离心收集血清,同法收集健康者的血清,血清分装后冻存于深低温冰箱。本研究符合南京总医院伦理委员会制定的伦理标准,两组成员均签署知情同意书。
二、实验动物及分组
20只清洁级雄性Wistar大鼠购于江苏常州卡文斯实验动物有限公司,6~8周龄,体重(190±10)g,饲养1周后按体重随机分为对照组和CP组,每组10只。CP组参考文献[6],采用尾静脉注射二丁基二氯化物(dibutyltin dichloride, DBTC)8 mg/kg体重的方法诱导大鼠慢性胰腺纤维化。对照组尾静脉注射等容积生理盐水。28 d后处死动物,取胰腺组织,部分用10%多聚甲醛固定,部分置-80℃冰箱保存。
三、检测指标
1.人血清FHL1水平检测:采用酶联免疫吸附试验(ELISA)法检测CP患者和健康对照者血清FHL1水平。ELISA检测试剂盒购置于武汉华美生物公司,按说明书操作。根据标准品的A450值绘制标准曲线,获取二元方程式,计算待测标本FHL1水平。
2.大鼠胰腺组织病理学检查:取甲醛固定的大鼠胰腺组织,经脱水、石蜡包埋、切片、HE染色,光镜观察胰腺组织病理变化,并参照van Westerloo等[7]的方法,从异常结构、腺泡萎缩、纤维化、炎性细胞浸润4个方面进行病理评分。
3.大鼠胰腺组织FHL1蛋白表达检测:取上述切片,采用免疫组织化学SP染色法检测FHL1蛋白表达。兔抗鼠FHL1一抗购于美国Abcam抗体公司(ab49241),工作浓度1∶200。以PBS代替一抗作为阴性对照。羊抗兔二抗、HRP工作液以及DAB显色液均购于福州迈新生物有限公司。细胞质内出现棕黄色颗粒为阳性染色。高倍镜下随机选取3个视野进行观察并拍照,通过图像分析软件Image-proplus-6根据染色范围和染色强度测量出A50值。
同时,取-80℃冰箱保存的胰腺组织20 mg,加入100 μl组织裂解液提取组织蛋白,经BCA法定量后常规行蛋白质印迹法检测胰腺组织FHL1蛋白表达。以β-Tbulin为内参。兔抗鼠FHL1抗体工作浓度1∶2 000;羊抗兔二抗(D110063)购自上海生工生物工程有限公司,工作浓度1∶1 000。最后ETC发光,X线片曝光、显影、定影。采用Image J软件扫描图片,获取条带灰度值,以目的条带与内参条带的灰度值比表示蛋白相对表达量。
四、统计学处理

结 果
一、人血清FHL1蛋白水平
CP患者血清FHL1蛋白水平为0.99~1.29g/L,平均(0.86±0.22)g/L,健康者血清FHL1蛋白水平为0.7~1.10g/L,平均(1.18±0.22)g/L。CP患者血清FHL1水平显著低于健康者,差异具有统计学意义(t=10.54,P=0.001)。
二、大鼠胰腺组织病理变化
造模28d后对照组大鼠胰腺组织质地柔软,色泽白亮;镜下见胰腺小叶轮廓清晰,腺泡细胞形态饱满呈锥体形,排列整齐有序,未见炎性细胞浸润及纤维组织增生。CP组大鼠胰腺组织色泽黄白,质地偏硬;镜下见胰腺小叶结构破坏严重,轮廓不清,间质内大量纤维组织增生,腺泡细胞萎缩、坏死和空泡样变性,小叶间和腺泡内有大量炎性细胞浸润(图1)。CP组胰腺组织异常结构、腺泡萎缩、纤维化、炎性细胞浸润的病理评分分别为(2.2±0.4)、(2.0±0.7)、(2.4±0.3)、(2.8±0.6)分,对照组均为0分,两组差异具有统计学意义(t值分别为17.24、9.01、25.22、14.75,P值均<0.001),表明CP造模成功。

图1 对照组(1A)、CP组(1B)大鼠胰腺组织病理变化 (HE ×200)
三、大鼠胰腺组织中FHL1蛋白表达量的变化
免疫组织化学法结果显示,对照组、CP组大鼠胰腺组织FHL1蛋白表达的A50值分别为37 570±9 254、15 798±3 247,CP组显著低于对照组,差异有统计学意义(t=2.438,P=0.016,图2)。
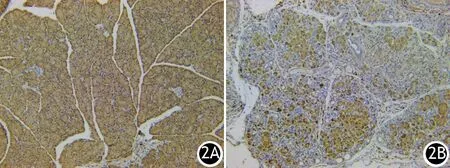
图2 对照组(2A)、CP组(2B)大鼠胰腺组织FHL1蛋白表达 (免疫组化 ×200)
蛋白质印迹法结果显示,对照组、CP组大鼠胰腺组织FHL1蛋白相对表达量分别为0.89±0.03、0.44±0.11。CP组大鼠胰腺组织FHL1蛋白表达量显著低于对照组,差异具有统计学意义(t=4.289, P=0.002, 图3)。
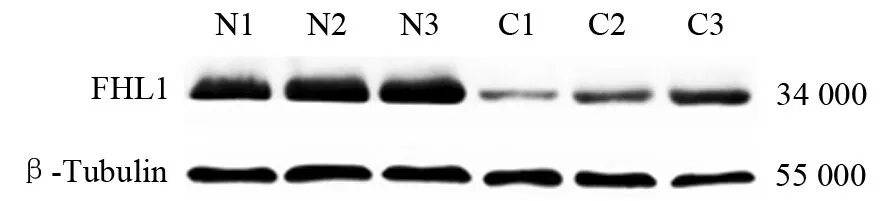
图3 对照组(N1~N3)、CP组(C1~C3)大鼠胰腺组织FHL1蛋白表达 (蛋白质印迹法)
讨 论
CP的年发病率为5~12/10万,患病率约为50/10万,男性占比较多[8]。CP发病的具体机制尚不完全清楚,其发生主要与酗酒、吸烟、肥胖、药物暴露、血型及自身免疫等因素有关,其中酗酒是CP最常见的致病因素[9-10]。
FHL1蛋白是一种细胞骨架相关蛋白,隶属于LIM蛋白超家族中的FHL蛋白家族。FHL蛋白家族的特点是拥有4.5个的LIM蛋白结构域,为FHL1调节蛋白相互作用的功能提供了结构基础。文献报道,FHL1广泛分布于心、脑、肺、肌肉等不同器官和组织中,尤其在心肌和骨骼肌高表达,它参与调控细胞转录因子和细胞骨架蛋白的表达和活性,在器官和组织分化及发育过程中发挥重要作用[11-12]。近年来,采用微阵列分析和免疫组织化学染色法对人类肿瘤的临床研究结果发现,FHL1蛋白在胰腺癌、胃癌、结肠癌、肝癌、乳腺癌、肾癌、皮肤癌等肿瘤组织中表达降低[1-2,13],而上调FHL1蛋白表达可显著抑制肿瘤细胞的生长[14]。因此,FHL1作为抑癌基因而被深入研究。
目前,慢性炎症与肿瘤发生之间的联系已经得到公认,比如食管癌与Barretts化生、结直肠癌与炎症性肠病、溃疡性结肠炎和克罗恩病等[15]。CP患者罹患胰腺癌的相对危险度为13.3,其诱发胰腺癌的风险是一般人群的15~16倍[3,5]。因此,对于CP发病机制的研究和易患人群的早期筛查与诊断,具有重要的临床意义。
本研究结果显示,CP大鼠胰腺组织FHL1蛋白低表达,CP患者血清FHL1水平较健康者低,提示FHL1蛋白可能参与CP的纤维化进程,可以作为CP诊断的一个辅助指标和诊断依据。但本研究只是对FHL1参与CP的纤维化过程进行了初步探讨,而对于FHL1参与调控CP的胰腺纤维化的具体细胞和分子机制亟待更进一步深入研究。
[1]ShathasivamT,KislingerT,GramoliniAO.Genes,proteinsandcomplexes:themultifacetednatureofFHLfamilyproteinsindiversetissues[J].JCellMolMed, 2010, 14(12): 2702-2720.DOI: 10.1111/j.1582-4934.2010.01176.x.
[2] 刘哲, 许元鸿, 龙锦, 等.FHL1在人胰腺癌族中的表达及其与胰腺癌的侵袭及转移的相关性研究 [J]. 临床与病理杂志, 2015, 35(3): 423-427.DOI:10.3978/j.issn.2095-6959.2015.03.019.
[3]RaimondiS,LowenfelsAB,Morselli-labateAM,etal.Pancreaticcancerinchronicpancreatitis;aetiology,incidence,andearlydetection[J].BestPractClinGastroenterol, 2010, 24(3): 349-358.DOI: 10.1016/j.bpg.2010.02.007.
[4]JuraN,ArcherH,Bar-sagiD.Chronicpancreatitis,pancreaticadenocarcinomaandtheblackboxin-between[J].CellRes, 2005, 15(1): 72-77.DOI:10.1038/sj.cr.7290269.
[5]VakkilaJ,LotzeMT.Inflammationandnecrosispromotetumourgrowth[J].NatRevImmunol, 2004, 4(4): 641-648.DOI: 10.1038/nri1415.
[6] 陈浩宇, 王茜, 陈洁.IL-18及趋化因子CX3CL1在慢性胰腺炎大鼠胰腺纤维化中的表达及其意义[J]. 中华胰腺病杂志, 2016, 16(2): 115-118.DOI: 10.3760/cma.j.issn.1674-1935.2016.02.009.
[7]VanWesterlooDJ,FlorquinS,deBoerAM,etal.Therapeuticeffectsoftroglitazoneinexperimentalchronicpancreatitisinmice[J].AmJPathol, 2005, 166(3): 721-728.DOI: 10.1016/S0002-9440(10)62293-6.
[8]HirotaM,ShimosegawaT,MasamuneA,etal.ThesixthnationwideepidemiologicalsurveyofchronicpancreatitisinJapan[J].Pancreatology, 2012, 12(2): 79-84.DOI: 10.1016/j.pan.2012.09.001.
[9]CoteGA,YadavD,SlivkaA,etal.AlcoholandSmokingasRiskFactorsinanEpidemiologyStudyofPatientsWithChronicPancreatitis[J].ClinGastroenterolHepatol, 2011, 9(3): 266-273.DOI: 10.1016/j.cgh.2010.10.015.
[10]YadavD,LowenfelsAB.Theepidemiologyofpancreatitisandpancreaticcancer[J].Gastroenterology, 2013, 144(6): 1252-1261.DOI: 10.1053/j.gastro.2013.01.068.
[11]SchesslJ,FeldkirchnerS,KubnyC,etal.ReducingbodymyopathyandotherFHL1-relatedmusculardisorders[J].SeminPediatrNeurol, 2011, 18(4): 257-263.DOI: 10.1016/j.spen.2011.10.007.
[12]ShalabyS,HayashiYK,NonakaI,etal.NovelFHL1mutationsinfatalandbenignreducingbodymyopathy[J].Neurology, 2009, 72(4): 375-376.DOI: 10.1212/01.wnl.0000341311.84347.a0.
[13]SakashitaK,MimoriK,TanakaF,etal.ClinicalsignificanceoflossofFhl1expressioninhumangastriccancer[J].AnnSurgOncol, 2008, 15(8): 2293-300.DOI: 10.1245/s10434-008-9904-3.
[14]DingI,NiuC,ZhengY,etal.FHL1interactswithoestrogenreceptorsandregulatesbreastcancercellgrowth[J].JCellMolMed, 2011, 15(1): 72-85.DOI: 10.1111/j.1582-4934.2009.00938.x.
[15]OrlandoRC.Mechanismsofepithelialinjuryandinflammationingastrointestinaldiseases[J].RevGastroenterolDisord, 2002, 2Suppl2:S2-S8.
(本文编辑:屠振兴)
Expression of FHL1 and the significance in pancreatic fibrosis of chronic pancreatitis
WangHui,WeiJuan,LiuTong,WangFangyu.
DepartmentofGastroenterology,NanjingGeneralHospitalofNanjingMilitaryRegion,PLA,Nanjing21002,China
WangFangyu,Email:wangfangyu2014@126.com
Objective To explore the expression of transcriptional regulation factor FHL1 in pancreatic fibrosis of chronic pancreatitis (CP) and clinical significance. Methods Serum samples from 20 CP patients treated in the Department of Gastroenterology, Nanjing General Hospital and 20 healthy controls in the corresponding period were collected. The level of FHL1 in the serum was detected by ELISA. Twenty male Wistar rats were randomly divided into control group and CP group according to the body weight. The CP rat model was established by injecting dibutyltin dichloride (DBTC) through tail vein. All the rats were killed at 28 days after injection and the pancreas was collected, which was observed using hematoxylin and eosin (HE) staining to investigate pathological changes. The expression of FHL1 in pancreas was measured by immunohistochemistry (IHC) and Western blotting (WB). Results The average of serum FHL1 level in two groups were (0.86±0.22)g/L and (1.18±0.22)g/L, respectively. The level of FHL1 in serum of CP patients was significantly lower than that of healthy cases, and the difference was statistically significant (t=10.54,P=0.001). Damaged pancreatic lobular structure, acinar atrophy and the obvious fibrous hyperplasia were observed in CP rats. The pathological score of abnormal structure, acinar atrophy, fibrosis,and inflammatory cell infiltration in the pancreas of the CP group was (2.2±0.4),(2.0±0.7),(2.4±0.3) and (2.8±0.6), respectively, but was all 0 in control group. The difference between two group was statistically significant (tvalue=17.24, 9.01, 25.22 and 14.75, respectively, allP<0.001). The expression of FHL1 in the pancreatic tissue of CP group were less than that of normal group, and the difference was statistically significant (IHC: 15 798±3 247vs37 570±9 254,t=2.438,P=0.016; WB: 0.44±0.11vs0.89±0.03,t=4.289,P=0.002). Conclusions The protein of FHL1 was in low expression in the pancreas of CPs, indicating that FHL1 may participate in the formation of pancreatic fibrosis.
Pancreatitis, chronic; Colon, descending; Fibrosis; FHL1
10.3760/cma.j.issn.1674-1935.2016.06.009
210002 南京,南京军区南京总医院消化内科
汪芳裕,Email: wangfangyu2014@126.com
国家自然科学基金面上项目(81270453)
2016-07-12)
